查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






作者:复旦大学附属中山医院心内科 黄浙勇 副主任医师
胸痛中心的建立对快速救治急性心肌梗死(AMI)居功至伟。“时间就是心肌,就是生命”,病人一旦胸痛,将被绿色通道短时间被输送至导管室。硬要鸡蛋里挑骨头的话,快速是仓促的近义词,过分强调速度往往意味着牺牲质量。因此,特殊类型的“AMI”往往在第一条防线(临床防线)不能识别,被迫转移到第二条防线(造影防线)。介入医生除了修炼介入基本功之外,也应抓紧临床基本功,及时识别一些隐身在“AMI”背后的元凶。
主动脉夹层(Aortic Dissection,AD)累及冠脉开口、继发AMI罕见,但误诊率和病死率极高。临床上常被诊断为一般的AMI,但其治疗显然有别于单纯AMI:
①药物治疗禁止溶栓,避免抗栓、抗凝;
②造影并非禁忌,但介入操作耽误外科处理时机、甚至扩展夹层;
③需要尽早外科手术。因此,急诊造影如能敏锐的捕捉到AD的蛛丝马迹,对AD的及早诊治意义重大。
本文以病例为引子,从影像、临床二个方面梳理主动脉夹层并发AMI的提示线索。
病例1
54岁男性吸烟患者,持续性剧烈胸痛15小时。伴冷汗,晕厥1次。当地诊断为AMI伴低血压休克,多巴胺静滴后转至我院。患者休克貌,心率104bpm,血压114 / 72mmHg(多巴胺5 µg/kg/min)。心电图示窦性心动过速,II度I型房室传导阻滞,急性下壁右室心肌梗死(图1)。急查cTnT 5.670ng/ml;肌红蛋白914.5ng/ml,NT-proBNP 469.5pg/ml,D二聚体 2.99mg/L。诊断为急性下壁右室心肌梗死,行直接PCI治疗。
急诊造影见左冠除前降支心肌桥外无明显狭窄,右冠开口次全闭塞,导管注射硝酸甘油100ug*2次无缓解。右冠开口至近段快速植入4.0×20mm药物洗脱支架(图2)。术后安返CCU,3 µg/kg/min多巴胺维持下血压110/70 mmHg,心率100 bpm。
术中总感觉哪里不对劲。首先是右冠造影时导管到位难度较大;其次是孤立性右冠开口次全闭塞,不能用导管头诱发痉挛解释;其次是支架释放前右冠开口明明定位精确良好,在无呼吸心跳影响定位的情况下,最后造影居然提示右冠开口2-3mm并无支架覆盖。术后仔细复盘,发现其他不少影像学疑点,如升主动脉管腔形态改变(变平直,变窄)、中度主动脉瓣返流、主动脉根部右侧可疑造影剂残留等等。一个可怕的诊断浮现于脑海:升主动脉夹层!患者经CTA和心超证实患者为Startford A型主动脉夹层(图4)。
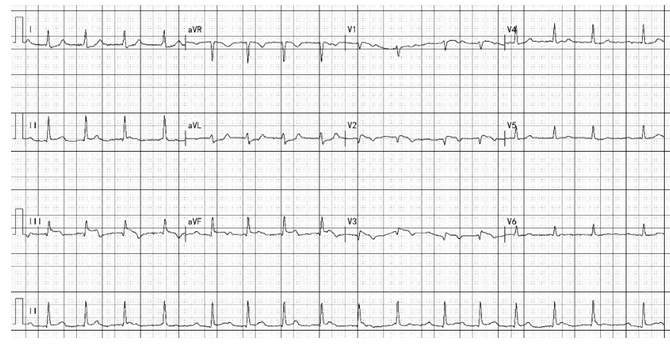
图1 入院心电图
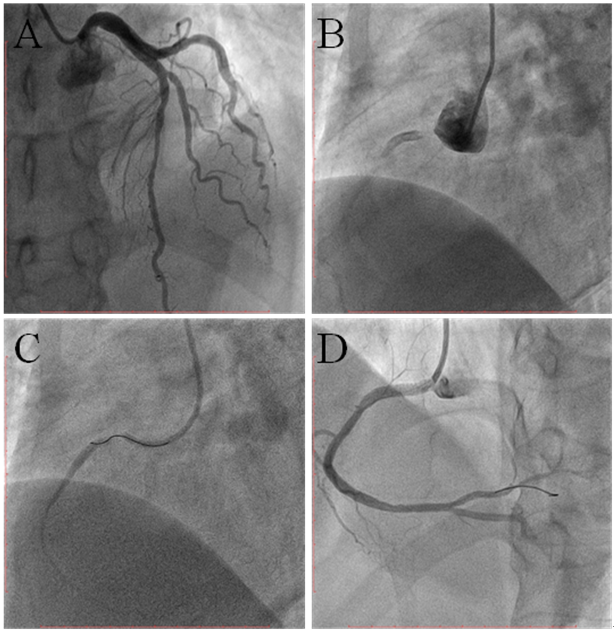
图2 急诊PCI过程
A、左冠造影;B、右冠造影;C、导丝通过狭窄开口;D、支架后结果

图3 介入疑点
A、孤立性右冠开口狭窄;B、升主动脉管腔形态改变(变平直,变窄)和主动脉瓣返流;C、可疑的夹层直接征象;D、意外的右冠开口支架覆盖不全
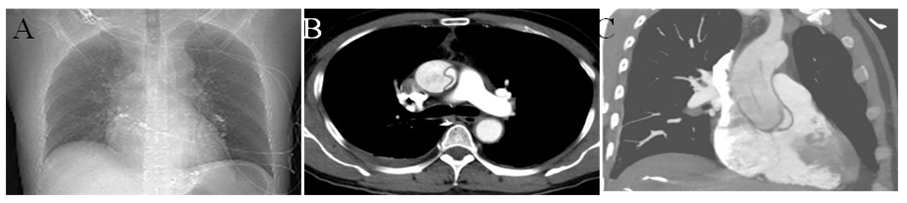
图4 CTA证实A型主动脉夹层
亡羊补牢:急诊PCI识别AD魅影
根据AD的发病机制和病理学特点,在详细回顾复旦大学附属中山医院历年病例、搜索Pubmed相关个案报道[1-13]的基础上,我们尝试总结直接PCI提示AD的线索(图5)。我们认为,急诊冠脉造影和介入治疗过程中,如发现以下情况应警惕AD:
(1)后前位透视上纵膈增宽。
(2)难以找到冠脉开口。由于升主动脉管腔变形影响造影导管操作、冠脉开口变形、位移或闭塞等原因,造影导管口常常难以顺利到位,需要非选择性主动脉根部造影。
(3)升主动脉间接征象。非选择性主动脉根部造影可揭示一些经常被忽视的征象,包括升主动脉管腔形态变平直变窄,升主动脉外缘膨出与管腔距离增宽、不同程度的主动脉瓣返流等。
(4)孤立性冠脉开口狭窄。冠脉开口病变属于常见病,但其余冠脉节段基本正常的所谓“孤立性”开口病变往往提示特殊病因。需要警惕导管头刺激诱发痉挛或主动脉疾病累及冠脉口。主动脉血肿压迫显示为向心性或偏心性开口狭窄,边缘光滑;冠脉壁内血肿压迫显示为冠脉开口和近段向心性狭窄或发白;有时可观察到冠脉开口和近中段夹层直接征象。
(5)升主动脉直接征象:导管真腔造影有时可显示主动脉夹层直接征象;有时仅隐约显现微小夹层征象,需要仔细观察。偶尔导管直接进入主动脉假腔,轻轻冒烟发现造影剂滞留。
(6)PCI线索。如本例支架释放前定位良好,但释放后出现不可思议的开口覆盖不全征象。
一旦造影怀疑AD,应该做升主动脉造影。主动脉造影原先是诊断AD金指标,因有扩大夹层的潜在风险,目前已经被CTA替代。如患者已经下台,应立即心脏超声或CTA检查。更多案例详见文末病例精粹。
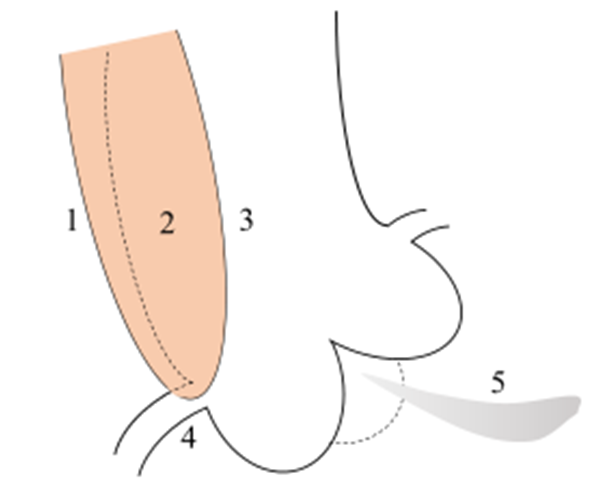
图5 冠脉造影提示主动脉夹层的常见征象示意图
1、后前位透视上纵膈增宽,升主动脉外缘膨出与管腔距离增宽;2、主动脉夹层直接征象;3、升主动脉管腔形态变平直变窄,造影导管口难以到位; 4、孤立性冠脉开口狭窄,开口精确定位效果不佳;5、主动脉瓣反流等
Startford A型AD导致心肌缺血的机制可简单概括为:压迫、剥离、断裂。这3种机制刚好对应Neri分型的3种亚型[14]:A型(压迫)是由于冠脉外血肿(如主动脉或心包血肿)对冠脉开口处的外在压迫,或主动脉内膜片堵塞冠脉开口,冠脉结构正常;B型(剥离)是由于主动脉夹层撕裂至冠脉,冠脉假腔对真腔的挤压;C型(断裂)是最严重的类型,冠状动脉从主动脉根部离断,直接导致冠脉阻塞(图1)。值得指出的是,逆向撕裂至冠脉开口的主动脉内膜片可形成“活瓣”,舒张期内膜片向主动脉瓣方向脱垂,从而导致间歇性冠脉阻塞[14]。该分型有助于心脏外科手术治疗的策略制定,但对心内科介入医生理解冠脉造影图像也大有裨益。
AD主要累及右冠,故下壁AMI更为常见,少数累及到左冠可导致前壁AMI。个中原因与主动脉和冠脉解剖位置有关。首先,胸主动脉呈现环形,血流动力学作用下,原始破口常位于主动脉环的外侧面,如升主动脉右前方,主动脉弓的后外侧,因此,假腔常位于主动脉外侧,真腔常位于内侧,这也是AD真假腔的鉴别方法之一。而右冠恰恰位于外侧缘。其次,AD逆行撕裂才累及冠脉口,越高者越容易累及。在冠脉造影时,感觉左冠开口位置高于右冠,这与升主动脉根部从左室向右前方发出有关。若以主动脉瓣环为基准,右冠开口位置实际上要高于左冠开口。
 示意图 A型主动脉夹层累及冠状动脉的Neri分型
示意图 A型主动脉夹层累及冠状动脉的Neri分型
A:主动脉血肿或活瓣,冠脉正常;B:冠脉血肿;C:冠脉离断。引自[15],略有着色修改
人间正道:造影前识别AD
血管造影曾被认为是AD诊断的“金标准”,因此造影发现AD并非“事故”。而且PCI和外科修复夹层并不相悖。不少学者报道,对于心源性休克等血流动力学不稳定的患者,PCI可以作为外科术前的桥接和过渡手段[1-13]。
但造影本身有创性(尤其是股动脉途径),可诱发或加重夹层;而且延误外科急诊手术时间。另外,造影发现主动脉夹层,假如有人追问“夹层是否是造影导管诱发”,百口莫辩。万一病人家属追问,想死的心都有。由此可见急诊造影前临床识别AD的重要性。急性胸痛拟诊为AMI患者,如果有以下“反常胸痛”和“反常血压状态”,应怀疑主动脉夹层可能:
(1)胸痛更严重、更持续、更广泛,不能完全用心肌梗死解释。如突发撕裂样疼痛,剧烈难以忍受,持续不缓解,可向背部、腹部、下肢、壁及颈部放射等。但这属于主观性指标,鉴别价值有限。
(2)胸痛和心电图不匹配。 AD发生和累及冠脉开口并非同步,AD胸痛在前,AMI在后,因此临床可表现为胸痛持续时间与心电图表现和肌钙蛋白升高程度不匹配。这需要医生洞悉AMI心电图和酶学动态变化规律。
(3)肌钙蛋白和D二聚体不匹配。ACS时冠脉血栓负荷远不及肺栓塞和AD, 因此D二聚体显著增高的胸痛应该怀疑肺栓塞和AD。
(4)高血压+休克外貌:AD患者因剧痛而有休克貌,焦虑不安、大汗淋漓、面色苍白、心率加速,但血压常不低或者反常增高。
(5)高血压+右室心肌梗死:AD最易累及右冠开口,表现为下后壁+右室AMI。右室MI常伴低血压,但一般相对容易纠正,经导管/静脉注入250mlNS血压可明显上升。如伴反常的高血压,应该高度警惕AD累及右冠可能性。反之,如低血压极难纠正,在排除机械合并症(如乳头肌断裂/功能不全,心脏破裂)的情况下,应考虑AD可能性。因为AD血肿严重阻断主动脉前向血流、合并严重主动脉瓣返流,外膜破裂出血/渗出时,可出现顽固性低血压。
(6)四肢血压差异大,桡动脉和/或足背动脉脉搏减弱、不对称。
(7)AD的其他特点。夹层血肿涉及主动脉瓣环或AD血肿严重阻断主动脉前向血流时发生,故可突然在主动脉瓣区出现舒张期吹风样杂音,脉压增宽。
一旦临床有上述表现,应及时进行大动脉CTA 检查,排除主动脉夹层后再进行抗血小板、抗凝、溶栓或介入手术等。对于急性心梗患者做个便携式心超,是一种有效的筛选方法,一来心超可以评估室壁运动异常、提供急性心梗的诊断依据,并评估心脏功能;二来排除主动脉夹层这一致命疾病。
外科处理
传统手术方法需缝闭冠脉开口行CABG手术,目前提倡尽可能冠脉修复手术:A型冠脉开口内膜完整,只需将冠脉开口直接吻合至人工主动脉(直接吻合法);B型需要切开冠脉清理血肿后,吻合至人工主动脉;C型需要切除部分冠脉开口部分,再经短段的静脉桥或人工血管连接到人工主动脉。
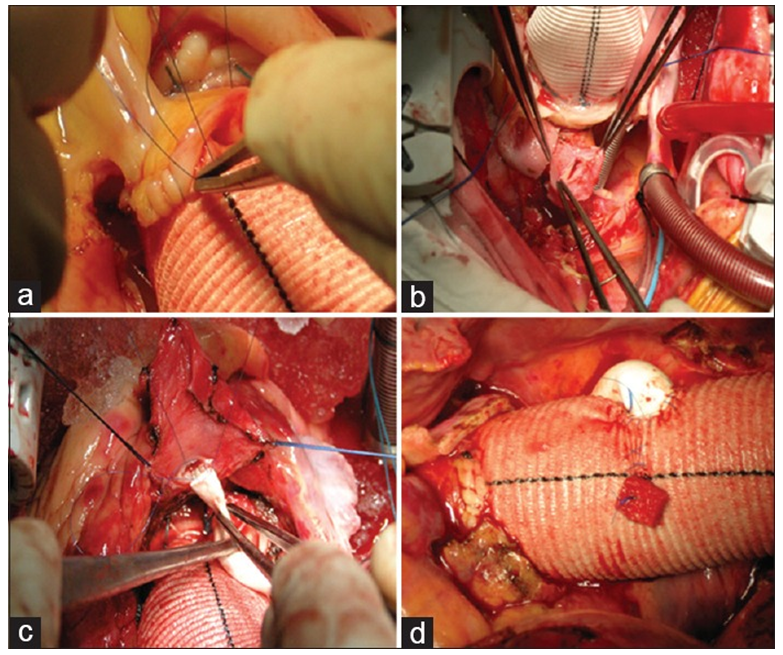
图6 冠脉修复手术
首先人工主动脉置换(a),切除损害的冠脉开口节段(b),再经短段的静脉桥或人工血管连接到人工主动脉(c-d)。[16]
A型主动脉夹层病例精粹
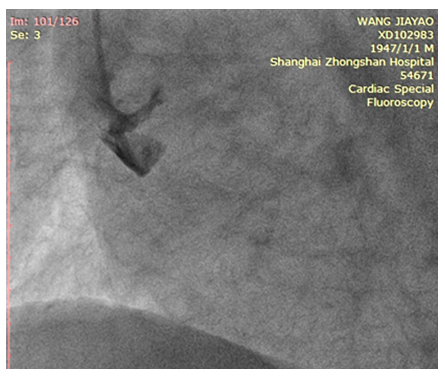
图7 AD患者冠造术中死亡
70岁男性,阵发性胸痛4天,1小时前晕厥1次 。心电图示窦性心动过速,II、III、Avf、V4 -V6 导联ST段弓背抬高1-2mm,提示急性下壁、前侧壁心肌梗死。急诊造影经右侧股动脉送入6F JR4导管送至升主动脉轻推造影剂提示主动脉夹层。术中病情恶化死亡,床旁超声示证实升主动脉瘤样扩张伴夹层,中大量心包积液。
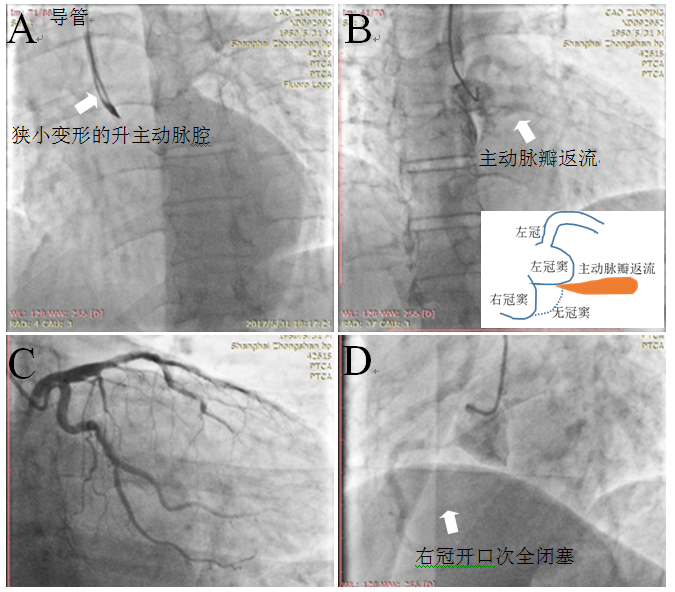
图8 AD累及右冠开口,次全闭塞
68岁男性,急性下壁STEMI。提示AD的冠脉造影征象,详见图注
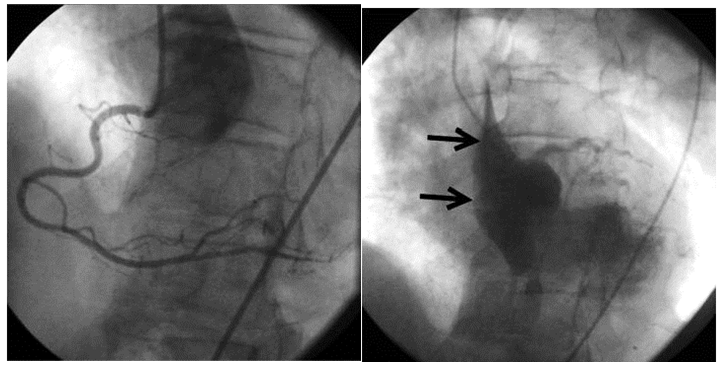
图9 AD累及右冠开口,严重狭窄
80岁男性,急性下壁AMI,选择性左冠造影未见狭窄,右冠开口严重狭窄(发白),主动脉造影进一步确诊为主动脉夹层,可见严重主动脉瓣反流。(2015 Circulation)
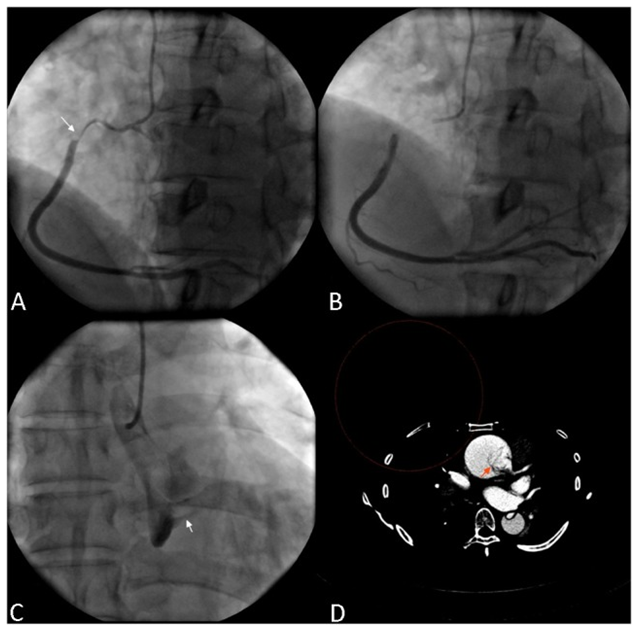
图10 AD累及右冠,右冠近中段夹层
56岁男性,急性下壁心肌梗死。造影显示右冠近中段严重狭窄,夹层样表现。升主动脉变窄,轻度主动脉瓣反流。CTA证实A型主动脉夹层[17]。
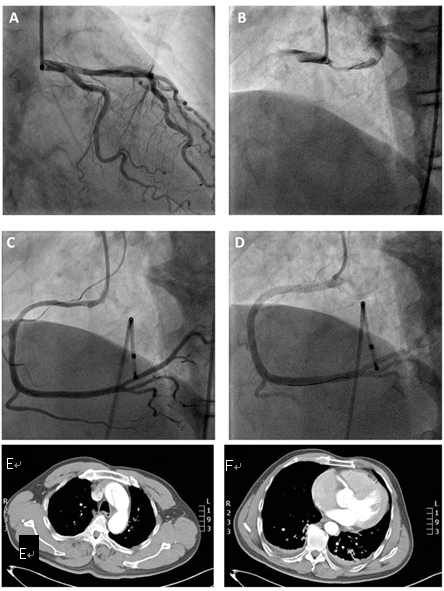
图11 AD累及右冠,近中段夹层
51岁高血压男性,急性下壁右室心肌梗死。造影显示左冠正常,右冠开口夹层。植入支架后结果良好(C-D)。术后CTA证实A型主动脉夹层(E-F)[11]。

图12 右冠窦瘤合并夹层累及右冠开口
37岁高血压男性患者,胸痛9小时。诊断为急性下后壁、右室心肌梗死,cTNT 0.182ng/ml,D-D 0.52mg/L。5F TIG导管造影见左冠未见明显狭窄,未找到右冠。6F JR4导管行右冠造影见右冠窦极其宽大(A),右冠开口至近中段狭窄99%,远段TIMI血流0-1级(B),考虑主动脉夹层撕裂至右冠口。胸腹主动脉CTA:主动脉根部近右冠窦处瘤样扩张,右冠未见显示,升主动脉至主动脉弓部壁环形低密度影,壁内血肿可能,夹层不除外。心超示主动脉右冠窦瘤样扩张,左室下壁后壁及后室间隔收缩活动异常,少量心包积液。在全麻醉下行右冠窦瘤切除术+冠状动脉搭桥术+David手术。术中见升主动脉宽35mm,右冠窦明显扩张,壁增厚硬化,沿右房室沟一直延续至下壁;切开右冠窦瘤壁,长度4cm,壁厚,合并陈旧性夹层表现。最终诊断为右冠窦瘤合并夹层,继发急性心肌梗死。手术顺利。

图13 AD累及左主干[1]
急性前壁心肌梗死,造影示左主干和前降支病变(A),左主干近中段支架术后患者室颤,复查造影示左主干开口部位严重狭窄(B),补支架后造影良好(C)。术后CTA示主动脉夹层(D)。
小结
要识别疑难病、罕见病,要有知识储备,更要凡事多想一层。AMI特殊病因不少,需要我们提高临床警惕,从临床表现、检验指标、影像学等各个方面识别疑点、尽早诊治。当然,不碰到最好!
参考文献
1.Arrivi A, Tanzilli G, Puddu P E, et al. Acute Aortic Dissection Mimicking STEMI in the Catheterization Laboratory: Early Recognition Is Mandatory. Case Rep Cardiol, 2012, 2012: 367542.
2.Barabas M, Gosselin G, Crepeau J, et al. Left main stenting-as a bridge to surgery-for acute type A aortic dissection and anterior myocardial infarction. Catheter Cardiovasc Interv, 2000, 51: 74-77.
3.Camaro C, Wouters N T, Gin M T, et al. Acute myocardial infarction with cardiogenic shock in a patient with acute aortic dissection. Am J Emerg Med, 2009, 27: 899 e893-896.
4.Cardozo C, Riadh R, Mazen M. Acute myocardial infarction due to left main compression aortic dissection treated by direct stenting. J Invasive Cardiol, 2004, 16: 89-91.
5.Gohbara M, Endo T, Kimura K, et al. Left main trunk stenting in a case of acute aortic dissection: a case report. Clin Case Rep, 2017, 5: 1649-1653.
6.Hanaki Y, Yumoto K, I S, et al. Coronary stenting with cardiogenic shock due to acute ascending aortic dissection. World J Cardiol, 2015, 7: 104-110.
7.Ikari Y, Hara K, Tamura T, et al. Intracoronary stenting of a coronary occlusion resulting from an aortic dissection. Cathet Cardiovasc Diagn, 1995, 36: 160-163.
8.Lee S W, Hong M K, Kim Y H, et al. Bail-out stenting for left main coronary artery dissection during catheter-based procedure: acute and long-term results. Clin Cardiol, 2004, 27: 393-395.
9.Okamoto M, Amano T, Matsuoka S, et al. A Case of Acute Myocardial Infarction due to Left Main Trunk Occlusion Complicated With Aortic Dissection as Diagnosed by Intravascular Ultrasound. Cardiol Res, 2012, 3: 232-235.
10.Shimamura J, Kubota H, Tonari K, et al. [Acute aortic dissection with left main coronary malperfusion treated with precedent stenting followed by a definitive surgery]. Kyobu Geka, 2010, 63: 537-541.
11.Wang Z G, Zhao W, Shen B T, et al. Successful treatment of a case of acute myocardial infarction due to type A aortic dissection by coronary artery stenting: A case report. Exp Ther Med, 2015, 10: 759-762.
12.Yip H K, Wu C J, Yeh K H, et al. Unusual complication of retrograde dissection to the coronary sinus of valsalva during percutaneous revascularization: a single-center experience and literature review. Chest, 2001, 119: 493-501.
13.Zhu Q Y, Tai S, Tang L, et al. STEMI could be the primary presentation of acute aortic dissection. Am J Emerg Med, 2017, 35: 1713-1717.
14.刘雁翔, 孙晓刚. 急性Stanford A型主动脉夹层累及冠状动脉的研究进展. 中华胸心血管外科杂志, 2017: 628-631.
15.Neri E, Toscano T, Papalia U, et al. Proximal aortic dissection with coronary malperfusion: presentation, management, and outcome. J Thorac Cardiovasc Surg, 2001, 121: 552-560.
16.Tang Y F, Zhang G X, Liao Z L, et al. Surgical Treatment of Coronary Malperfusion with Acute Type A Aortic Dissection. Chin Med J (Engl), 2016, 129: 1000-1002.
17.Tang L, Hu X Q, Zhou S H. Acute Stanford Type A Aortic Dissection Mimicking Acute Myocardial Infarction: A Hidden Catastrophe Which Should Prompt Greater Vigilance. Acta Cardiol Sin, 2014, 30: 493-496.
《中国医学论坛报》策划制作,谢绝转载。
查看更多