查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





时下大热的免疫治疗最初以其在黑色素瘤上的显著疗效逐渐步入人们视野,此后黑色素瘤一直走在免疫治疗的前列。但是不同黑色素瘤亚型的基因差异导致免疫应答程度的不尽相同,其中黏膜型(MM)和肢端型(AM)黑色素瘤在亚洲人群中多见,与欧美的主要类型皮肤型黑色素瘤在生物学特性和免疫治疗疗效上存在很大差异,因此更有针对性的基因组学研究就显得尤为重要。
2021年1月,一项发表在欧洲肿瘤内科学会(ESMO)官方期刊ESMO Open上的原创研究(Original Research)[1]——《接受免疫检查点抑制剂(ICI)治疗的亚洲晚期黑素瘤患者的分子表达谱分析》是迄今为止最大的针对亚洲人群黑色素瘤的综合性基因组学研究,或将给到科研工作者们更多启示。本期【周一黑咖汇】特邀解读专家浙江省肿瘤医院曹君教授,点评专家浙江省肿瘤医院方美玉教授,为我们解读该项研究,展望未来方向。
解读专家

点评专家

研究概述
1
研究目的
本研究旨在通过正在接受ICI治疗的亚洲晚期黑色素瘤患者的分子表达谱分析,来确定可预测肿瘤免疫应答程度的生物标志物。
2
研究方法
本研究共纳入188例亚洲转移性黑色素瘤患者,并收集他们的肿瘤组织样本进行下一代测序(NGS)。其中有10例因肿瘤组织样本不足而排除。研究主要分析了NGS数据和一些临床、病理因素,以明确可预测ICI疗效的潜在生物标志物。
3
研究结果
(1)患者一般情况:
178例患者的基线情况见表1(Table 1),最常见的黑色素瘤亚型是肢端型(39.9%),其次是皮肤型(32.0%)、黏膜型(25.8%)和葡萄膜型(0.6%)。
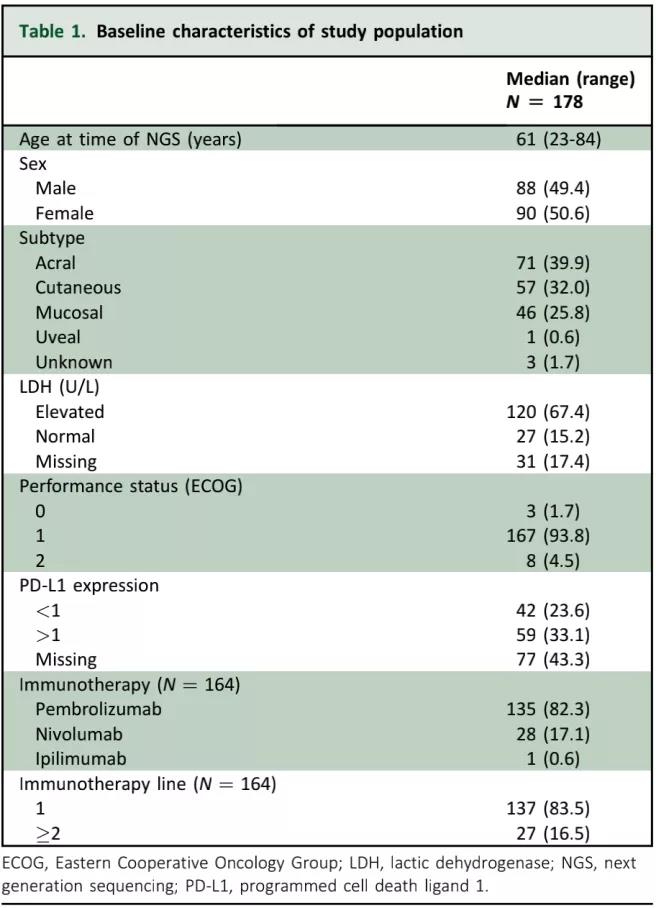
(2)基因突变与拷贝数变异:
经由NGS分析的178个肿瘤组织样本中,有106个(59.6%)具有至少一个基因突变,最常见的突变是BRAF(16.3%),其次是NRAS(14.6%)、KIT(6.2%)、TP53(6.2%)、PTEN(5.6%)和NF1(5.1%);有72例患者没有可检测到的体细胞突变(40.2%);在98例患者中观察到基因拷贝数变异(55.1%),最常见的变异是CDKN2A丢失(14.6%)和CCND1扩增(14.0%)(图1,Figure 1)。
(3)不同黑色素瘤亚型的基因组学分布:
如图2(Figure 2)所示,以KIT、BRAF、NRAS、KRAS为例,在全部121例非皮肤黑色素瘤(包括肢端型和黏膜型)中,有11例可以观察到KIT基因突变,但在剩下57例皮肤黑色素瘤中,没有观察到任何一例存在KIT基因突变;与黏膜黑色素瘤相比,BRAF基因突变更常见于肢端和皮肤黑色素瘤;与皮肤黑色素瘤相比,NRAS和KRAS都相对更常见于肢端型和黏膜型。

(4)免疫应答情况:
中位随访16.9个月,在164例可评估疗效的患者中,有135例(82.3%)接受了帕博利珠单抗治疗,28例(17.1%)接受了纳武利尤单抗治疗,1例(0.6%)接受了伊匹木单抗治疗;总体客观缓解率(ORR)为45.7%,其中完全缓解(CR)41例(25.0%),部分缓解(PR)34例(20.7%);总体客观缓解率(ORR)45.7%,疾病控制率(DCR)70.7%,中位无进展生存期(mPFS)为5.9个月(95%CI,3.8个月~8.05个月)。
(5)基因组改变与免疫应答、PFS的关系:
从基因层面而言,NRAS突变、TP53突变和NF2缺失与ICI的耐药性显著相关(P<0.05),反之MYC和RPS6KB1扩增与ICI的免疫应答显著相关(P<0.05);TP53突变、BRAF突变、NF2缺失和BIRC2扩增是PFS预后不良的因素(P <0.05),而老年患者(≥65岁)和BRCA1突变则与更长的PFS相关(P <0.05)(图3A,Figure 3A)。
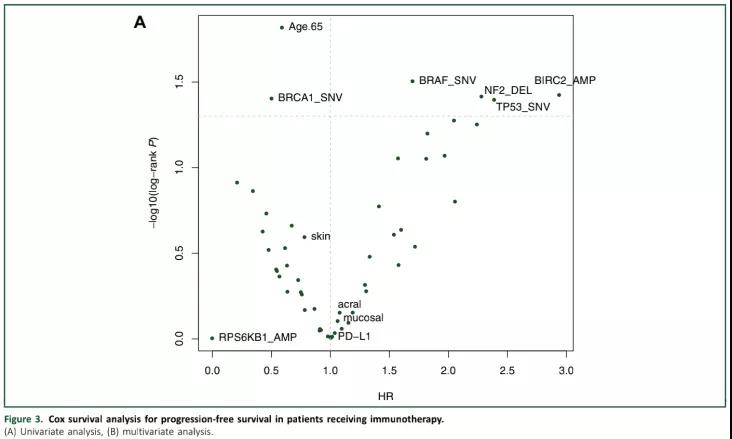
此外,研究者还发现在178例患者中,有6%存在MSH2基因突变,有5%存在MLH1基因突变,但这些与ICI免疫应答或PFS均无关。进一步的分析又表明,与≤10个突变的患者相比,携带≥10个突变的患者接受ICI治疗后PFS有延长的趋势(P= 0.051)。
曹君教授解读
我国肢端/黏膜型ICI治疗效果不佳?
黑色素瘤按其基因变异可分为4个亚型,分别为肢端型(AM)、黏膜型(MM)、慢性日光损伤型(CSD,包括皮肤型)和非慢性日光损伤型(non-CSD,包括原发病灶不明型)。根据本研究的结果,亚洲人群最常见的黑色素瘤亚型依旧是肢端型、皮肤型和黏膜型,其中肢端型和黏膜型多见于亚洲人群,它们的生物学行为更是有别于皮肤型黑色素瘤,更易侵及血管、更易出现复发转移[2],这意味着现有的临床治疗手段可能无法达到最佳疗效。
2015年8月,国内第一项PD-1单抗治疗黑色素瘤的Ⅰ期研究拉开序幕,随后开展的Ⅱ期研究结果显示,非肢端型/非黏膜型黑色素瘤患者的ORR为34%,与西方人群基本相当,但肢端型和黏膜型ORR分别只有14.3%和0%,这也导致了总体人群ORR被显著拉低(20.7%)。
KEYNOTE-151研究[3]入组了103例黑色素瘤患者,其中肢端型39例,黏膜型15例,总人群ORR为16.7%,肢端型ORR为15.8%,黏膜型ORR为13.3%,可以看出获益患者的疗效维持时间与过去相比明显延长,但总体ORR远不如帕博利珠单抗在欧美人群报道的40%~60%。
因此,总体而言,中国的非肢端型/非黏膜型黑色素瘤的免疫治疗疗效与国外相仿,但肢端型和黏膜型黑色素瘤的免疫治疗效果略差,那么哪些因素导致了这样的差异呢?
PD-L1表达/TMB均较皮肤型低
既往的研究显示,PD-L1表达和肿瘤突变负荷(TMB)作为两个重要的免疫生物标志物在肢端型和黏膜型黑色素瘤中均较低。一项纳入了200例黑色素瘤患者的研究显示(肢端型16例、黏膜型36例、皮肤型45例、葡萄膜型103例),PD-L1表达阳性的比例为30%(60/200),其中肢端型、黏膜型、皮肤型分别为31%、44%、62%[4]。此外,一项纳入95例皮肤黑色素的研究显示,中位TMB为14.4 Muts/Mb[5];而另一项纳入5例黏膜黑色素瘤的研究显示,中位TMB仅为2.86 Muts/Mb[6]。
因此,PD-L1表达和TMB较低可能是免疫治疗在肢端型/黏膜型黑色素瘤中有效率偏低的原因之一。
基因组学情况复杂,KIT可能为主要靶点
既往研究显示,肢端型和黏膜型发生KIT基因突变者较多,其次为BRAF突变;而非慢性日光损伤型,如躯干黑色素瘤,大部分发生BRAF V600E突变(60%)或NRAS突变(20%)[7-10]。本研究中,KIT基因突变仅见于非皮肤型黑色素瘤(包括肢端型和黏膜型),而在皮肤型中几乎不存在;相对地NRAS和KRAS在三个亚型中均存在,但多见于肢端型和黏膜型;BRAF基因突变则更常见于肢端型和皮肤型黑色素瘤,而在黏膜型中则比例很低。
目前已有关于KIT抑制剂的Ⅱ期临床研究获得了较为不错的结果(总体ORR为 20%~30%,DCR为 35%~55%),但是大部分有效的患者维持时间较短;此外,该系列研究还显示KIT抑制剂在黏膜型黑色素瘤比肢端型或阳光损伤型黑色素瘤具有更好的反应率[11-14]。
因此,基于目前的研究数据,未来在进行优势人群筛选时,或可以更有针对性地选用合适的免疫联合治疗方案,使患者得到更多获益。
方美玉教授点评
本研究是通过对亚洲晚期黑色素瘤患者的基因表达谱分析,来探讨不同黑色素瘤亚型、不同基因突变和免疫应答疗效之间的相关性,共纳入178例可采集肿瘤组织样本的患者,通过NGS对所有患者进行基因组测序,并绘制了独特的三元分布图(Figure 2)。从这张图也可以看出,中国的黑色素瘤跟国外存在着较大的差异,黏膜型和肢端型这两个亚型在欧美非常少见,但在亚洲却是主要的黑色素瘤亚型,它们的基因突变情况也和国外常见的黑色素瘤亚型不尽相同,这也导致了我们不能局限于国外的临床研究,同时需要结合国内相关研究作出突破。
ICI对肿瘤微环境具有协同调节作用,因此在联合治疗方面或将大有可为。去年的一项PD-1单抗联合血管内皮生长因子受体(VEGFR)抑制剂治疗晚期黑色素瘤的安全性和有效性研究纳入了88%(29/33)黏膜型患者,ORR达到42%,mPFS为7.5个月[15],预示着PD-1单抗联合抗血管生成药物是可以探索的方向之一。2020年美国临床肿瘤学会(ASCO)年会上发布了一项PD-1单抗联合CTLA-4单抗治疗晚期黑色素瘤的Ⅰ期临床研究数据[16],并初步取得了阳性结果,联合方案的扩展研究和针对肢端型黑色素瘤的辅助治疗Ⅲ期研究也正在进行中。
机遇与挑战并存,基于现有的较为优异的免疫治疗数据,未来免疫联合治疗亦是大势所趋,我们也非常期待未来能够寻找到符合亚洲特点的生物标志物和治疗方案,使更多中国患者、乃至亚洲患者获益。
作者:曹君 方美玉
参考文献
[1] S. Byeon, et al. Molecular profiling of Asian patients with advanced melanoma receiving check-point inhibitor treatment. ESMO Open. 2020 Dec 15; 6(1): 100002.
[2] 中国临床肿瘤学会指南工作委员会. 《中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南2020》. 人民卫生出版社.
[3] SI L, ZHANG X, SHU Y, et al. A phase Ⅰb study of pembrolizumab as second-line therapy for Chinese patients with advanced or metastatic melanoma (KEYNOTE-151) . Transl Oncol, 2019, 12 (6): 57828-835.
[4] Genevieve J Kaunitz et al.Melanoma subtypes demonstrate distinct PD-L1 expression profiles. Lab Invest. 2017.
[5] Hodis E, Watson IR, Kryukov GV , et al. A landscape of driver mutations in melanoma. Cell. 2012.
[6] Furney SJ, Turajlic S, Stamp G, et al. Genome sequencing of mucosal melanomas reveals that they are driven by distinct mechanisms from cutaneous melanoma. J Pathol. 2013.
[7] HIGH WA, ROBINSON WA. Genetic mutations involved in melanoma: a summary of our current understanding. Adv Dermatol, 2007, 23: 61-79.
[8] CURTIN JA, BUSAM K, PINKEL D, et al. Somatic activation of KIT in distinct subtypes of melanoma. J Clin Oncol, 2006, 24 (26): 4340-4346.
[9] CURTIN JA, FRIDLYAND J, KAGESHITA T, et al. Distinct sets of genetic alterations in melanoma. N Engl J Med, 2005, 353 (20): 2135-2147.
[10] KONG Y, SI L, ZHU Y, et al. Large-scale analysis of KIT aberrations in Chinese patients with Melanoma. Clin Cancer Res, 2011, 17 (7): 1684-1691.
[11] GUO J, SI L, KONG Y, et al. Phase Ⅱ, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J Clin Oncol, 2011, 29: 2904-2909.
[12] CARVAJAL RD, ANTONESCU CR, WOLCHOK JD, et al. KIT as a therapeutic target in metastatic melanoma. JAMA, 2011, 305: 2327-2334.
[13] HODI FS, CORLESS CL, GIOBBIE-HURDER A, et al. Imatinib for melanomas harboring mutationally activated or amplified KIT arising on mucosal, acral, and chronically sun-damaged skin. J Clin Oncol, 2013, 31: 3182-3190.
[14] GUO J, CARVAJAL RD, DUMMER R, et al. Efficacy and safety of nilotinib in patients with KIT-mutated metastatic or inoperable melanoma: final results from the global, single-arm, phase Ⅱ TEAM trial. Ann Oncol, 2017, 28 (6): 1380-1387.
[15] Xinan Sheng et al.Axitinib in Combination With Toripalimab,a Humanized Immunoglobulin G4Monoclonal Antibody Against Programmed Cell Death-1, in Patients With Metastatic Mucosal Melanoma: An Open-Label Phase IB Trial.JCO.2019.
[16] Bin Lian et al. IBI310 monotherapy or in combination with sintilimab in patients with advanced melanoma: An open-label phase Ia/1b study. ASCO 2020. Abs. e15111.9
下期预告 :由张雪莹教授和
斯璐教授带来【周一黑咖汇】第十二期,敬请期待!
解读专家

点评专家

审批号:MI-PD1-2091-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多