查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





血小板是人体最重要的细胞之一,由骨髓中巨核细胞产生,起到加快凝血和止血的作用。如果巨核细胞成熟障碍,可造成血小板生成减少,即血小板减少症。
2021年6月18日,国家血液系统疾病临床医学研究中心、北京大学人民医院、北京大学血液病研究所黄晓军教授及孔圆研究员共同通讯在《Signal Transduction and Targeted Therapy》(IF=13.493)在线发表了题为“M2 macrophages, but not M1 macrophages, support megakaryopoiesis by upregulating PI3K-AKT pathway activity”的研究论文,并在第26届欧洲血液学年会(EHA)上做口头报告。

该研究首次揭示造血干细胞移植后血小板延迟植入的新机制,指出PI3K-AKT通路是巨噬细胞M2亚型支持巨核细胞成熟的关键通路,有望成为血小板减少症的关键治疗靶点。
黄晓军教授指出,移植后血小板延迟植入(PT)患者存在骨髓巨噬细胞极化失衡状态,表现为经典途径活化巨噬细胞(M1)增高和替代途径活化巨噬细胞(M2)下降,介导了骨髓巨核细胞成熟障碍,从而导致血小板生成减少。
而移植后植入功能良好患者的骨髓巨噬细胞以M2型为主,且其PI3K-AKT通路显著激活,对巨核细胞成熟和血小板生成发挥支持作用。我们可以通过激活PI3K-AKT通路的药物上调PI3K-AKT通路,恢复M1/M2巨噬细胞极化状态,促进巨核细胞功能和血小板生成,为PT患者提供潜在的治疗新靶点。
造血干细胞移植领域亟待解决的重大临床难题——血小板延迟植入
血小板是由造血干细胞在骨髓微环境中迁移并定向分化成巨核细胞而产生的,巨核细胞的成熟和血小板的生成受到骨髓微环境的严格调控。
血小板是人体最重要的细胞之一,起到加快凝血和止血的作用。如果巨核细胞成熟障碍,可造成血小板生成减少,从而导致皮肤瘀斑、牙龈、消化道出血等症状,严重者可因脑出血危及生命。
造血干细胞移植不仅是治疗恶性血液病的有效方式,而且是研究造血干细胞重建调控的理想模型。
供者造血干细胞在受者体内归巢植入、并与骨髓微环境相互作用重建造血系统和免疫系统是移植成功的关键。
移植成功的第一步就是血象的提升、恢复,包括血小板的提升。如果干细胞在患者体内尚未完成重建的这个阶段是最危险的,随时可能危及生命。
血小板延迟植入是异基因造血干细胞移植的严重并发症之一。
持续性血小板减少容易导致严重出血,尚无有效临床防治手段,仅能依赖于促进血小板生长的细胞因子类药物和输注血小板等,严重影响患者生活质量、增加医疗费用、甚者导致移植相关死亡率增高,是移植失败的重要原因之一。
因此,深入阐明移植后PT的发病机制、探索建立新型干预策略是亟待解决的重要临床科学问题。
近年来,北京大学血液病研究所黄晓军教授、张晓辉教授和孔圆研究员课题组的系列研究揭示骨髓微环境损伤和巨核细胞成熟障碍参与了移植后PT的发生。
巨噬细胞作为骨髓微环境的关键细胞成分,在造血干细胞稳态维持中发挥着重要作用。
但是巨噬细胞,特别是经典途径活化(M1)和替代途径活化(M2)两种巨噬细胞极化亚型对巨核细胞的调控作用及其机制仍是亟待解决的重要科学问题。
黄晓军团队发现移植后血小板延迟植入的干预新靶点
为明确M1和M2巨噬细胞分别对巨核细胞成熟的调控作用以及PI3K-AKT通路是否通过介导巨噬细胞极化来调控巨核细胞成熟与血小板生成的科学问题,研究者利用人原代细胞和细胞系开展体外共培养、转录组测序(RNA seq)分析、抑制剂/激动剂和慢病毒体外干预巨噬细胞研究以及巨噬细胞特异性PI3K敲低小鼠模型体内研究。
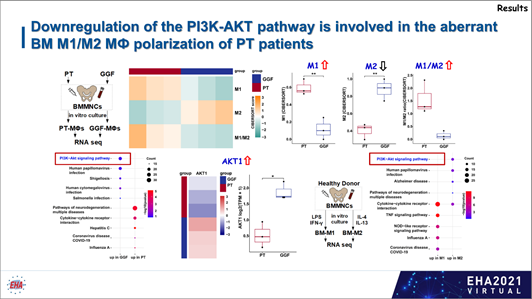
通过前瞻性临床病例配对研究和体外实验,研究者发现,移植后PT患者骨髓巨噬细胞极化失衡,表现为骨髓M1显著升高而M2显著下降。
与移植后植入功能良好(GGF)患者骨髓巨噬细胞相比,PT患者骨髓巨噬细胞共培养的造血干细胞向巨核细胞分化比例下降,且巨核细胞成熟比例显著降低,提示M1升高而M2下降的巨噬细胞极化失衡可能是导致PT巨噬细胞对巨核细胞支持功能下降的重要原因。
为进一步探索移植后PT患者骨髓巨噬细胞极化失衡和功能改变的机制,研究者分别对PT患者和GGF患者的原代骨髓巨噬细胞进行了RNA seq。
CIBERSORT评估患者原代骨髓巨噬细胞M1和M2相关基因评分再次证实,PT患者骨髓巨噬细胞以M1型为主,而GGF患者骨髓巨噬细胞以M2型为主。
KEGG通路富集分析发现,与PT患者巨噬细胞相比,GGF患者骨髓巨噬细胞PI3K-AKT通路显著激活,并且高表达AKT1基因,提示PI3K-AKT通路可能是调控PT巨噬细胞极化失衡功能改变的关键通路及治疗靶点。
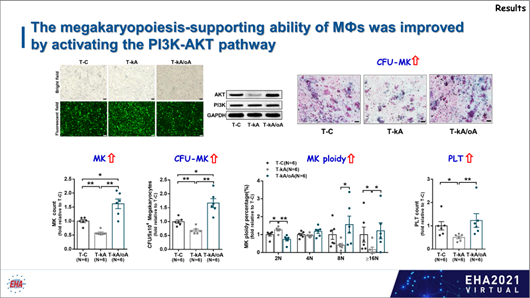
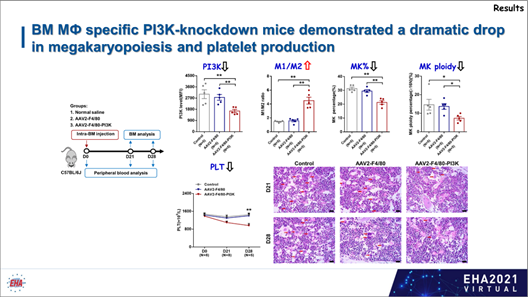
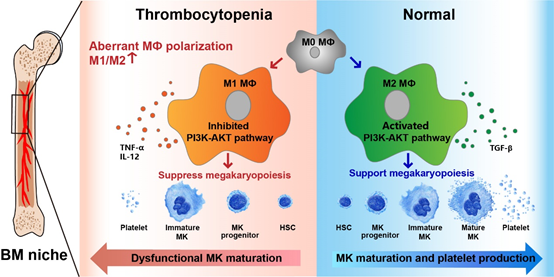
综上所述,该研究数据表明,M1 和 M2 巨噬细胞以 PI3K-AKT 通路依赖的方式对巨核细胞发挥相反的调控作用,是对血小板减少症发病机制的新见解,并探索创新性靶向药物,实现巨噬细胞极化失衡的靶向调控,对于促进移植后血小板重建,提高移植患者的临床疗效具有重要意义,从而带来更为广阔的社会效益和经济效益。
该研究第一作者是赵红艳博士,黄晓军教授和孔圆研究员为共同通讯作者。

国家血液系统疾病临床医学研究中心、北京大学人民医院、北京大学血液病研究所
教授,主任医师,博导
国家血液系统疾病临床医学研究中心主任
北京大学血液病研究所所长
北京大学人民医院血液科主任
北京市造血干细胞移植重点实验室主任

国家血液系统疾病临床医学研究中心、北京大学人民医院、北京大学血液病研究所
研究员、副教授、博导
国家血液系统疾病临床医学研究中心 转化中心主任
造血干细胞移植北京市重点实验室副主任

第一作者
赵红艳
国家血液系统疾病临床医学研究中心、北京大学人民医院、北京大学血液病研究所,博士研究生(导师/黄晓军教授,副导师/孔圆研究员)。
通讯员 北京大学人民医院宣传中心 钟艳宇
查看更多