查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2023年10月20日至24日,欧洲肿瘤内科学会(ESMO)年会在西班牙马德里召开。
作为全球最具影响力的肿瘤学会议之一,每年都会有大量来自世界各地的临床医生、研究人员和医疗健康行业代表在ESMO大会相聚。本次ESMO大会上,泰格医药欧洲、亚太等地的临床研究专家和运营团队共同参与了本次盛会,并举办以“Connecting Oncology Innovators”为主题的客户酒会。泰格团队与全球肿瘤学者、业界翘楚共同探讨了最新肿瘤学趋势、创新疗法及业界的突破性进展,并向与会嘉宾们展示泰格医药全面的肿瘤创新研发服务和解决方案,得到与会人员的热烈反响。




每年的ESMO大会都会有数千篇研究摘要发出,其中最重要、对临床治疗影响最大的研究成果,会以最新突破摘要(LBA)的形式发布。今年ESMO大会期间,数十家中国生物医药企业带着最新的研究成果亮相。接下来,我们就与大家分享一下中国生物医药企业发布的9项LBA。

LBA25:局部晚期直肠癌新辅助短程放疗序贯卡瑞利珠单抗联合化疗与长程放化疗序贯化疗的疗效
这是由华中科技大学同济医学院附属协和医院团队完成的一项随机、多中心、开放标签III期研究,研究人员比较了短程放疗(SCRT)序贯免疫化疗与长程放化疗(LCRT)序贯化疗,围手术期治疗局部晚期直肠癌(LARC)的疗效和安全性。
在2021年7月至2023年3月间,共有231名患者按照1:1的比例,随机分配到A组(113人)和B组(118人)。A/B两组患者分别接受SCRT或LCRT治疗,然后分别接受2个周期的卡瑞利珠单抗(CAM)+CAPOX或CAPOX治疗。随后进行全直肠系膜切除术,A组患者再接受6个周期的CAM+CAPOX治疗,之后再接受长达1年的CAM治疗;B组患者再接受6个周期的CAPOX治疗。
从研究的主要终点来看,A组由独立审查委员会(IRC)评估的病理学完全缓解(pCR)率为39.8%,B组为15.3%,HR为3.7(p<0.001)。显然,在ITT人群中,A组的pCR率显著提高,达到了主要终点。
LBA33:新型KRAS G12D抑制剂HRS-4642在KRAS G12D突变晚期实体瘤患者中的首个1期临床研究
上海市肺科医院的研究人员在晚期KRAS G12D突变实体瘤的1期临床研究中,首次评估了高选择性KRAS G12D抑制剂HRS-4642的安全性和使用剂量。
截至2023年8月4日,共有18名经组织学确认携带KRAS G12D突变的晚期实体瘤患者入组(肺腺癌10例,结直肠腺癌5例,阑尾黏液腺癌、卵巢癌和胰腺癌各1例)。这些患者之前接受治疗的中位数为3种(2-7种)。入组后,接受HRS-4642治疗,剂量分别为15、50、100、200和300毫克,每周给药一次,21天为一个周期。
在研究过程中,没有观察到剂量限制性毒性,也没有达到最大耐受剂量,HRS-4642的半衰期约为40小时。9例患者(50.0%)出现3级及以上的不良事件,6例(33.3%)出现3级及以上的治疗相关不良事件,分别为高胆固醇血症(16.7%)、脂肪酶升高(11.1%)和贫血(11.1%)。没有患者因治疗相关不良事件而中断治疗或死亡。从疗效上看,一名肺癌患者在使用200毫克后出现部分缓解,11名患者(61.1%)病情稳定,6名患者(33.3%)靶病灶缩小。
以上结果说明,HRS-4642对携带KRAS G12D突变的晚期实体瘤患者,具有可耐受的安全性和初步的抗肿瘤活性。
LBA36:新诊断晚期卵巢癌患者接受PARP抑制剂senaparib维持治疗的有效性和安全性(FLAMES研究)
FLAMES研究是一项随机、双盲、安慰剂对照的3期临床试验,由复旦大学附属肿瘤医院的研究人员带领完成。
截至2023年3月16日,有404名新诊断的晚期卵巢癌患者按照2:1的比例随机分为两组,分别接受senaparib或安慰剂的治疗。主要研究终点是由盲法独立中央审查(BICR)根据RECIST v1.1评估的无进展生存期(PFS)。
从研究结果来看,与安慰剂相比,senaparib能显著改善PFS(HR=0.43,P<0.0001),且与BRCA突变状态无关(HR=0.43,P<0.01)。在安全性方面,senaparib和安慰剂组3级及以上不良事件(AEs)发生率分别为66.3%和20.3%,导致用药剂量减少的AEs发生率分别为63.3%和6.0%,导致停药的AEs发生率分别为4.4%和0%。两组均没有导致死亡的不良反应。
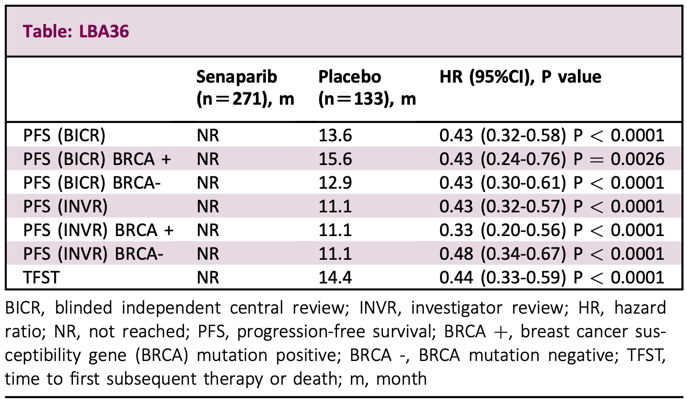
以上数据表明,与安慰剂相比,senaparib一线维持治疗可显著降低卵巢癌患者的疾病进展或死亡风险,且与BRCA突变状态无关。此外,senaparib的耐受性良好,未发现新的安全信号。
LBA44:卡瑞利珠单抗联合法米替尼与卡瑞利珠单抗单药或研究者选择化疗治疗复发转移性宫颈癌的疗效
这是一项随机、开放标签的2期临床试验,由复旦大学附属肿瘤医院的研究人员领衔完成。
截至2023年4月21日,共有194名既往铂类化疗失败的复发性或转移性宫颈癌患者被随机分为三组(A组105人,B组54人,C组35人)。A组患者接受卡瑞利珠单抗联合法米替尼治疗,B组患者仅接受卡瑞利珠单抗治疗,C组患者接受卡瑞利珠单抗联合研究者选择的化疗治疗。研究的主要终点是BICR根据RECIST v1.1评估的客观缓解率(ORR)。
在中位时间为9.9个月的随访时间里,A组的ORR为41%,B组为24.1%。安全性方面,三组的治疗相关不良事件(TRAEs)发生率分别为100%、94.3%和100%,分别有84.8%、15.1%和60.0%的患者报告了3级及以上的TRAEs。此外,三组分别有19.0%、5.7%和0%的患者因不良事件停药,且A组中有2例患者(1.9%)报告了与治疗相关的死亡。
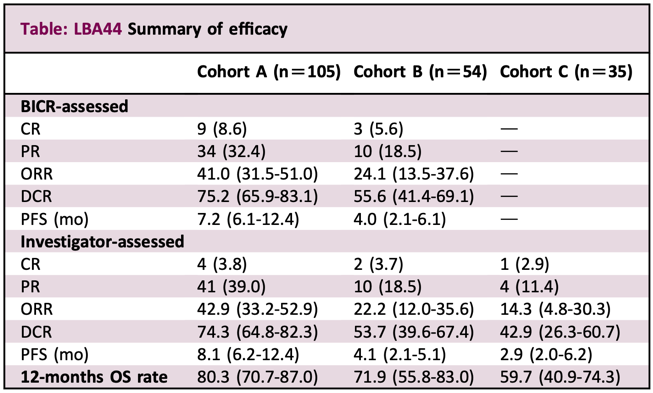
研究人员认为,以上数据表明,在复发性或转移性宫颈癌患者中,卡瑞利珠单抗联合法米替尼的抗肿瘤活性比单用卡瑞利珠单抗或研究者选择的化疗更强,且安全性可耐受。
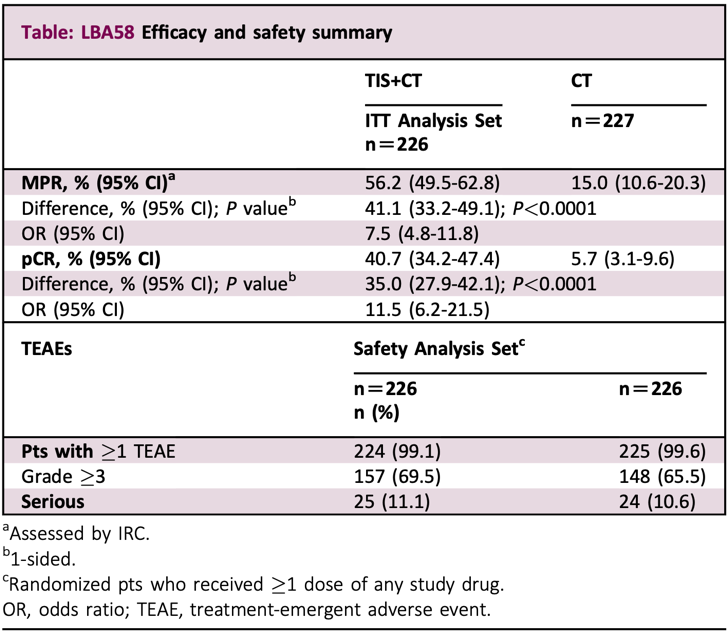
LBA58:在RATIONALE-315试验中,可切除II-IIIA期非小细胞肺癌患者对替雷利珠单抗(TIS)联合铂双药化疗(CT)新辅助治疗的病理反应
这项由天津市肿瘤医院团队开展的研究,招募了453名未经治疗且可手术的II-III期非小细胞肺癌患者。
所有患者按照1:1随机分组,其中226人接受替雷利珠单抗联合铂双药新辅助治疗(TIS+CT组),其余227人接受安慰剂联合铂双药新辅助治疗(CT组),然后实施手术治疗,随后分别开展8个周期的替雷利珠单抗或安慰剂治疗。研究的主要终点是新辅助治疗后的主要病理学缓解(MPR),以及由IRC根据RECIST v1.1评定的无事件生存(EFS),次要终点是pCR率。
在治疗结束后,TIS+CT组的MPR率和pCR率分别为56.2%和40.7%,而CT组分别为15%和5.7%。显然,与CT相比,TIS+CT组的MPR和pCR率显著提高(P<0.0001)。此外,研究数据还显示,TIS+CT不影响手术的可行性。
LBA69:阿美替尼联合阿帕替尼与阿美替尼单药作为EGFR突变阳性局晚期或转移性非小细胞肺癌的一线治疗的比较
ATTENTION研究是由中国人民解放军总医院的研究人员领衔的随机多中心临床研究。
在2021年6月至2022年11月间,共有104例未经治疗的IIIB或IV期非小细胞肺癌患者入组,这些患者携带EGFR 19del或21L858R突变,或者其他不常见的EGFR突变。
所有患者按照1:1的比例分成两组,一组接受阿美替尼联合阿帕替尼治疗(AUM+APA组),另一组接受阿美替尼单药治疗(AUM组),直至疾病进展。研究的主要终点是无进展生存期(PFS)。次要终点包括客观反应率(ORR)、疾病控制率(DCR)、颅内ORR(iORR)、颅内DCR(iDCR)、总生存期(OS)和安全性。
截至2023年9月12日,AUM+APA组的PFS有获益趋势。AUM+APA组和AUM组的ORR分别为72.9%和64%,DCR分别为100%和94%。在19 del或L858R亚组中,AUM+APA组和AUM组的ORR分别为75%和68%。在脑转移和肝转移亚组中,AUM+APA组和AUM组的ORR分别为100%和60%,60%和33%,iORR分别为82%和63%。
安全性方面,AUM+APA组和AUM组最常见的治疗引发的不良事件(TEAEs)分别为腹泻(31% vs 12%)、皮疹(29% vs 10%)、蛋白尿(27% vs 6%)、血小板计数减少(25% vs 4%)、高血压(25% vs 6%)、肌酸激酶升高(23% vs 16%)。
以上数据说明,与AUM单药相比,AUM联合APA可能是EGFR突变非小细胞肺癌患者更有效的一线治疗方案。
LBA79:在初治局晚期胃或胃食管结合部(G/GEJ)腺癌中,舒格利单抗加化疗与安慰剂加化疗的一项3期研究的预先指定无进展生存(PFS)和总生存(OS)的最终分析
由北京大学肿瘤医院团队领衔的GEMSTONE-303研究是一项随机、双盲、多中心的3期临床试验。
在2019年4月9日至2021年12月29日期间,研究人员招募了479名既往未经治疗、HER2阳性状态不明、PD-L1表达≥5%、不可切除的晚期或转移性G/GEJ腺癌患者。所有患者按照1:1随机分为两组,一组接受PD-L1抑制剂舒格利单抗(suge)联合CAPOX治疗(suge+CAPOX组),另一组接受安慰剂联合CAPOX治疗(安慰剂+CAPOX组)。研究的主要终点为PFS和OS。
从研究结果来看,suge+CAPOX组和安慰剂+CAPOX组的中位PFS分别为7.62月和6.08月,HR为0.66(P<0.0001);两组的中位OS分别为15.64月和12.65月,HR为0.75(P=0.006)。
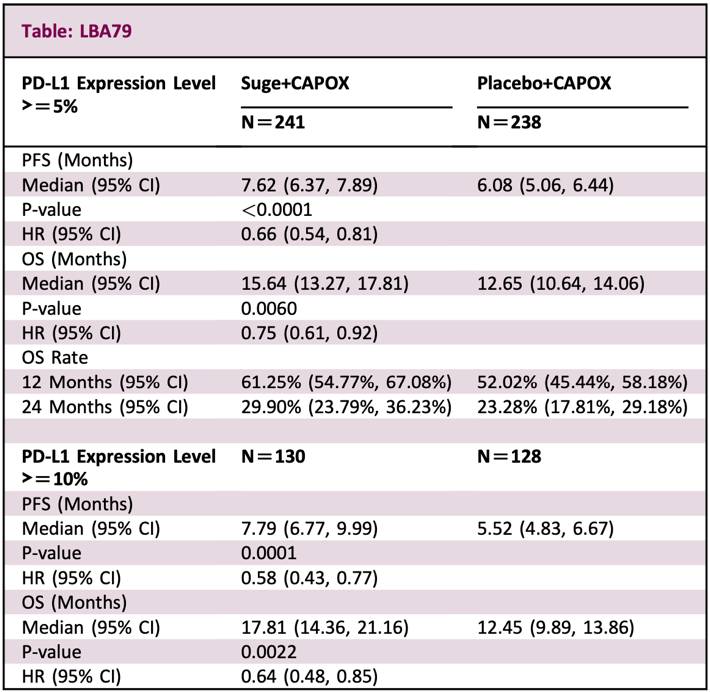
研究人员认为,以上研究结果表明,舒格利单抗与CAPOX联用可显著改善患者的PFS和OS,且安全性可控。这些研究结果支持将舒格利单抗+CAPOX作为PD-L1表达≥5%的晚期G/GEJ腺癌患者的新一线治疗方案。
LBA80:替雷利珠单抗联合化疗与安慰剂联合化疗用于晚期胃或胃食管结合部(G/GEJ)腺癌一线治疗的比较——RATIONALE-305试验的最终分析结果
由中山大学肿瘤防治中心研究人员领衔的RATIONALE-305研究是全球多中心研究,共招募了997名既往未经治疗、HER2阴性、局部晚期、不可切除或转移性G/GEJ腺癌患者。
所有患者按照1:1随机分为两组,一组接受替雷利珠单抗联合化疗(TIS+chemo),另一组接受安慰剂联合化疗(PBO+chemo)。研究主要终点是PD-L1阳性和ITT人群的OS,次要终点包括PFS和ORR等。
在最短随访时间为24.6个月的时间里,在ITT人群中,与安慰剂联合化疗组相比,替雷利珠单抗联合化疗组的OS显著改善,两组分别为12.9个月和15.0个月(HR=0.80,单侧P=0.0011)。
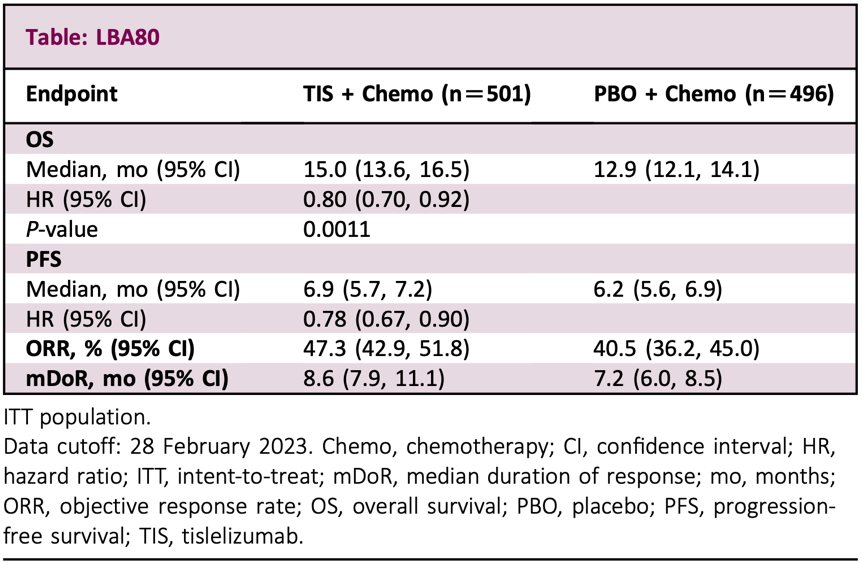
在安全性方面,替雷利珠单抗联合化疗组和安慰剂联合化疗组的3级及以上的治疗相关不良事件(TRAEs)发生率分别为53.8%和49.8%,有16.1%和8.1%的患者因TRAEs而中断治疗,以及分别有1.2%和0.4%的患者因TRAEs而死亡。
基于以上研究数据,研究人员认为,在ITT人群中,替雷利珠单抗联合化疗对OS的改善显著优于安慰剂联合化疗,且耐受性良好。这些数据表明,替雷利珠单抗联合化疗有潜力成为晚期G/GEJ腺癌患者的一线治疗方案。
LBA93:特瑞普利单抗联合化疗与安慰剂联合化疗用于广泛期小细胞肺癌一线治疗的比较
由吉林省肿瘤医院团队领衔的EXTENTORCH研究是一项随机对照III期临床研究。
在2019年9月至2021年5月之间,中国48个研究机构共招募了442名经组织学或细胞学确诊的广泛期小细胞肺癌(ES-SCLC)患者。所有患者按照1:1随机分配到特瑞普利单抗联合化疗组(223)或安慰剂联合化疗组(219)。研究主要终点是PFS和OS。
在中位随访时间为11.8个月的时间里,特瑞普利单抗组的PFS显著优于安慰剂组(5.8个月 vs. 5.6个月,HR=0.667,P=0.0002)。在数据截止日期(2023年4月20日)的最终OS分析中,特瑞普利单抗治疗组的OS为14.6个月,显著优于安慰剂组的13.3个月(HR=0.798,P=0.0327)。
总的来说,研究人员认为,在化疗基础上加用特瑞普利单抗可显著改善ES-SCLC患者的PFS和OS,且安全性可接受。
本次ESMO大会圆满落幕,期待与大家明年的相聚!
查看更多