查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





中山大学孙逸仙纪念医院林天歆教授、陈旭教授团队在权威医学期刊MedComm发表题为“Intravesical Disitamab Vedotin (RC48) for HER2-Expressing High-Risk Non-Muscle-Invasive Bladder Cancer: A Single-Arm, Dose–Escalation Phase I Trial Study”的临床研究结果。这是全球首个将HER2靶向ADC药物——维迪西妥单抗(RC48)通过膀胱灌注途径应用于HER2阳性的高危非肌层浸润性膀胱癌患者(High-risk non-muscle invasive bladder cancer, HR-NMIBC)的临床研究,为BCG(卡介苗)治疗无效或不耐受的HR-NMIBC患者提供了全新的保膀胱策略。

临床数据表明,NMIBC占全部膀胱癌的75–80%,其中HR-NMIBC患者复发或进展风险显著增加。目前HR-NMIBC患者的标准治疗为经尿道膀胱肿瘤切除(TURBT)联合术后卡介苗膀胱灌注,然而,部分国家和地区存在卡介苗短缺问题,以及卡介苗具有较明显的毒副作用,导致部分患者无法获得或无法耐受卡介苗治疗;此外,约70–85% NMIBC存在HER2过表达,这类患者对卡介苗反应更差、复发更早。因此,针对HER2阳性的HR-NMIBC患者,亟需研发新型且安全、高效的术后治疗方案,防止肿瘤复发或进展。
RC48是我国原创的HER2靶向ADC药物,由抗HER2单抗偶联细胞毒微管抑制剂MMAE构成。临床研究表明,RC48静脉用药在治疗转移性尿路上皮癌患者展现出良好的有效性和安全性,已在我国获批应用于既往接受过系统化疗且HER2表达阳性(IHC 2+/3+)的局部晚期或转移性尿路上皮癌。基于此,研究团队提出“RC48膀胱内灌注”策略,可将高浓度药物直接送达病灶,同时显著降低全身毒性,并发起了首个开放标签、单臂、剂量递增的 I 期临床试验,评估 RC48 在HR-NMIBC中的安全性和初步疗效。
本研究共纳入 9 例患者,按照“3+3”剂量递增方案,在诱导期分别予以60/120/180mg的剂量(每组3人),每周1次,持续6周,后续予每月1次的维持治疗(剂量可改变)。
安全性优异:9例患者全部完成诱导期疗程(6周),未观察到剂量限制性毒性(DLT)或≥3级药物相关不良事件。主要不良反应为泌尿系感染(55.6%)、尿频(11.1%)及血尿(11.1%)。上述相关不良反应通过暂停给药或对症治疗后均可自行缓解。
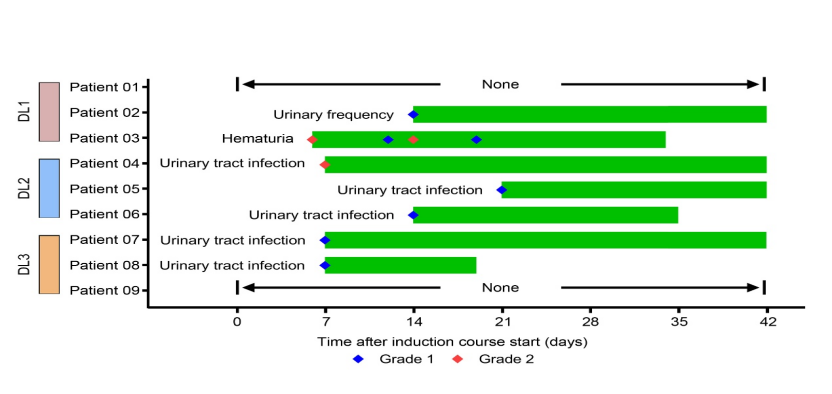
本研究中各患者发生药物相关不良反应示意图
疗效良好:中位随访16.97个月,6个月、12个月无复发生存率分别为100%与87.5%,两个时间点无进展生存率均为100%。其中2例复发患者均来自60 mg组,提示疗效呈剂量依赖性。
基于上述研究成果,对HR-NMIBC患者,相较传统的卡介苗灌注治疗方案(1 年RFS率60–90%,PFS率80%-90%),或卡介苗膀胱灌注联合化疗/免疫治疗方案(1年RFS率为80%-90%),RC48 膀胱灌注方案在安全性和精准治疗方面展现出独特优势,为HR-NMIBC保膀胱治疗提供新思路。
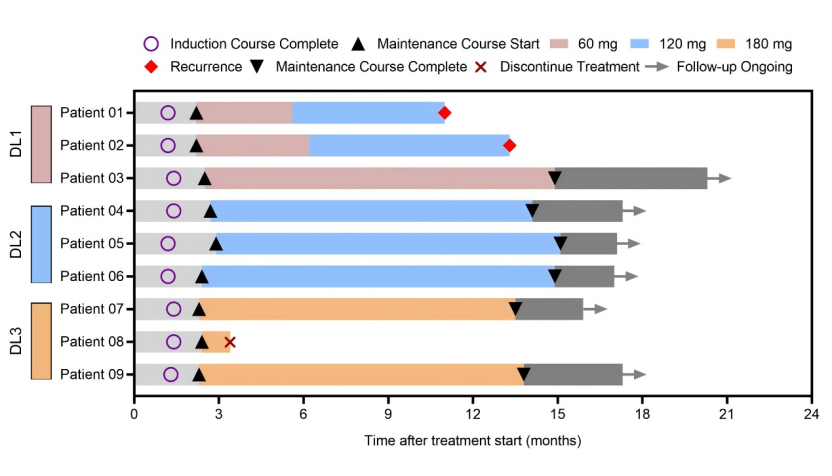
本研究中各患者治疗方案示意图
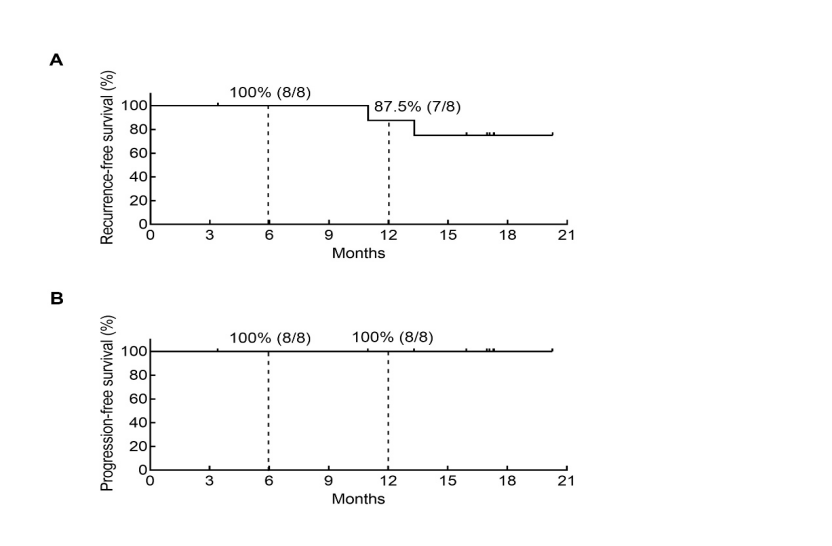
本研究无复发生存率、无进展生存率示意图
本研究第一作者及共同通讯作者为中山大学孙逸仙纪念医院泌尿外科陈旭教授,共同第一作者为孙逸仙纪念医院泌尿外科助理研究员黄铭,以及研究生陈泽华。通讯作者为孙逸仙纪念医院泌尿外科林天歆教授。
来源:中山大学孙逸仙纪念医院泌尿外科
查看更多