查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





来源:爱肝联盟公众号
与高脂肪高热量饮食和肥胖密切相关的非酒精性脂肪性肝病(NAFLD)是当前全球第一大慢性肝脏疾病,现已累及全球四分之一的人口,严重危害人类健康。NAFLD疾病谱主要包括单纯性脂肪肝和非酒精性脂肪性肝炎(NASH)及其相关肝纤维化和肝硬化。根据NASH的定义,肝脏中除了存在肝细胞脂肪变以外,还需要有肝细胞的损伤和炎症细胞的聚集。富含脂质的肝细胞可以通过脂毒性诱发肝细胞损伤,而肝细胞损伤又和肝脏炎症的发生互为因果,因为损伤的肝细胞可诱导炎症细胞向肝脏招募,炎症细胞会产生炎性介质和炎性因子导致肝细胞损伤。
在NAFLD的发生发展过程中,巨噬细胞的激活和极化,特别是M1型巨噬细胞数量或M1与M2型巨噬细胞比例的增加,在促进肝脏炎症方面起到关键作用。然而,巨噬细胞识别肝损伤信号的具体分子机制和调控巨噬细胞极化和活化的因素至今尚未明确。MicroRNA (miRNA) 是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA分子,它们在动植物中参与转录后基因表达调控。最近,有研究提示miRNA是代谢性炎症发生的重要调控因子,细胞中的miRNA可以通过与Ago2蛋白结合后分泌、被包裹到外泌体中分泌等不同的方式分泌到细胞外。当细胞受到的损伤缓慢而温和时,大部分的miRNA通过外泌体作为载体释放到细胞外。miR-192-5p是肝脏中含量最丰富的miRNA之一,血清miR-192-5p水平已被证实可能是NAFLD疾病进展的生物标记物。然而,有关miR-192-5p在肝脏炎症发生中的作用至今鲜见研究报道。
近日,上海交通大学医学院附属新华医院消化内科暨上海市小儿消化与营养重点实验室范建高教授研究团队,在肝病领域权威期刊Hepatology杂志(影响因子14.971)在线发表题为“Lipotoxic Hepatocyte-Derived Exosomal miR-192-5p Activates Macrophages via Rictor/Akt/FoxO1 Signaling in NAFLD”的原创性研究成果,首次提出肝细胞源性外泌体miR-192-5p参与肝脏巨噬细胞激活及极化过程,进而诱导脂肪变性的肝脏发生炎症损伤。该研究阐明了脂肪肝时肝脏巨噬细胞活化的新机制,为阻断巨噬细胞介导的肝内炎症、治疗NASH的药物研发提供了新靶点。

该研究发现,与健康对照组相比,肝活检证实的NASH患者血清miR-192-5p水平显著升高,且与血清ALT及AST水平、肝脏脂肪变、肝细胞气球样变及小叶炎症的病理评分存在显著正相关。在高脂肪高胆固醇饲料喂养16周的NASH大鼠模型中可以看到同样的结果。同时,血清miR-192-5p水平与肝脏M1型巨噬细胞数量及肝内M1型巨噬细胞炎症因子水平存在相关性,但与M2型巨噬细胞炎症因子水平不相关。此外,NASH患者及NASH模型大鼠的血清外泌体及棕榈酸诱导的脂毒性肝细胞外泌体的数量及其中的miR-192-5p水平都较各自的对照组显著升高,这提示NASH状态时肝细胞可释放富含miR-192-5p的外泌体,且该外泌体与巨噬细胞诱导的肝内炎症相关。
进一步的研究发现,脂毒性肝细胞释放的外泌体可被巨噬细胞摄取,引起巨噬细胞的miR-192-5p水平升高,同时M1型表面分子CD11b CD86表达增多,且促炎因子iNOS、 IL-6和TNF-α水平升高,但对M2型表面分子CD11b CD206及M2型特异性细胞因子Arg1、Ym1及Fizz1无显著影响。在巨噬细胞中过表达miR-192-5p可得到同样的结果。这提示脂毒性肝细胞外泌体及外泌体miR-192-5p可诱导巨噬细胞的M1型极化及促炎因子的释放。
通过对miRNA靶基因数据库的筛选及进一步双荧光素酶报告基因实验和western-blot实验的验证,Rictor被确定为miR-192-5p诱导巨噬细胞M1型极化的直接作用靶基因。在巨噬细胞中敲除Rictor后,可增加CD11b+CD86+细胞的比例,促进其向M1型巨噬细胞转化,同时诱导M1型细胞因子表达显著升高。Rictor是mTORC2的一个重要亚基,后者是催化Akt的Ser473位点磷酸化的重要上游激酶。研究人员发现,在巨噬细胞中过表达miR-192-5p可抑制靶基因Rictor的表达,从而降低下游Akt和FoxO1的磷酸化水平,增加FoxO1的活性,最终引起一系列炎症反应。
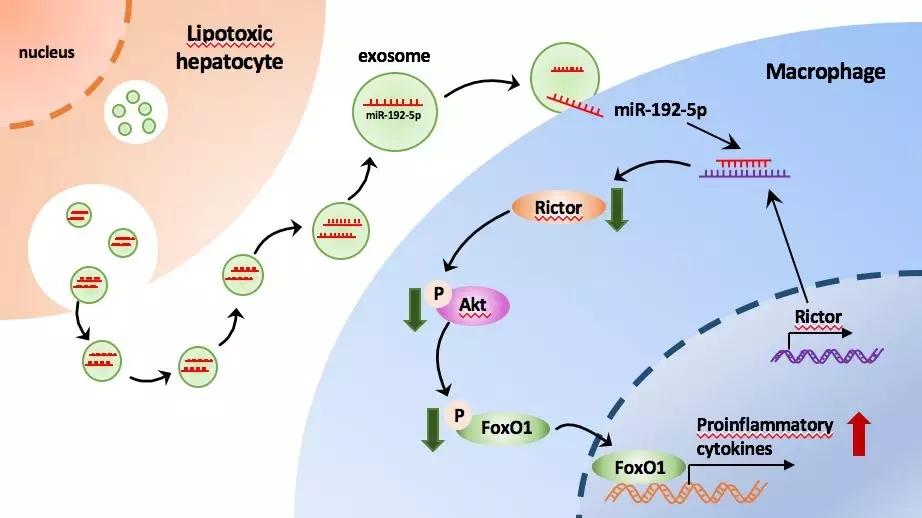
总之,该研究通过一系列体内体外实验证实,NAFLD时细胞来源的外泌体miR-192-5p,可以通过调控Rictor/Akt/FoxO1信号通路激活巨噬细胞,促进炎症反应的发生。血清外泌体miR-192-5p水平有可能作为NAFLD及NASH的无创诊断标记物及潜在的药物治疗靶点。
原文链接:
查看更多