查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2024年4月19日,《细胞代谢》(Cell Metabolism)期刊在线发表了中山大学肿瘤防治中心/华南恶性肿瘤防治全国重点实验室林东昕、郑健、王力勤研究团队题为醌二氢蝶呤还原酶缺乏驱动胰腺癌免疫抑制的研究成果。该研究发现,胰腺癌因醌二氢蝶呤还原酶(QDPR)失活致其生物蝶呤代谢异常导致胰腺癌形成免疫抑制微环境,从而逃逸免疫抑制并抵抗免疫检查点阻断剂的治疗。这项成果首次揭示肿瘤细胞生物蝶呤代谢对肿瘤免疫的调控作用,为克服胰腺癌免疫治疗抵抗提供了新思路。
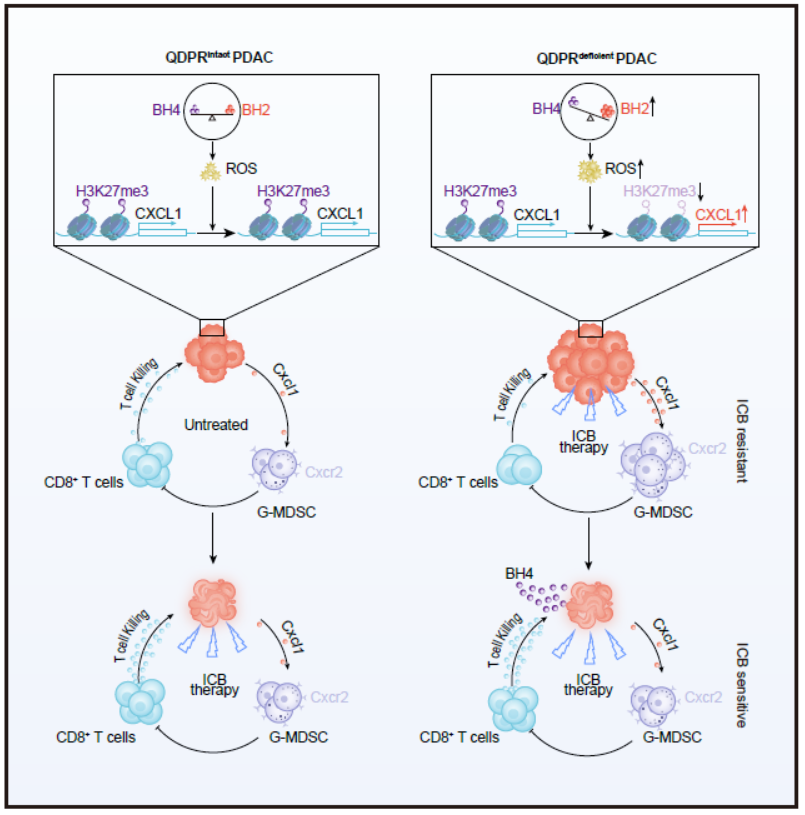
胰腺癌被称为“癌中之王”,其恶名源自该肿瘤的高度恶性表型和对各种治疗方法的抵抗。严重的免疫抑制性肿瘤微环境是胰腺癌的特征之一,也是其对抗免疫检查点阻断剂如PD-1和CTLA-4抗体治疗的主要原因。癌细胞本身所发生的遗传或表遗传改变可导致其代谢重编程;而代谢重编程是获得塑造有利于其恶性表型肿瘤微环境能力的重要机制。然而,何种代谢重编程导致胰腺癌的免疫逃逸和抗免疫治疗并不很清楚。生物蝶呤代谢是体内重要的物质代谢之一,涉及多步骤酶促合成和转换过程,主要产物有醌二氢生物蝶呤(qBH2)、二氢生物蝶呤(BH2)和四氢生物蝶呤(BH4),后者是多种芳香族氨基酸羟化酶和一氧化氮合酶的辅助因子。正常的生物喋呤代谢在维护机体正常免疫状态中也起重要作用。因此,探究肿瘤中是否发生生物喋呤代谢重编程,以及如果发生重编程是否会影响到肿瘤免疫微环境是一个具有理论和实际意义的重要问题。
本项研究从组学数据分析入手,发现胰腺癌中生物蝶呤代谢酶活性低与患者生存时间短相关。于是在小鼠原代胰腺癌细胞中,分别将生物蝶呤代谢通路中的6个关键酶基因敲除,发现只有敲除QDPR的细胞移植到小鼠胰腺后能显著增殖并加快动物死亡。有趣的是,此种作用只在免疫健全小鼠中存在,而在免疫缺陷小鼠中则不存在。
对原位移植瘤进行的单细胞RNA测序分析显示,QDPR缺乏的肿瘤细胞其肿瘤微环境中髓性抑制细胞(MDSC)显著增多而CD8+T细胞显著减少且功能受损,表现出典型的免疫抑制性。一系列详尽的功能机制分析证明,QDPR缺乏阻断了qBH2生成BH4,而被氧化形成BH2;这种代谢重编程使癌细胞中BH2/BH4比值增高,令一氧化氮合酶从生成NO改变为生成活性氧(ROS)。ROS增多使趋化因子CXCL1基因启动子区抑制表达的组蛋白K27三甲基化减少,从而上调了CXCL1的表达。过表达的CXCL1招募MDSC至肿瘤组织,形成免疫抑制微环境。
研究示意图
中山大学肿瘤防治中心刘记副研究员、博士生贺小威、邓爽、赵思涵和张少萍为本文的并列第一作者。郑健研究员、林东昕院士和王力勤研究员为该研究论文的共同通讯作者。
来源|中山大学肿瘤防治中心
查看更多