查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






大脑是人类在长期进化中发展起来的最为重要的思维和意识器官,对大脑疾病的自我认识从古至今备受关注,也是目前全球热门的“脑科学”。阿尔茨海默病(AD)就是当下大众最为关注的大脑病变。
在组织病理学上,AD的特征是脑中存在细胞外斑块和细胞内神经原纤维缠结。尽管过去几十年,全球的科学家们一直致力于攻克AD。然而,时至今日,已有20年时间没有治疗AD的新药问世了。科学家们历经无数次尝试,试图找寻AD的新药,但多项针对β淀粉样蛋白的临床试验均以失败告终。AD成为仅次于癌症的致死性脑病,是最令科学家费解的疑难问题,也让普通百姓倍感纠结,或许大家都存在这样的担忧——随着年龄的增长,我会成为一名AD患者吗?

图1:AD患者大脑记忆拼图的缺失(图虫创意)
因此,多年来,无数科研工作者都在试图揭开AD发病及发展机制的“神秘面纱”,也在探索最有效、最先进的治疗方法。那么,近期的中国学术界又有何新进展呢?
丨Nature:中国学者揭示先天免疫系统反应蛋白IFITM3在AD中的作用
γ-分泌酶是AD发病过程中的重要致病分子。小分子γ-分泌酶调节剂(GSMs)可特异地抑制Aβ42产生而不影响其他位点和底物切割, 已经成为AD药物开发有前途的策略之一。2020年9月2日,纪念斯隆·凯瑟琳癌症研究中心来自中国的学者李月明在Nature杂志在线发布了一项新研究,该研究开发了一种“无偏见”的化学生物学方法,使用GSMs鉴定γ-分泌酶调节蛋白[1,2]。

图2: The innate immunity protein IFITM3 modulates γ-secretase in Alzheimer’s disease
研究人员通过使用E2012 BPyne GSM探针,鉴定出了一种与AD发病有关的调节蛋白——先天免疫系统反应蛋白IFITM3。IFITM3具有广泛的抗病毒活性,可作为先天免疫应答中抵抗感染的第一道防线。
而在这项工作中,研究人员发现,IFITM3可作为γ-分泌酶复合物的一部分,上调γ-分泌酶活性以产生Aβ,而细胞中IFITM3的敲低和敲除(KO)将减少γ-分泌酶活性,KO细胞中IFITM3的重新表达完全恢复了这种活性。其次,IFITM3表达随着衰老和FAD突变而增加,IFITM敲除可以降低5XFAD小鼠中的γ-分泌酶活性和斑块沉积;一部分迟发性AD(LOAD)患者具有较高水平的IFITM3蛋白,并表现出较高的γ-分泌酶活性以产生Aβ。此外,IFN-γ可处理诱导原代神经元培养物中的IFITM3表达,并直接增强γ-分泌酶活性,其他促炎细胞因子IL-6和IL-1β在人星形胶质细胞(Aβ的另一来源)中诱导IFITM3表达,导致γ-分泌酶活性增加。最后,该研究证明了IFITM3靠近γ-分泌酶的活性位点,这是第一个被活性定点抑制剂标记的γ-分泌酶调节蛋白。这些抑制剂用于鉴定γ-分泌酶。
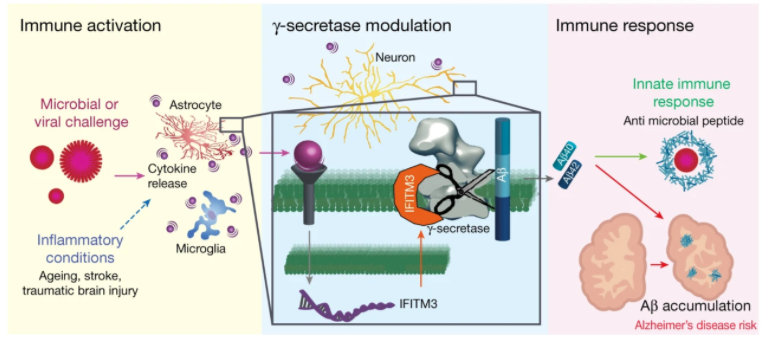
图3: IFITM3蛋白是连接感染/先天免疫与Aβ产生/AD风险的桥梁
简而言之,这项工作揭示了神经炎症调节γ-分泌酶活性并因此影响Aβ产生的独特机制。IFITM3作为一种免疫开关,可以增加γ-分泌酶活性和Aβ产生的抗微生物活性,可能导致增加老年痴呆症的风险。此外,这项工作首次确定了LOAD亚群,这对于了解该疾病的具体机制和开发精确药物治疗非常有价值。这项工作还为研究γ-分泌酶调节蛋白在不同生理和病理条件下对γ-分泌酶的调节开辟了新途径。
因此,IFITM3可以作为一个值得考虑的生物标志物和药物靶标,在对迟发型阿尔兹海默症病人的分类中可以起到很好的区分作用,并为其制定个性化治疗。
丨Science Advances:新的药物递送途径siRNA,可将AD治疗药物精准运输至大脑
有毒聚集的淀粉样β积累是AD的关键致病事件,它是由淀粉样前体蛋白(APP)通过BACE1(β位APP裂解酶1)和γ分泌酶裂解而产生的。上述研究对如何调节γ分泌酶活性提出了新的途径。来自南开大学、河南大学的学者于10月9日,在Science Advances杂志上发布了一项研究,提出了一种新的AD治疗方法:通过小干扰RNA(siRNA)对BACE1的进行特异性沉默,以期达到抑制AD进展的目的[3,4]。

图4: Blood-brain barrier–penetrating siRNA nanomedicine for Alzheimer’s disease therapy
与基于小分子的方法相比,小干扰RNA(siRNA)通过以高靶向特异性,低有效剂量和相对简单的药物开发过程直接阻断致病性基因表达,为脑部疾病的治疗提供了有希望的疗法。沉默BACE1的慢病毒载体中的siRNA也已显示可改善AD神经病理学。然而,有效、安全地将siRNA全身性地递送至大脑仍然具有挑战性,这反映了生物屏障的存在。最近的研究表明,纳米运输方法具有克服这些挑战的巨大潜力。
该研究开发了一种糖基化的“三重相互作用”稳定的聚合siRNA纳米药物(Gal-NP @ siRNA),以靶向APP / PS1转基因AD小鼠模型中的BACE1。Gal-NP @ siRNA具有卓越的血液稳定性,可以通过血糖控制的葡萄糖转运蛋白1(Glut1)介导的转运有效穿透血脑屏障(BBB),从而确保siRNA降低BACE1的表达并修饰相对途径。值得注意的是,Gal-NP @ siBACE1给药可恢复AD小鼠的认知能力,而无明显副作用。这种策略支持RNA干扰疗法在神经退行性疾病中的实用性。
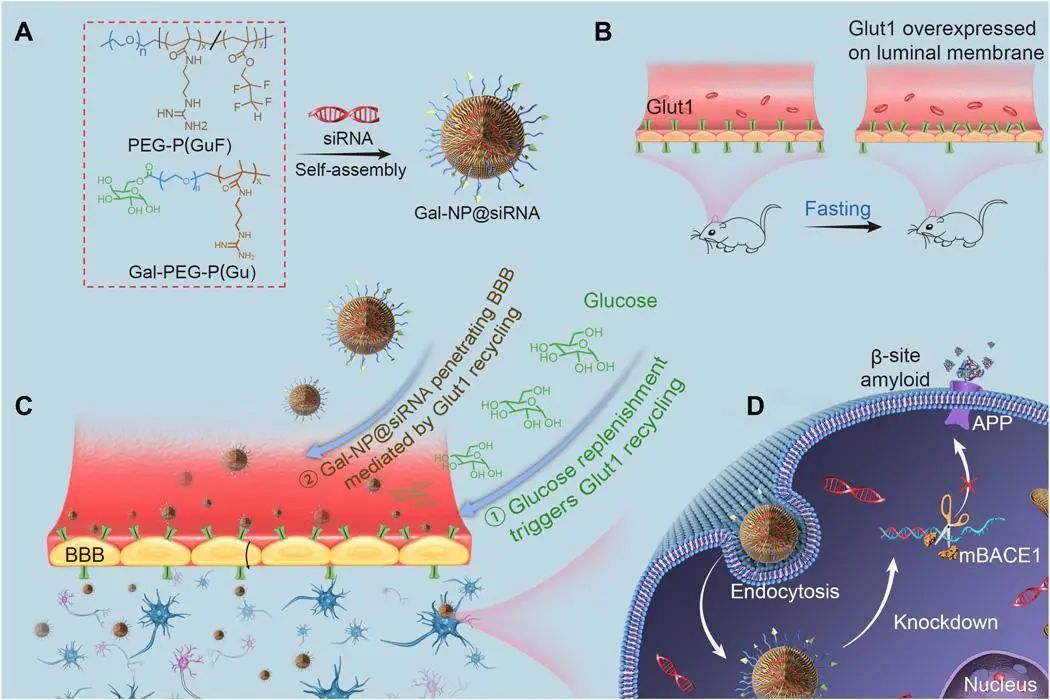
图5: siRNA纳米药物(Gal-NP @ siRNA)的形成以及APP / PS1转基因小鼠中AD病理学
有专家认为,在该项工作中报告的siBACE1纳米递送方法,虽然是使用AD小鼠模型中对其进行了评估,但该模型具有较大临床转化的潜力。
人脑研究大突破:科学家发现AD治疗的新靶标
虽然,上述两项研究对与AD发病相关的BACE1和γ分泌酶,两种酶类进行了逐一突破,但遗憾的是,这两项研究均是在小鼠模型中的发现,距其转化为临床研究还有很长的路程。可喜的是,今年在对人脑AD发病机制的研究也有了新的突破。同样是来自的中国的学者——香港科技大学的研究人员连发两篇论文,利用新开发的方法研究AD患者的大脑,确定了治疗阿尔茨海默病的新靶点。这种新方法也使研究人员能够测量潜在药物对AD患者的影响,为AD研究和药物开发开辟了新的方向[5,6]。

图6: 研究成果已在国际权威科学期刊PANS和Cell Reports发表
AD尚且无法治愈的一个原因是——传统的研究方法在确定药物开发的分子靶点方面能力有限。分子和病理途径分析一般将AD患者的大脑作为一个整体进行检查分析,通常低估了不同脑细胞类型对AD的作用及其异常。尤其是那些不太常见的细胞类型,如小胶质细胞(大脑的常驻免疫细胞)和神经血管细胞(特别是内皮细胞)。来自香港科技大学的研究团队不仅解决了“AD靶点开发困难”这一难题,还同时在内皮细胞和小胶质细胞发现了多个潜在的新分子靶标。
该研究团队利用先进的单细胞转录组分析技术,分析AD患者死后大脑中特定细胞的功能。这项技术让研究人员在单细胞水平上追踪传统工具无法观测到的大脑分子变化。因此,该研究首次发现血管自然的增新程序和内皮细胞亚群中的免疫启动与AD的发病机理有关联,显示血管失调与AD之间存在联系。研究还发现了新型分子靶标,有助恢复AD患者的神经动态平衡。
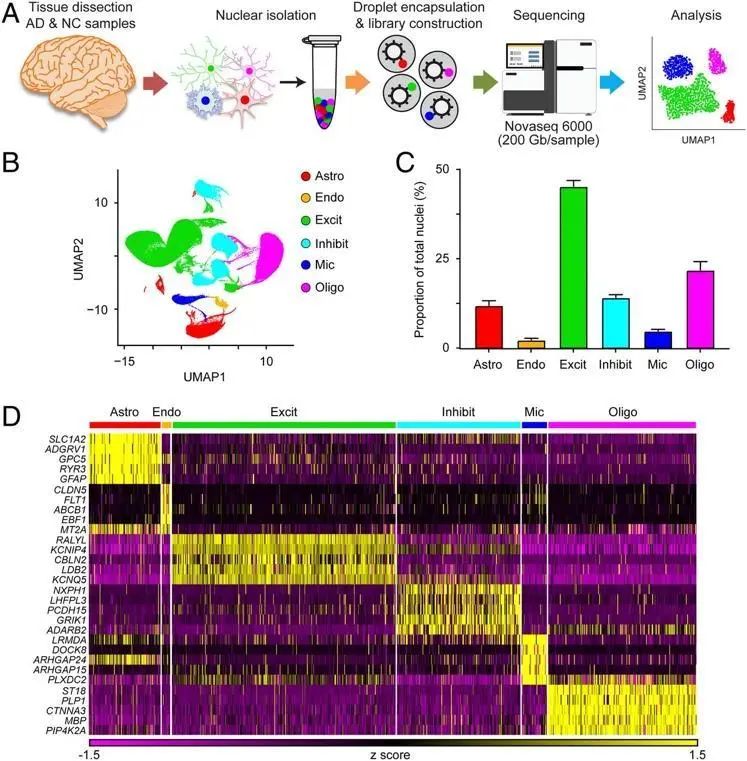
图7: AD前额叶皮层的单核转录组分析
此外,团队亦利用相关技术分析了细胞因子白介素33(IL-33)的作用机制。IL-33是重要的免疫讯号蛋白,有机会发展成为有效治疗AD的新药物。研究人员发现,IL-33可以通过刺激小胶质细胞特定亚型的生长,促进对淀粉样蛋白的清除,从而改善阿尔茨海默病的病理特征。团队更在小胶质细胞转化为一个负责去除病原体的吞噬状态机制方面,取得了突破性成果。
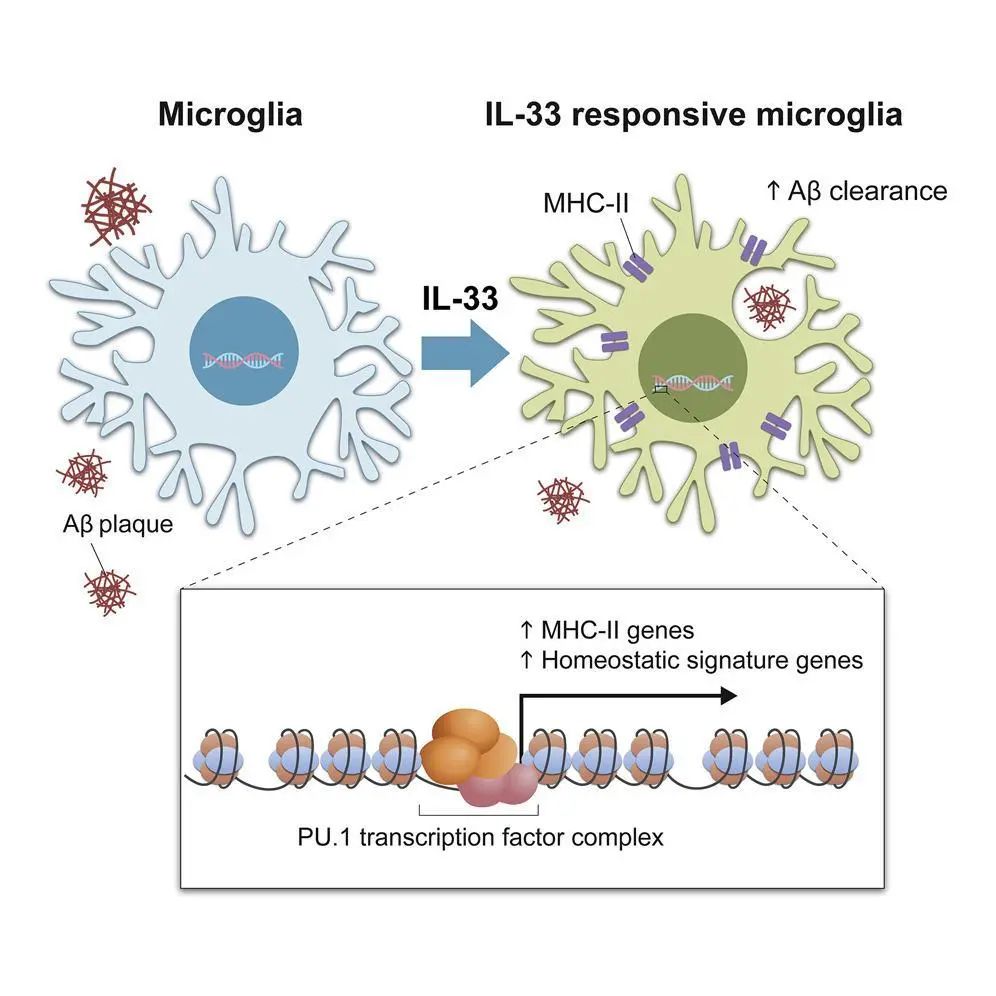
图8: IL-33诱导AD中小胶质细胞亚群表达MHC-II分子
参考文献
1. BioArt. Nature | 李月明团队揭示先天免疫系统反应蛋白IFITM3在阿尔茨海默病中的作用. BioArt (2020).
2. Hur, J.-Y. et al. The innate immunity protein IFITM3 modulates γ-secretase in Alzheimer’s disease. Nature 586, 735-740, doi:10.1038/s41586-020-2681-2 (2020).
3. 枫叶. Science Advances | 重大进展!薛雪/师冰洋/郑蒙开发新的递送方法,将siRNA递送至大脑治疗阿尔茨海默病. iNature (2020).
4. Zhou, Y. et al. Blood-brain barrier–penetrating siRNA nanomedicine for Alzheimer’s disease therapy. Science Advances 6, eabc7031, doi:10.1126/sciadv.abc7031 (2020).
5. Lau, S.-F. et al. IL-33-PU.1 Transcriptome Reprogramming Drives Functional State Transition and Clearance Activity of Microglia in Alzheimer’s Disease. Cell Reports 31, 107530, doi:https://doi.org/10.1016/j.celrep.2020.107530 (2020).
6. Lau, S.-F., Cao, H., Fu, A. K. Y. & Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer’s disease. Proceedings of the National Academy of Sciences 117, 25800, doi:10.1073/pnas.2008762117 (2020).
来源:临床前线
查看更多