查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2019年9月29日,中国首个免疫治疗药物欧狄沃(纳武利尤单抗)正式获得中国国家药品监督管理局(NMPA)批准扩大适应症,适用于治疗接受含铂类方案治疗期间或之后出现疾病进展且肿瘤PD-L1表达阳性(表达PD-L1的肿瘤细胞≥1%)的复发性或转移性头颈部鳞癌患者(SCCHN),成为首个且目前唯一在我国获批该适应证的肿瘤免疫治疗药物。这一新适应症的获批无疑将为我国的头颈部鳞患者带来希望!
NMPA对纳武利尤单抗头颈部鳞癌适应证的获批的主要循证证据是基于CheckMate 141研究结果。CheckMate 141是一项随机、全球性、Ⅲ期临床研究,受试者是361例接受含铂类方案治疗期间或治疗后6个月内出现进展的复发性或转移性SCCHN患者。结果显示,与标准治疗(多西他赛、甲氨蝶呤或西妥昔单抗)相比,纳武利尤单抗可提高患者的生存获益,改善生活质量。本期我们特邀中山大学肿瘤防治中心的宋明教授解读CheckMate 141研究中纳武利尤单抗治疗SCCHN的安全性数据。
PD-1/PD-L1抑制剂的不良反应谱不同于传统抗肿瘤药物
与传统抗肿瘤药物不同,免疫检查点抑制剂(ICI)通过利用机体自身的免疫系统杀伤肿瘤[1,2]。因而,ICI引起的不良反应谱和应对策略与化疗及靶向药物有所不同。免疫相关不良反应(irAE)是ICI主要的治疗相关不良反应,其可能机制是ICI引发的自身免疫反应[3]。一项系统性回顾与网状荟萃分析结果充分显示,PD-1/PD-L1单抗的不良反应普遍低于传统的抗肿瘤药物[4]。



 纳武利尤单抗3-4级治疗相关严重不良事件发生率较标准治疗组下降60%
纳武利尤单抗3-4级治疗相关严重不良事件发生率较标准治疗组下降60%
CheckMate 141期中分析观察结果:3-4级不良反应发生率更低
中位随访时间5.1个月(范围,0-16.8个月)时,可见纳武利尤单抗组的3-4级治疗相关不良反应发生率(TRAE)较标准治疗(IC)组更低(13.1% vs. 35.1%)。纳武利尤单抗组中最常见的任意级别不良反应为疲劳(14.0%)、恶心(8.5%)、皮疹(7.6%)、食欲减退(7.2%)和瘙痒(7.2%)。
在可能与免疫相关的不良反应中,纳武利尤单抗组的胃肠道不良反应发生率低于标准治疗组(6.8% vs. 14.4%,主要为腹泻),而皮肤不良反应发生率则高于标准治疗组(15.7% vs. 12.6%,主要为皮疹和瘙痒)。2.1%接受纳武利尤单抗治疗的患者发生肺炎;2例接受纳武利尤单抗治疗的患者由于治疗相关原因死亡,分别为肺炎和高血糖。1例接受标准治疗的患者因治疗相关的肺部感染死亡[5]。
发生率≥5%的TRAE

CheckMate 141研究的2年安全性结果:无新增不良事件,可管理
CheckMate 141研究随访2年的安全性结果与既往分析一致,且可管理,无新增安全性信号。大多数3-4级TRAEs发生在开始治疗的前6个月内;纳武利尤单抗组3-4级TRAEs在开始研究治疗的前6个月、6 - 12个月和≥12个月内发生率分别为19.5%、2.5%和1.7%。纳武利尤单抗组TRAE为61.9%,低于标准治疗组的79.3%。其中,纳武利尤单抗3-4级严重TRAE发生率为15.3%,较标准治疗的36.9%下降60%。纳武利尤单抗组严重TRAEs发生率(7.2%)同样低于IC组(15.3%),药物毒性导致的死亡率与既往分析一致[6]。
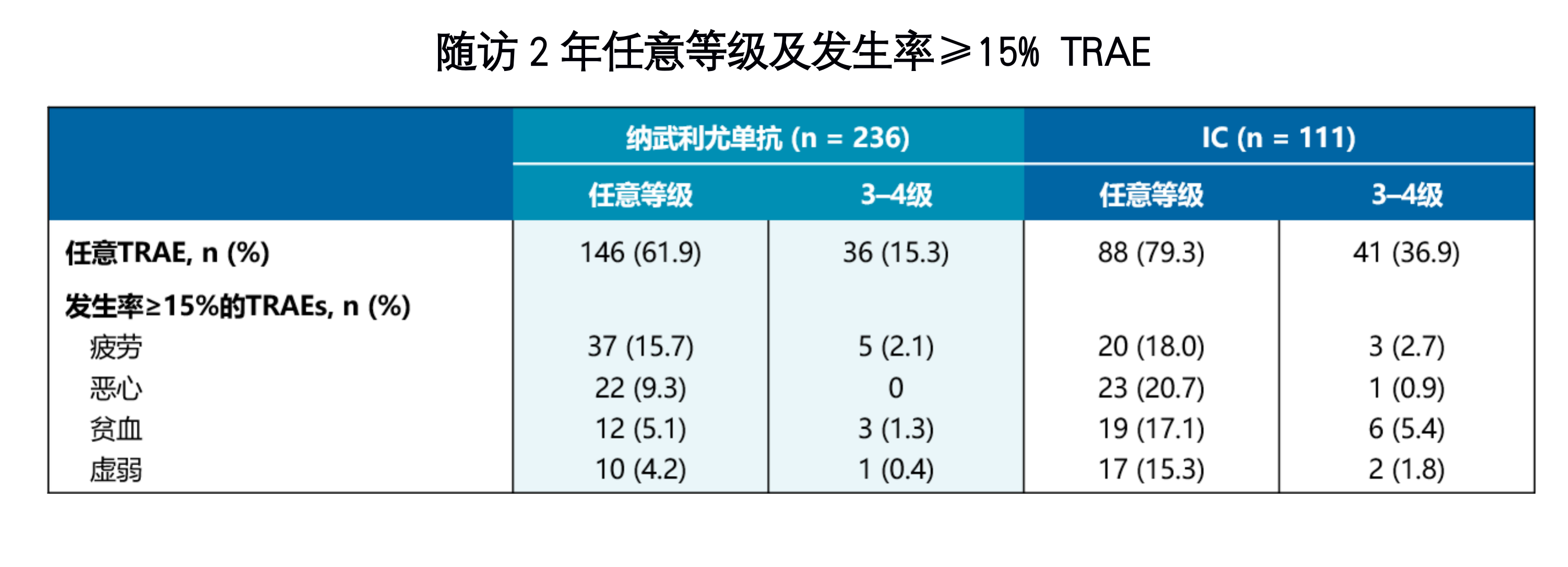
随访2年任意等级及发生率≥15% TRAE

亚洲人群安全性结果:与整体人群一致 [7]
在亚洲人群中,纳武利尤单抗组有16例(69.6%)出现治疗相关不良反应(TRAE),标准治疗组为10例(90.9%)。其中纳武利尤单抗组有2例(8.7%)患者,标准治疗组有3例(27.3%)出现3级或以上不良反应。·亚洲人群亚组中未观察到治疗相关死亡。在亚洲患者中,纳武利尤单抗治疗最常见的不良反应为食欲减退、瘙痒、皮疹和疲劳,标准治疗组最常见的不良反应为恶心、胃炎和食欲减退。
在可能与免疫相关的不良反应中,纳武利尤单抗胃肠道AE发生率为4.3%,低于标准治疗的18.2%。与此同时,纳武利尤单抗组的皮肤相关AE更为常见(43.5% vs. 9.1%,主要为瘙痒和皮疹)。
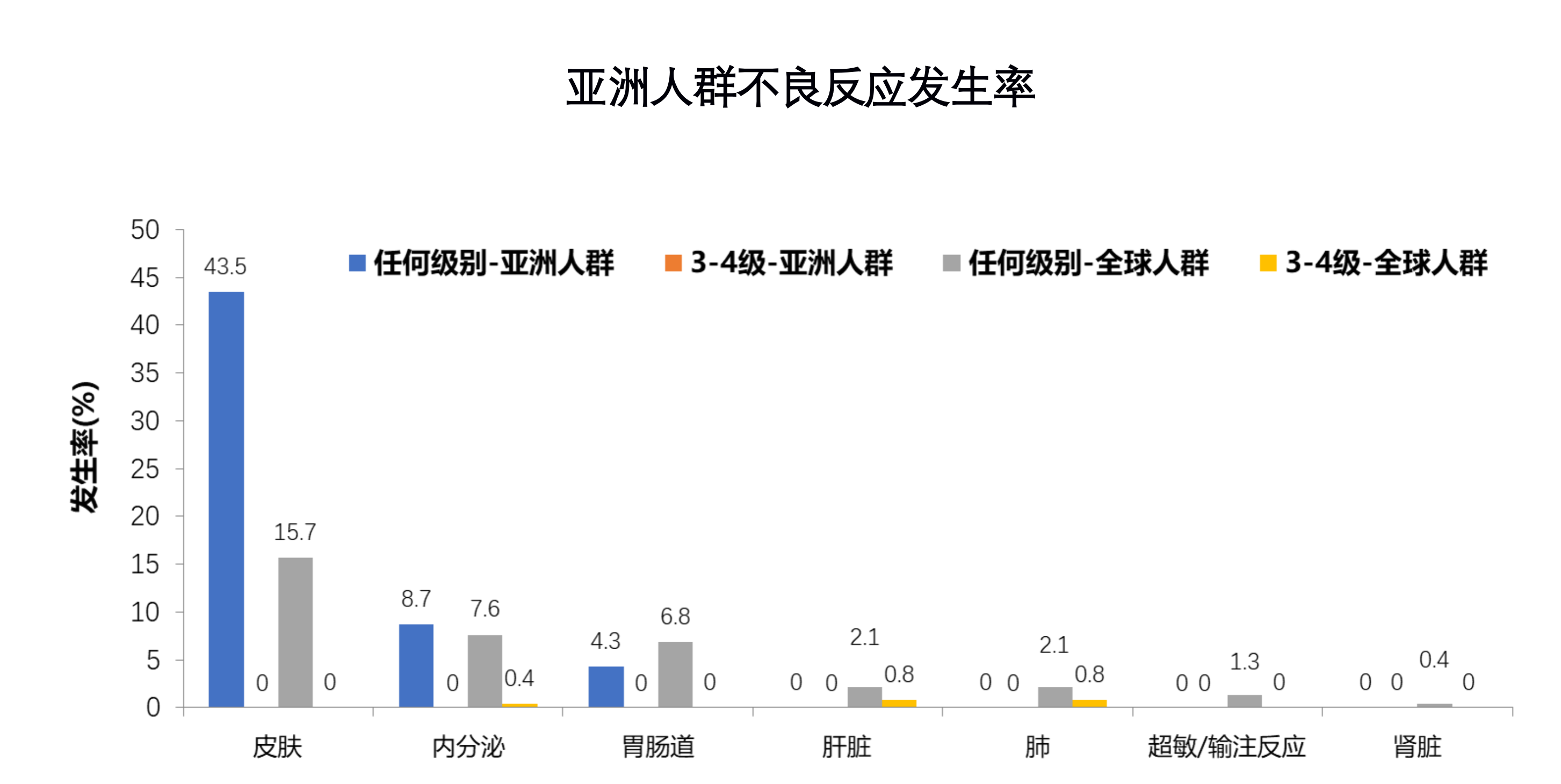
亚洲人群不良反应发生率

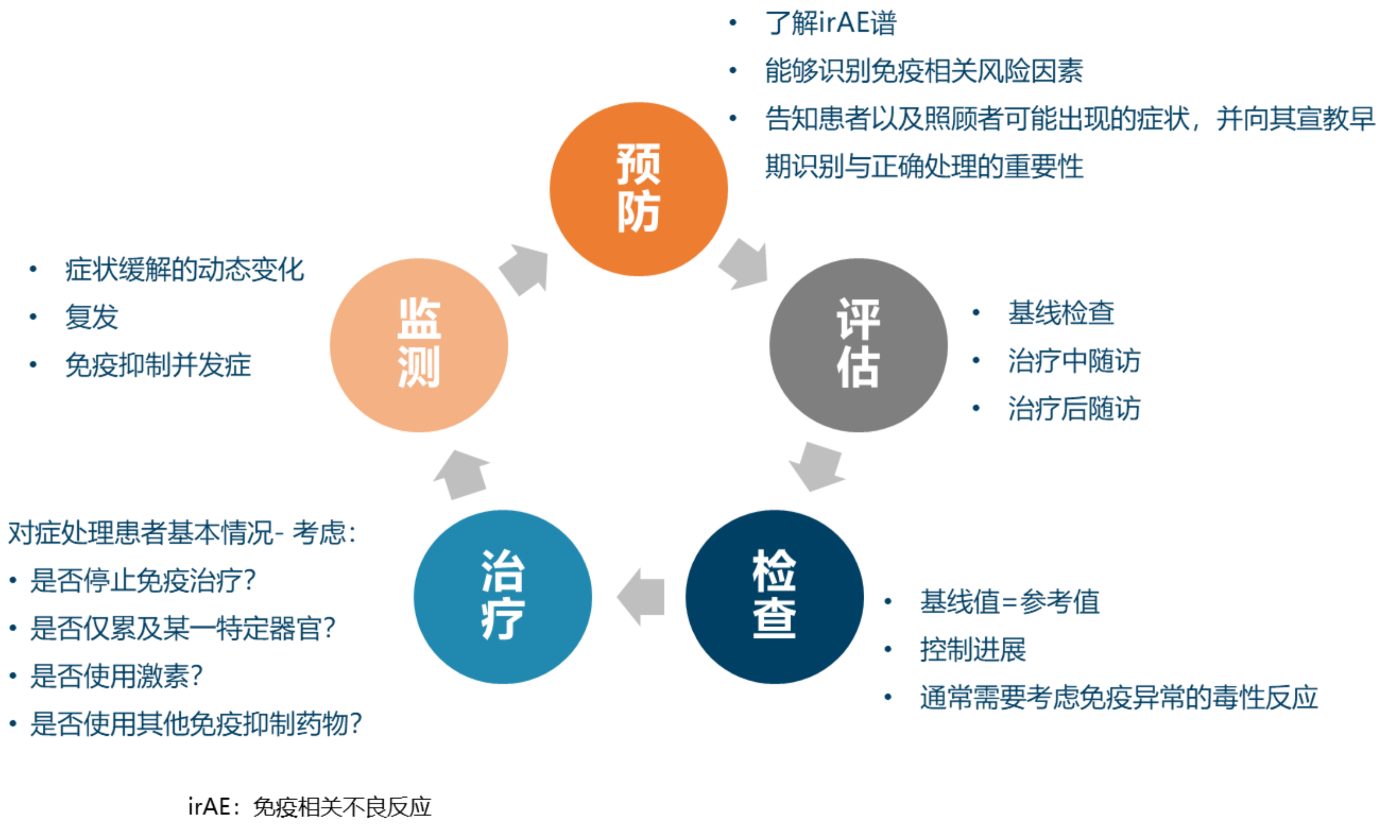
早期识别与科学管理对免疫相关不良反应至关重要
免疫相关不良反应(irAE)的管理主要包括毒性反应的识别和分级、免疫抑制治疗和根据患者个体情况调整免疫检查点抑制剂的给药等几个方面。其关键目标是早期识别症状和及时干预。不同临床指南推荐的irAE处理原则总体一致,通常轻度(I级)irAE需要加强监测,无需暂停免疫治疗,中度以上(≥2级)的irAE则需要暂停免疫治疗并使用以皮质类固醇为主的免疫调节剂,部分重度irAE需要永久停用免疫治疗。SCCHN患者发生严重irAE的风险较低,安全性可控。一项西班牙多中心真实世界研究显示,在50例接受纳武利尤单抗治疗的SCCHN患者中,无一例患者发生需要停药或使用全身激素治疗的irAE[8]。

宋明教授表示:PD-1/PD-L1抑制剂的不良反应谱不同于传统抗肿瘤药物,总体不良反应发生率低于化疗与靶向治疗,以皮肤、胃肠道、内分泌、肝脏相关反应最为常见。CheckMate-141研究结果显示,对于含铂类治疗进展后的复发/转移性头颈部鳞癌患者,纳武利尤单抗较标准治疗3-4级治疗相关不良事件发生率下降60%,且并未随治疗时间的延长出现新的安全性信号,其安全性优势是显著临床获益的重要组成部分。在免疫相关不良反应(irAE)临床处理上,关键是早期识别症状和及时干预,在CheckMate-141研究中纳武利尤单抗治疗复发/转移性头颈部鳞癌患者,发生严重irAE的风险较低,安全性可控。

参考文献:
1. DeVita and Rosenberg. N Eng J Med 2012, 366: 2207;
2. Chen DS, et al. Immunity. 2013 Jul 25;39(1):1-10
3. Postow MA, et al. N Engl J Med. 2018. 378(2): 158-168
4. Xu C, et al. BMJ. 2018 Nov 8;363:k4226.
5. Ferris RL, et al. N Engl J Med 2016;375:1856-67.
6. Ferris RL,et al.Oral Oncol. 2018 Jun;81:45-51.
7. Kiyota N, et al. Oral Oncol. 2017 Oct;73:138-146.
8. 郭晔等. 肿瘤预防与治疗. 2019;32(7):572-579
OPDHN-OO-0051-200302-210302
查看更多