查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





那是一个遍地都是黄金的时代。
20世纪70年代,抗体药物研发开启了掘金时代。哈佛医学院著名免疫学家Stuart Schlossman成为这场西部狂野角逐中速度最快的神枪手。
站在那个历史档口,抗体药物的宏伟蓝图已经有了隐约的轮廓。
首先,抗体结构和生物学特征的关键科学问题已经被逐一攻破;其次,在1975年,Georges Köhler和César Milstein在顶级期刊《自然》上公布了革命性的杂交瘤技术,将大规模抗体制备的梦想照进了现实。

Georges Köhler 和César Milstein因杂交瘤技术获得1984年诺贝尔生理或医学奖
此时,Schlossman教授正痴迷于研究T细胞的生物学特征。1979年,Schlossman和他的合作者鉴定出了三种针对T细胞抗原的单克隆抗体,其中一种被称为OKT3。很快,研究人员就发现,OKT3可以用于耗竭T细胞。这也就意味着,OKT3可能会成为治疗免疫排斥的得力干将。
兵贵神速。1981年,OKT3作为一种免疫抑制剂开启了治疗移植排斥的临床试验。5年后,OKT3(后来更名为muromonab-CD3)一举获得FDA批准,成为全球第一款获批上市的治疗性单抗药物。
在第一款单抗横空出世40年后,2021年4月,PD-1抑制剂dostarlimab获批上市,成为第100款获FDA批准上市的单抗药物。
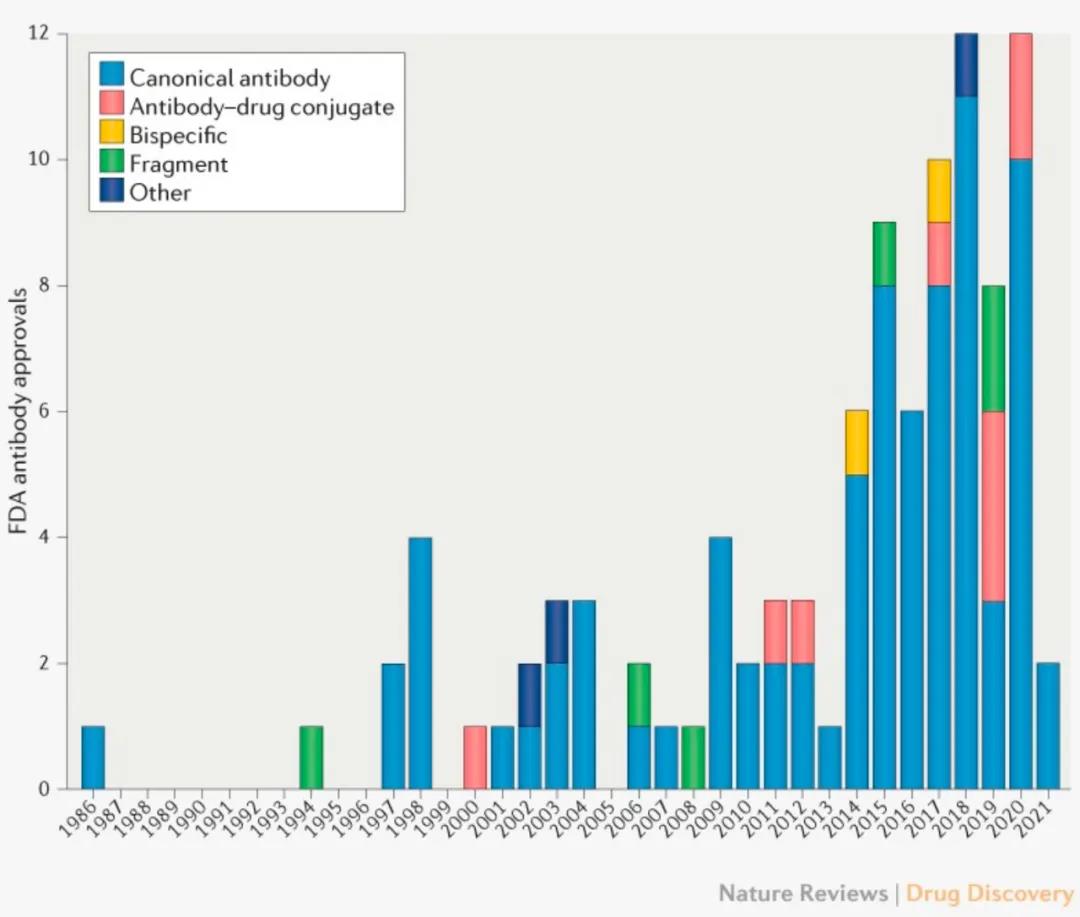
FDA单抗药物审批历史数据一览
40年,100款新药,单抗技术彻底改变了药物研发和疾病治疗的潮水方向。
然而40年只是一个逗号。珠联璧合,嫁接细胞毒性药物的抗体偶联技术,一箭双雕,双靶并进的双特异性抗体,以及让经典单抗药物更好更强的抗体工程化改造,都在塑造抗体药物更广阔的未来。
这仍然是一个遍地都是黄金的时代。
在FDA批准的100个抗体药物中,有42%的抗体靶向十个热门靶点,HER2就是其中最为耀眼的靶点之一。
靶向HER2的曲妥珠单抗也是抗体掘金时代的研发典范。1979年,Robert A. Weinberg教授团队首先发现了HER2基因[4]。8年后,加州大学洛杉矶分校的Dennis Slamon博士联手得克萨斯州立大学圣安东尼奥分校的Bill McGuire博士以及几名基因泰克的科学家共同发现,有大约20%~30%的乳腺癌存在HER2基因的扩增或过表达,HER2基因成为治疗乳腺癌强有力的靶点。10年后,FDA批准了曲妥珠单抗上市,用于治疗HER2阳性转移性乳腺癌。
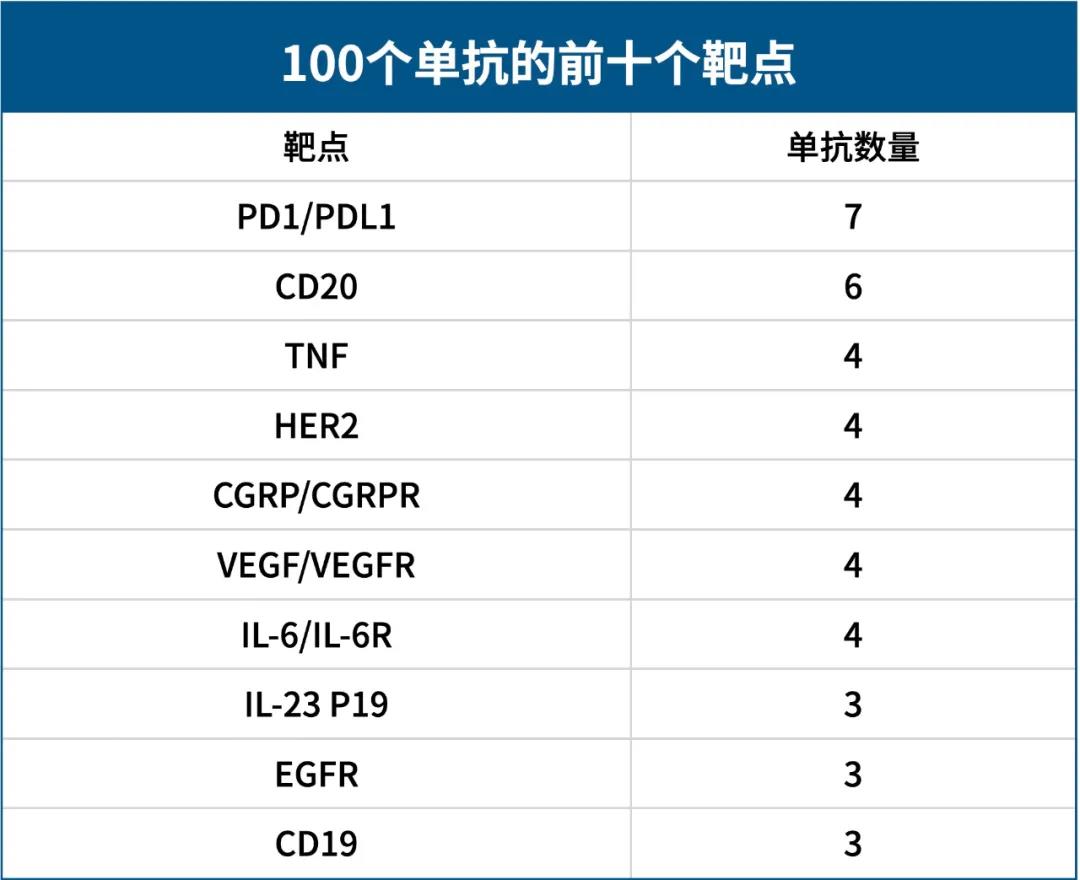
100款单抗药物中排名前十位的靶点
曲妥珠单抗的诞生彻底改变了HER2阳性晚期乳腺癌患者的命运。但完美之中总有不完美。后续的研究发现,并不是所有接受曲妥珠单抗治疗的患者都能获得良好的治疗效果。一些临床试验还提示,特定的基因型可以预测曲妥珠单抗的治疗效果。
我们知道,治疗性单克隆抗体可以通过直接或间接机制对肿瘤细胞进行诱导死亡。
直接机制包括阻断生长因子受体信号转导、直接跨膜信号转导等等;间接机制则需要与宿主免疫系统其他成员配合,包括补体介导的细胞毒性作用(CDC),抗体依赖性细胞介导的细胞吞噬作用(ADCP)和抗体依赖细胞介导的细胞毒性作用(ADCC)。
从单抗结构来看,直接作用机制主要依赖于抗体结合片段Fab,Fab能够特异性地识别肿瘤细胞表面的相关抗原,从而调控与该抗原相关的信号通路。而间接机制主要依赖于可结晶区域Fc。
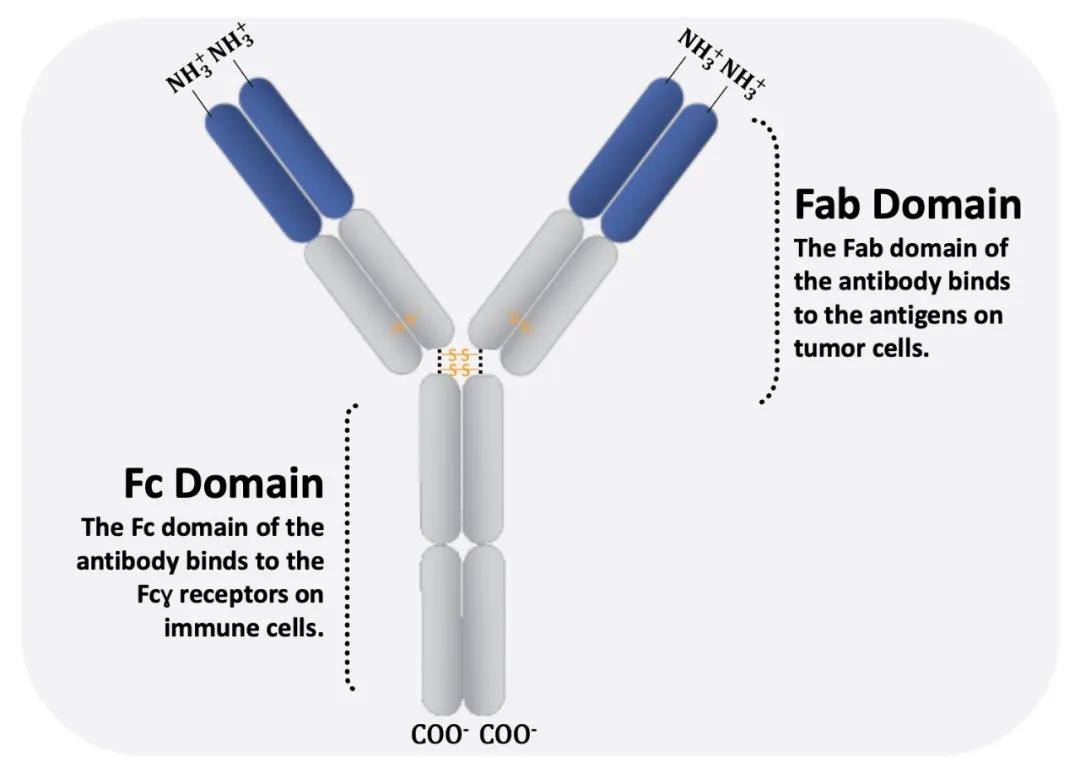
单抗药物的结构示意
对于曲妥珠单抗来说,直接机制包括受体内化、受体脱落,直接抗增殖活性等等;而间接机制则主要是ADCC。
对于隶属IgG1抗体的曲妥珠单抗来说,Fc受体家族-FcγR在ADCC机制中起着关键作用。
在ADCC中,抗体Fab段与肿瘤细胞上的靶标结合,而Fc段则被效应细胞上的FcγR识别。Fc与FcγR的相互作用激活了效应细胞,促使其释放细胞毒性颗粒,从而导致肿瘤细胞裂解。
FcγRs家族有三兄弟,分别为FcγRI (CD64), FcγRII (CD32) 和 FcγRIII (CD16)[8,9]。其中,和ADCC关系最为密切的是激活型受体CD16A(CD16的亚型)以及抑制型受体CD32B(CD32的亚型)。也就是说,抗体与CD16A的亲和力越高,ADCC效应越强;与CD32B亲和力越强,ADCC效应越弱。
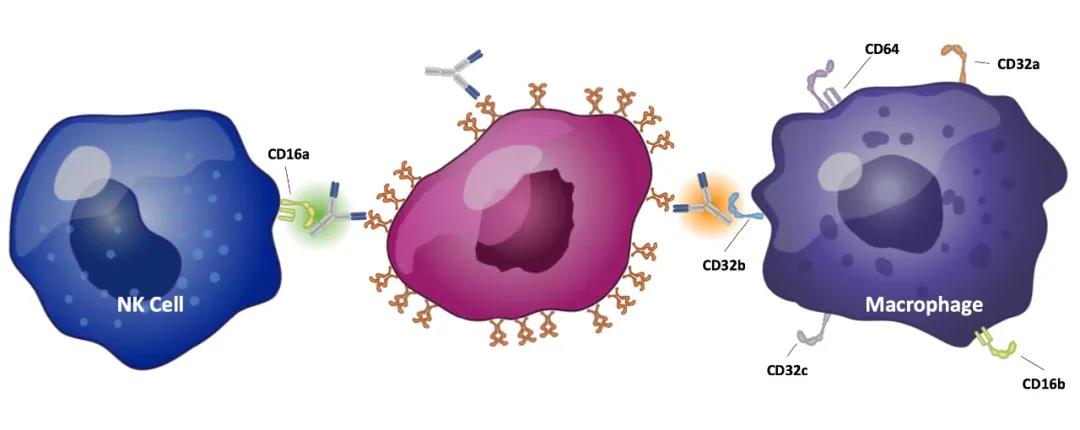
在FcγRs家族中,和ADCC关系最为密切的是激活型受体CD16A(CD16的亚型)以及抑制型受体CD32B(CD32的亚型)
后续研究发现,CD16A第158位氨基酸上,缬氨酸(V)或苯丙氨酸(F)的遗传多态性会极大影响其对IgG1的亲和力。研究显示,CD16A-V158等位基因比CD16A-F158等位基因具有更高的IgG1结合亲和力。在体外ADCC分析中, CD16A-V158等位基因型也显示了更强的ADCC活性[10]。
不同基因型对抗体亲和力的差异最终也转化成为治疗效果的差异,研究显示,CD16A-V158等位基因纯合患者接受曲妥珠单抗治疗的无进展生存期优于其他基因型患者。
那么,有幸具有CD16A-V158纯合子的人有多少呢?研究显示,CD16A-V158纯合子占全世界人口的10%~20%。也就是说,对于绝大部分接受曲妥珠单抗的患者来说,抗体引发的ADCC效应仍然有很大的提升空间。
摆在科学家面前的问题是,能不能通过改造抗体的Fc段,从而提升抗体的ADCC效应呢?
生命的进化给予我们人类极其精妙而宏伟的免疫系统。
每天,我们人体都会产生大约10亿个B细胞,而每个B细胞都会产生一种独特的抗体。所有的抗体都隶属五种免疫球蛋白,它们分别为IgG,IgA,IgM,IgD和IgE,在人体血清的免疫球蛋白中,60%为IgG。而FDA批准的单抗药物几乎全部都属于IgG。
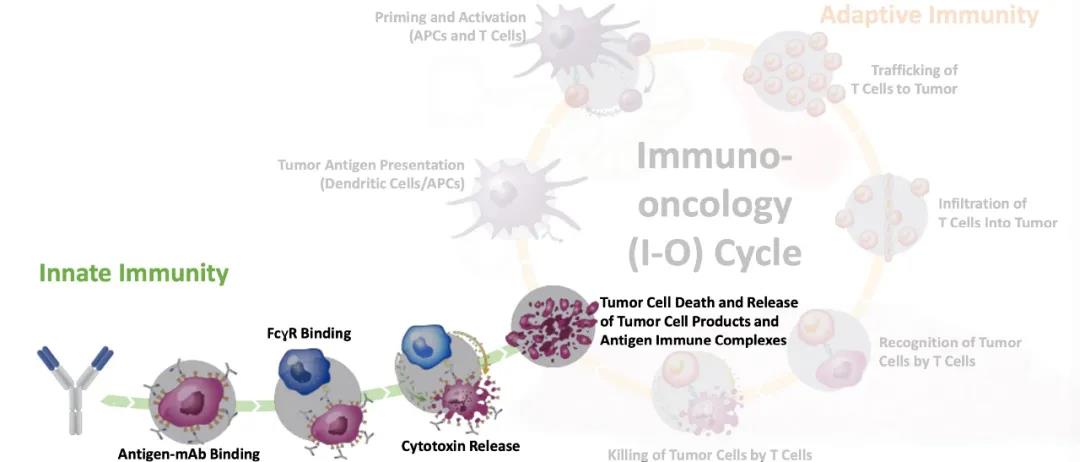
单抗药物间接机制示意图
IgG免疫球蛋白呈独特的Y型,上端的Fab段负责结合抗原,下端的Fc段则负责和其他免疫效应细胞结合。近年来,通过工程化改造Fc段实现抗体治疗效果的跃升,成为抗体药物研发的一股强劲的力量。
各种不同路径的工程化改造可以通过精准微调抗体Fc段数个氨基酸或其修饰方式,实现诸如半衰期优化、ADCC效应提升等一系列抗体性能提升,堪称是一门抗体微雕的艺术。
以糖基化改造为例,我们知道,人类 IgG 有两个位于 Asn297 的双触角聚糖,核心由 N-乙酰氨基葡萄糖和甘露糖组成,外围由岩藻糖,半乳糖等构成。在抗体的商业化生产过程中,糖基化是高度不均匀的,糖基的存在和组成在很大程度上会影响Fc的构象,从而进一步影响Fc与FcγR的结合能力。
有研究表明,去除岩藻糖可以显著增强抗体与CD16A的亲和力、从而提升ADCC活性。因此一大批基于去除岩藻糖的糖基化改造正在不同抗体药物中进行实验。
抗体示意图
除了糖基化改造之外,科学家还在用不同的方法去寻找可以改造抗体Fc段性能的氨基酸位点。
传统的丙氨酸扫描文库技术,利用丙氨酸体积小同时对蛋白质结构影响较小的特性,将其余19种非丙氨酸残基逐一替换成丙氨酸。由于将其他关键氨基酸替换成丙氨酸时,会导致蛋白质某些功能的减弱或衰退,因此可以鉴定某个氨基酸残基在蛋白质功能、活性位点、稳定性和形态等方面的作用。
除了丙氨酸扫描技术之外,科学家也尝试使用计算机算法分析,去预测某些关键氨基酸残基的作用。
2007年,MacroGenics公司的科学家使用酵母菌展示技术,发现了数个对ADCC效应至关重要的氨基酸残基[16]。通过对曲妥珠单抗近似抗体的Fc段引入F243L/R292P/Y300L/L235V/P396L等五个位点突变,MacroGenics公司的科学家研发出了曲妥珠单抗的工程化改造抗体马吉妥昔单抗(margetuximab)。
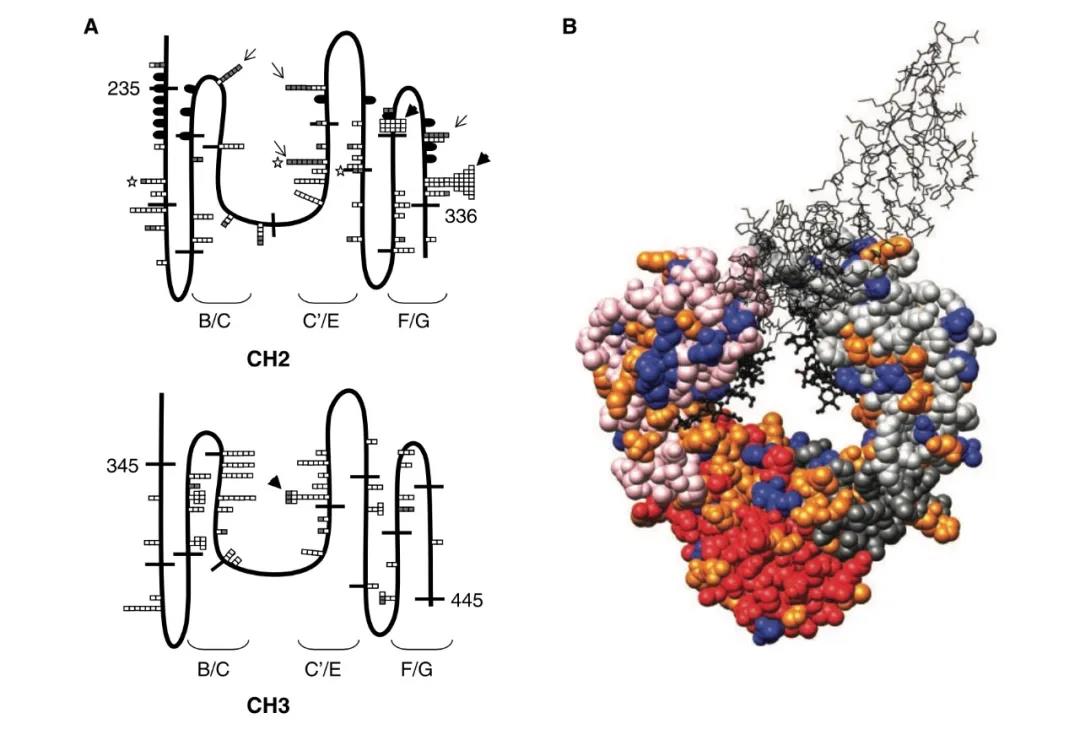
酵母菌展示技术鉴定的重要Fc氨基酸残基位点
进一步研究发现,马吉妥昔单抗与曲妥珠单抗在HER2的结合能力上表现一致,表明抗体的Fc段改造并没有影响抗原的结合能力。
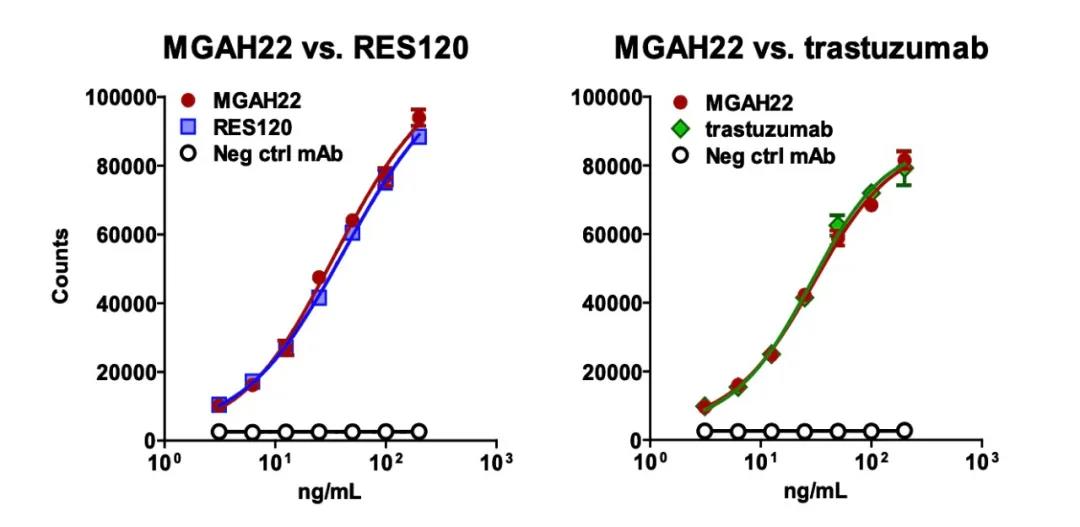
马吉妥昔单抗与曲妥珠单抗在HER2的结合能力上表现一致
与野生型的Fc结构域相比,马吉妥昔单抗与激活型受体CD16A的两个等位基因的亲和力显著增加,而与抑制型受体CD32B的亲和力显著下降。
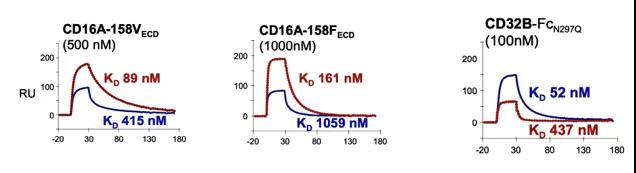
马吉妥昔单抗与激活型受体CD16A的两个等位基因的亲和力显著增加,而与抑制型受体CD32B的亲和力显著下降。
改造后抗体对于FcγR亲活力的改变也直接影响了抗体引发的ADCC效应。与野生型的Fc结构域抗体相比,马吉妥昔单抗能够引发更强的ADCC效应。同时,在携带人类CD16A-F158的转基因小鼠中,马吉妥昔单抗也表现出了更高的抗肿瘤活性。
那么,抗体微雕对于ADCC效应的提升能否进一步转化为真实的临床获益呢?毕竟,任何有关药效提升的结构改造如果不能最终体现在临床获益上,将都是徒劳无功的。只有拿出强有力的临床获益数据,才能最终验证临床前的假设。
2015年8月,马吉妥昔单抗在17个国家/地区的536名患者中启动了与曲妥珠单抗头对头的SOPHIA 3期临床试验。
536名曾经接受过2种以上抗HER2治疗后疾病进展的乳腺癌患者,被随机分配接受马吉妥昔单抗+化疗(n=266)或曲妥珠单抗+化疗(n=270)治疗。结果显示,与曲妥珠单抗联合化疗相比,马吉妥昔单抗联合化疗显著降低了疾病进展或死亡风险(HR=0.76;95%CI,0.59-0.98;P=0.033),两组的中位无进展生存期分别为5.8个月和4.9个月。
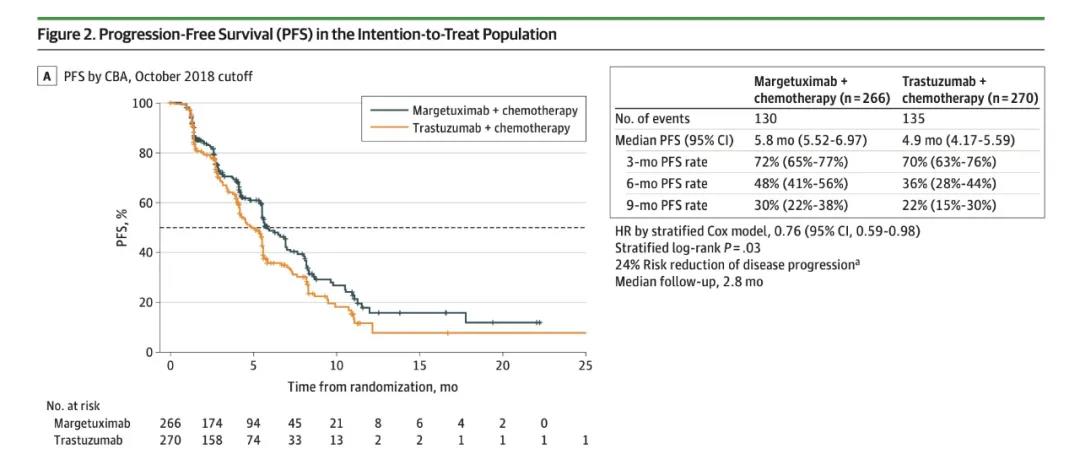
马吉妥昔单抗联合化疗显著降低了疾病进展或死亡风险
这也是首个在与曲妥珠单抗联合化疗头对头Ⅲ期研究中,取得阳性结果的抗HER2靶向疗法。2020年12月16日,美国食品与药物管理局(FDA)正式批准马吉妥昔单抗上市,与化疗联合,用于治疗成人转移性HER2阳性乳腺癌患者,这些患者接受过至少两种抗HER2方案治疗,并且至少有一个方案针对转移性疾病。
相信在不久的未来,抗体微雕的艺术也会给中国患者带来更多获益。
来源:奇点网

查看更多