查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






众所周知,嵌合抗原受体T细胞(CAR-T细胞)免疫疗法在B细胞恶性肿瘤中取得了巨大的成功,已被批准用于各种类型的复发/难治性(R/R) B细胞恶性肿瘤治疗,包括弥漫性大B细胞淋巴瘤(DLBCL)、B细胞急性淋巴细胞白血病(B-ALL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)和多发性骨髓瘤(MM)。
在肿瘤领域的成功也促使科学家将这种方法尝试用于治疗其他疾病,例如自身免疫性疾病、代谢障碍、纤维化等非肿瘤领域的疾病。
经过最近几年临床前和临床研究结果,证实了CAR-T细胞疗法确实有潜力可以作为一种潜在的疗法来改善非肿瘤疾病的生存益处。
本文就CAR-T细胞疗法在非肿瘤领域的进展作一个简要介绍,以拓宽我们对CAR-T细胞疗法进一步的认识。
01
自身免疫性疾病
CAR-T疗法在治疗许多类型的自身免疫性疾病方面具有巨大的前景。
研究表明,CAR-T细胞疗法可通过增强致病免疫细胞的杀伤作用,从而治疗许多不同类型的自身免疫性疾病。
此外,CAR Treg疗法可激活和增殖Treg细胞,从而使得免疫抑制效果得到进一步增强(图1)。
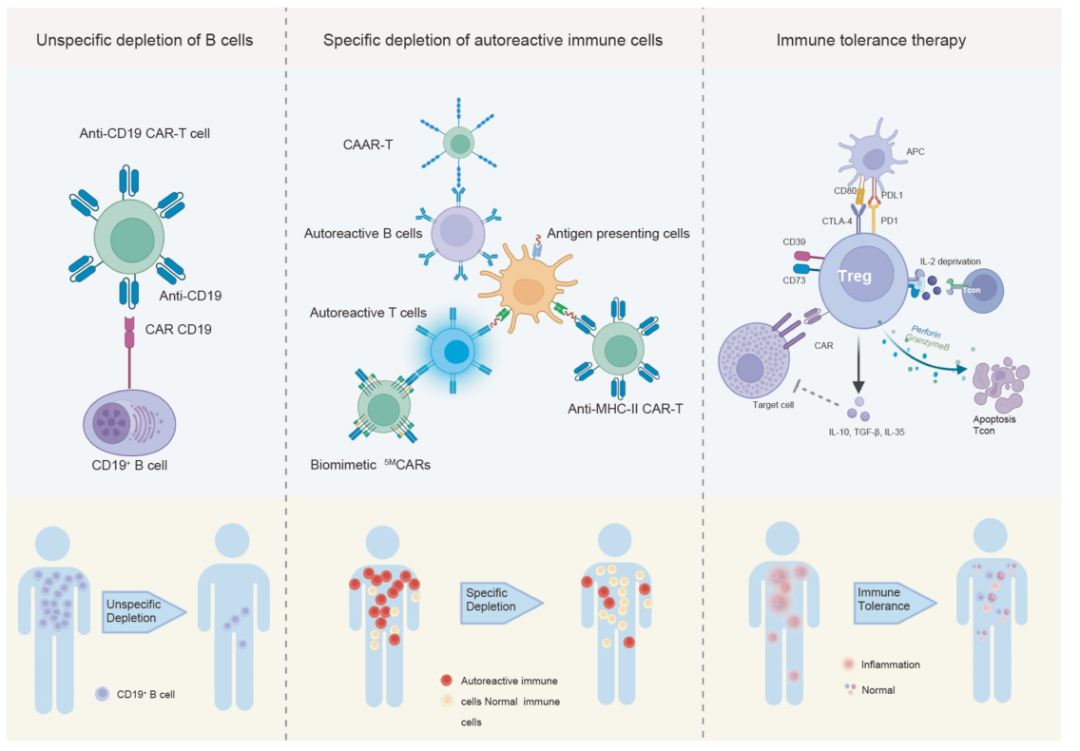
▲图1 CAR-T细胞疗法在治疗自身免疫性疾病中的作用机制
嵌合抗原受体(CAR)T细胞
系统性红斑狼疮(SLE)是一种典型的系统性自身免疫性疾病,其特点是多种类型的自身反应性B细胞和高水平的自身抗体。
靶向B细胞的抗体疗法虽取得一定效果,但整体疗效不佳,不同患者的反应也不尽相同。
由于CD19 CAR-T细胞在治疗B细胞白血病中取得了持久和持久的B细胞耗竭,并且比基于抗体的治疗效果更好,因此使用CAR-T细胞来耗竭SLE患者中B细胞的或许是一个可行的策略。
基于此想法, 2022 年9月,德国Friedrich Alexander的Georg Schett 领导的研究组在 Nature Medicine 发表了一项突破性研究中,利用anti-CD19 CAR-T细胞治疗药物来治疗SLE。
令人欣喜的是,在三个月内,所有五名患者的临床症状全部得到缓解,同时各项临床指标也归于正常。在长达17个月的治疗后随访中,所有患者都没有复发症状,这些结果支持了CAR-T疗法在治疗SLE具有非常大的潜力。
2023年4月10日,药明巨诺发布公告,瑞基奥仑赛(CD19 CAR-T疗法)治疗中重度难治性SLE的临床试验申请已获得NMPA的默示许可。
除了SLE外,嵌合抗原受体(CAR)T细胞也已被探索治疗其他自身免疫疾病,例如重症肌无力,狼疮性肾炎等。
嵌合自身抗体受体T细胞
寻常型天疱疮是一种危及生命的皮肤起泡的自身免疫性疾病,通常是由产生抗桥粒芯糖蛋白3(DSG3)的自身抗体引起的。
临床试验已使用CD20单抗利妥昔单抗非特异性地清除这些抗体的来源的B细胞,这使得患者的在短期得到了缓解,但不幸的是,复发率非常高,并存在显著的安全性问题。
为了避免类似情况,Payne领导的研究团队巧妙地设计了CAR,其可选择性地耗尽DSG3自身反应的B细胞,以避免非特异性B细胞再生的风险。这种结构后来被大家称为嵌合自身抗体受体(CAAR)。
CAAR不是像传统CAR那样靶向抗原,而是用自身抗体的作为靶标,在Payne设计的CAAR中,重组的DSG3被融合到CD137-CD3的ζ信号域。
在寻常型天疱疮体内小鼠模型中,这种DSG3特异性CAAR T细胞疗法显著改善了小鼠的皮肤表型,而且没有脱靶毒性。目前,该疗法的临床试验正在进行中(NCT04422912)。
由于很大一部分血友病患者在FVIII输血过程中会产生FⅧ抗体,这使得患者的治疗变得异常困难。为了解决这一痛点,一项研究开发了可靶向产生factorⅧ(FⅧ)特异性自身抗体B细胞的CAAR。
通过巧妙设计将FVIII结构域与CD28-CD3ζ融合,然后在CD8+T细胞上表达这些CAAR。
研究发现,将这些表达CAAR的工程T细胞过继转移到血友病小鼠体内后,可显著降低FⅧ抗体的水平。
CAR Treg 细胞疗法
另一种具有巨大治疗潜力的方法是将Treg细胞靶向受自身反应性免疫影响的区域,以局部抑制免疫反应。
使用CAR Treg细胞进行自身免疫疾病的临床前研究最多的三个例子是结肠炎,多发性硬化症和1型糖尿病(T1D)。
此外,也有人提出以人类白细胞抗原(HLA)为靶点的CAR Treg细胞来治疗移植器官的免疫排斥反应。
02
代谢类疾病
CAR-T细胞疗法正在成为一种治疗许多代谢紊乱的潜在方法,包括那些具有潜在的自身免疫发病机制的代谢紊乱,以及那些由于特定细胞类型的过度活动而可能被细胞毒性T细胞靶向和耗竭的代谢紊乱。
T1D可导致破坏胰腺中产生胰岛素的β细胞,患者需要终生接受胰岛素治疗。目前还没有被批准的预防或逆转T1D的治疗方法。目前正在探索两种潜在的CAR-T细胞策略来治疗T1D。
一种策略是靶向并摧毁负责破坏β细胞的自身免疫细胞。2019年的一项研究描述了CAR-T细胞对NOD小鼠抗原提呈细胞上的胰岛素肽-MHCⅡ类复合体的作用,这些细胞是导致小鼠模型糖尿病发生的原因。当过继转移时,这种CAR-T细胞治疗显著推迟了T1D的发生。
2020年,一个研究小组开发了第一代仿生五模块CAR(5MCAR),靶向糖尿病小鼠模型中的自身免疫CD4+T细胞。
5MCAR细胞毒性淋巴细胞能够清除致病的自身免疫T细胞,并能够预防和治疗小鼠的T1D(图2a)。
在接受治疗的小鼠中,观察到这些细胞的持久性可长达一年。
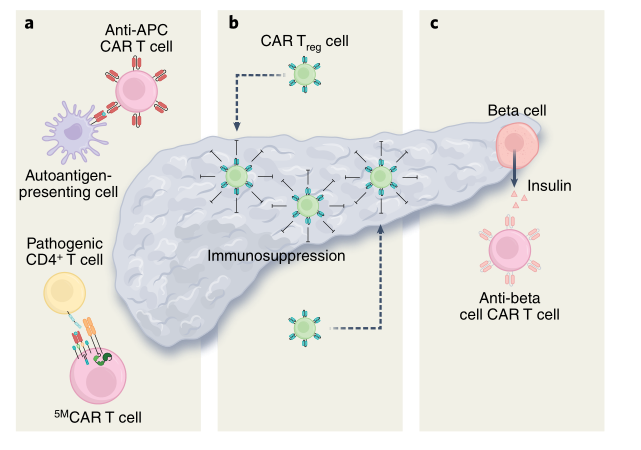
▲图2 使用CAR-T细胞治疗糖尿病的策略
第二种策略是在T1D的背景下使用Treg细胞来抑制免疫系统。由于已知T1D患者存在Treg功能障碍,人们也已探索了增加Treg细胞数量或功能的细胞疗法。
目前至少有两项临床试验将多克隆Treg细胞移植到T1D患者体内,但结果喜忧参半。
在这些试验中观察到的疗效不高有几个可能的原因,一个重要的因素可能是没有使用已被证明对自身免疫有效的抗原特异性Treg细胞。
为了克服这一点,一个研究小组试图通过改造Treg细胞来表达针对胰岛素的CAR,从而将Treg细胞定位于胰腺(图2b)。这些Treg细胞已被证明可以成功地定位、抑制并在体内长期存活。
另外一些研究开发了CAR-T细胞治疗其他的代谢适应证,例如动脉粥样硬化。
03
纤维化
另一个可能通过工程T细胞疗法解决的巨大医疗需求领域是纤维化,其可以影响到每一个器官和组织,并成为人类广泛疾病的基础。
几项研究已经成功地通过CAR-T细胞靶向并消融了促结缔组织增生性肿瘤间质中激活的成纤维细胞。
FAP是CAR-T细胞靶向的一个很好的靶点,因为它是一种细胞表面分子,只在病理过程中表达,在正常情况下不在身体其他地方高水平表达。通过使用高血压性心脏病的小鼠模型中,与受损的对照组相比,FAP特异性CAR-T细胞疗法显著减少了心脏的纤维化,并恢复了收缩和舒张期功能(图3)。
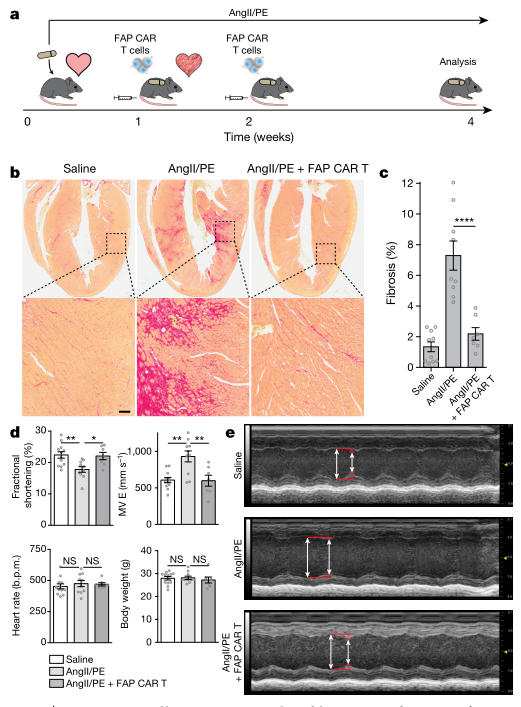
▲图3 FAP CAR-T细胞靶向心肌纤维化
CAR-T细胞靶向心脏纤维化的概念证明是非常重要的,因为它不仅为靶向其他形式的心脏纤维化打开了大门,而且可能还打开了许多心脏以外的纤维化疾病的大门。
04
细胞衰老
细胞衰老是由Leonard Hayflick于1961年首次描述的,是一种永久性的细胞周期停滞状态,不同于能够重新进入细胞周期的静止细胞和终末分化细胞。
此外,这些细胞在染色质结构、代谢活性和转录方面发生显著变化,导致一种称为衰老相关的促炎表型。衰老细胞通常由免疫系统从体内清除;然而,衰老细胞在器官和组织中的积累已被证明与许多与年龄相关的疾病有关,包括炎症性疾病、组织退化和癌症。
研究表明,通过白喉毒素介导的杀伤来去除小鼠的衰老细胞可以改善一些与年龄相关的病理。
在这些发现的基础上,Lowe等人设计了一种针对尿激酶型纤溶酶原激活剂受体(μPAR)的CAR,因为μPAR可在衰老细胞中广泛表达。
研究发现,μPAR CAR-T细胞能够在体外和体内有效地消融衰老细胞,从而延长小鼠肺腺癌模型的生存时间(图4)。
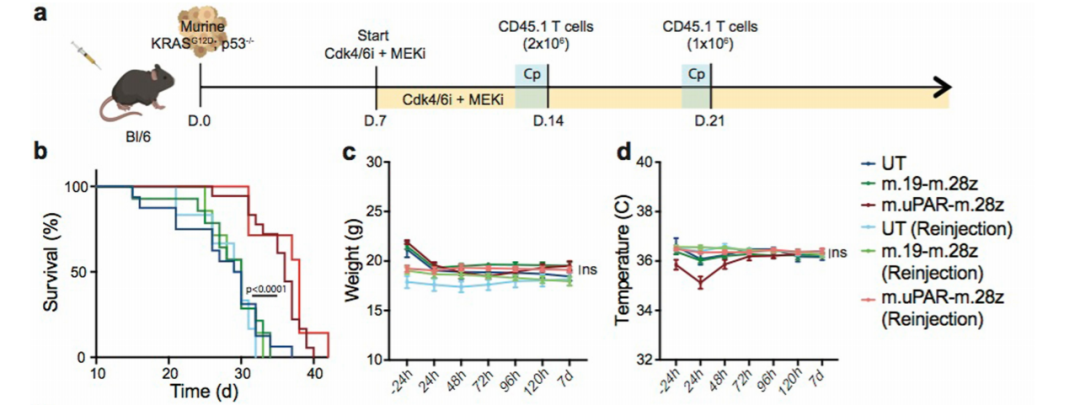
▲图4 μPAR CAR-T有效地消融衰老细胞,延长了肺腺癌模型小鼠的生存时间
此外,在四氯化碳诱导的和非酒精性脂肪性肝炎小鼠的肝纤维化模型中,μPAR特异性的CAR-T细胞过继转移也都产生了优异的治疗效果。
因此,CAR-T细胞可能是一种很有前途的增龄剂,可用于治疗许多与年龄相关的疾病。当然,这还需要临床研究来评估CAR-T靶向是否对人类安全有效。
小结
CAR-T细胞疗法在肿瘤学领域已取得了巨大的成功,但随着我们对各种病理及其基本分子机制认识的不断深入,CAR-T细胞疗法的应用范围将远远超出肿瘤学的范畴。
尽管CAR-T细胞疗法在治疗非肿瘤领域还处于早期阶段,研究报道还相对较少,但大家对这一赛道的关注日益剧增。随着CAR-T细胞疗法在各疾病领域的普及,或许万病皆可CAR。
来源:生物制药小编

☞看这篇就够了!他克莫司用药的 4 项注意事项及 6 条个体化用药经验
☞【专访】李建勇教授:提升淋巴瘤诊疗水平,目前首先要做的就是规范化!
查看更多