查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






免疫治疗的出现改变了非小细胞肺癌(NSCLC)的治疗格局,单药五年生存突破30%(KEYNOTE-024),但其获益在很大程度上是由一部分患者高效而持久的应答推动的。为了提高对免疫无应答患者的预后,免疫和放疗的“组合拳”值得期待。
放疗可以作为原位疫苗提高远端病灶的免疫清除(远隔效应),另一方面放疗也可直接杀伤肿瘤细胞并介导肿瘤微环境(TME)的改变,提高局部残留病灶的清除(免疫调节)。由于大样本随机对照证据的缺乏,近期Lancet发表了一篇合并分析[1],对PEMBRO-RT(phase II)和MDACC(phase I/II)两个随机试验中,免疫治疗(帕博利珠单抗)联合或不联合放疗是否能够改善转移性NSCLC患者的免疫应答进行了汇总分析,以更好地评估临床获益。
PEMBRO-RT是一项由荷兰癌症研究所主导的II期多中心(3个site)随机试验,纳入的患者既往接受过化疗,并且事后进行了PD-L1的检测。MDACC是在美国MD安德森癌症中心进行的一项I/II期单中心随机试验,纳入的既有初治患者,也有既往接受过化疗的患者,未明确PD-L1的表达。在两项研究中患者年龄>18岁,确诊为转移性非小细胞肺癌,且至少有一个未辐照病灶(用于监测放射野外反应),并且未接受过免疫治疗,则符合研究入组条件。
在两项试验中,帕博利珠单抗每3周静脉注射200 mg。在PEMBRO-RT试验中,帕博利珠单抗首次给药在最后一次放疗一周内进行,放疗剂量为24Gy/3f;MDACC试验中帕博利珠单抗与放疗同时给予,放疗分案可选50Gy/4f或45Gy/15f。合并分析的终点设定为最佳照射野外(远处)反应率(ARR)、12周ARR、最佳远处转移灶疾病控制率(ACR)、12周ACR、无进展生存期(PFS)和总生存期(OS)。
本分析汇总了148例患者的数据(51%来自PEMBRO-RT研究,49%来自MDACC研究)。76例患者接受了帕博利珠单抗单药治疗 [中位随访33个月(IQR 31.7-34.3)] ,72例患者接受了帕博利珠单抗联合放疗 [中位随访34个月(32.2-33.8)] 。所有患者的中位随访时间为33个月(IQR 32.4-33.6)。148例患者中124例(84%)有非鳞状组织学特征,111例(75%)既往接受过化疗。治疗组之间的基线变量无差异,包括PD-L1状态和转移性病灶体积。最常照射的部位是肺转移 [28/72(39%)] 、胸内淋巴结 [15/72(21%)]和肺原发性疾病 [12/72(17%)] 。
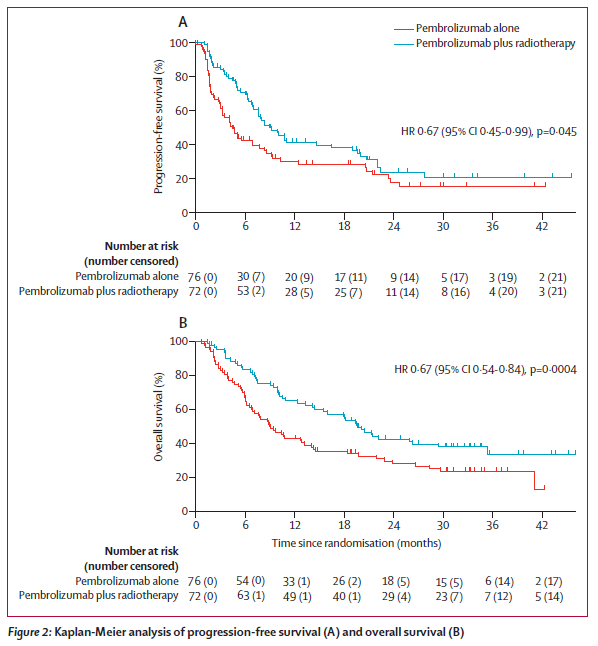
帕博利珠单抗联合放疗的最佳ARR显著高于帕博利珠单抗单药治疗 [41.7%vs 19.7%;比值比 (OR) 2.96, 95%CI 1.42-6.20; P = 0.0039] 。帕博利珠单抗联合放疗的最佳ACR也显著高于帕博利珠单抗单药治疗(65.3% vs 43.4%; 2.51, 1.28-4.91; P = 0.0071)。且不同PD-L1表达水平ARR分析显示组间无差异。对于12周时的缓解,治疗组之间的ARR无差异,但帕博利珠单抗联合放疗组的ACR显著高于帕博利珠单抗单药治疗组(表2)。
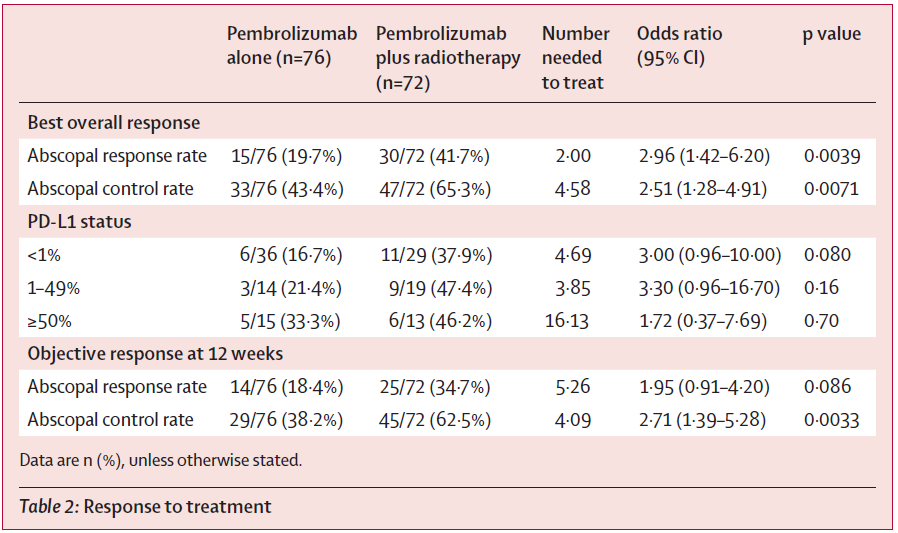
帕博利珠单抗联合放疗的中位无进展生存期 [9.0个月 (IQR 6.8–11.2) ] 显著长于帕博利珠单抗单药治疗 [4.4个月 (2.9–5.9) ] ,风险比 (HR) 为0.67 (95%CI 0.45-0.99; P = 0.045) 。在探索性亚组分析中,帕博利珠单抗联合放疗似乎对男性患者 (P = 0.032) 、既往接受过二线或以上化疗的患者 (P = 0.016) 和PD-L1低表达 (1-49%) 患者 (P = 0.012) 最有益。
帕博利珠单抗联合放疗组的中位总生存期 [19.2个月 (IQR 14.6-23.8) ] 长于帕博利珠单抗单药治疗组 [8.7个月 (6.4-11.0) ] ;HR 0.67, 95%CI 0.54-0.84; P = 0.0004)。在总生存期的探索性亚组分析中,帕博利珠单抗联合放疗似乎同样对男性患者最有益(P = 0.020)(图2)。
预后因素的多变量分析显示,无吸烟史和50Gy/4f的放疗计划与较长的PFS显著相关。无因素与总生存期相关。不良事件方面,高级别放疗相关不良事件非常罕见,帕博利珠单抗相关不良事件与帕博利珠单抗治疗转移性非小细胞肺癌的其他研究报告的不良事件相似。
据我们所知,PEMBRO-RT和MDACC随机试验的汇总分析是对前瞻性转移性非小细胞肺癌患者研究数据的最大评估,研究结果表明,在帕博利珠单抗免疫治疗的基础上加用放疗可显著增加未照射病灶的缓解率,从而显著提高无进展生存期和总生存期。
PEMBRO-RT和MDACC两项试验的主要终点均显示帕博利珠单抗 + 放疗在数值上改善,但两项研究均不符合预先规定的有意义临床获益的标准。因此,需要更大的样本量来更准确地检测在免疫治疗的基础上加用放疗对患者结局的影响。此外,PEMBRO-RT试验中的一个主要问题是PD-L1分布的不平衡,有利于帕博利珠单抗 + 放疗组。两项试验的汇总数据消除了这种不平衡,加强了患者结局改善归因于增加放疗的证据。
但亚组分析仍受到低样本量的限制。我们注意到,在联合队列中,PD-L1表达与结局无相关性:PEMBRO-RT试验的PD-L1阴性患者中,帕博利珠单抗 + 放疗的改善在汇总分析中消失。这种变化可能是由于19% (14/72) 的MDACC病例缺乏可用的PD-L1评分导致的偏倚,而PEMBRO-RT病例为3% (2/76) 。所以,很难得出PD-L1状态与帕博利珠单抗 + 放疗获益之间是否存在有意义的相关性的结论。
目前尚未就转移性非小细胞肺癌的最佳放疗剂量达成共识。在MDACC试验中,根据临床医生的判断和安全性(考虑照射病灶的大小、位置或两者)主观选择放疗方案。因此,该汇总分析中各种放疗方案疗效比较结论需要在更大规模随机试验中进一步验证。
在帕博利珠单抗免疫治疗的基础上加用放疗可显著提高转移性NSCLC患者的应答和生存结局。
谢启超教授
重庆医科大学附属第三医院肿瘤科主任
中国临床肿瘤学会(CSCO)肿瘤热疗专委会委员
中国医师协会肿瘤学分会青年委员
重庆中西医结合学会肿瘤专委会青年委员会主任委员
重庆市医学会放射肿瘤治疗学专委会副主任委员
重庆市免疫学会代谢免疫专委会常务委员
重庆市抗癌协会肿瘤心理专业委员会常务委员
重庆市医学会肿瘤学专业委员会精准医疗与分子诊断学组委员
肿瘤联合治疗是未来的发展趋势,免疫联合放疗无疑是全身与局部治疗相互补充的经典尝试,局部放疗可诱导机体产生多方面的免疫应答,选择合适的治疗时机对优化疗效具有非常重要的影响。在上述两项合并分析的试验中,pembrolizumab分别于放疗同时和放疗后立即使用,缘于放疗诱导PD-L1轴相关分子在肿瘤细胞及肿瘤浸润T细胞的过度表达是增强免疫疗效的重要机制之一,但其表达是暂时性的,若两者间隔时间太长会削弱其协同效用,Pacific研究的分层分析也发现,同步放化疗14天内接受免疫巩固治疗的患者,PFS和OS获益更加显著。当然,根据免疫药物的作用机制不同,时机选择也有所差异。以往的报道[2,3]提示抗CTLA-4抗体需要先于放疗使用,当Treg细胞被耗尽时,放疗产生的抗原释放才最有效,而基于Anti-OX40的激动型免疫治疗则需要在放疗同时或于放疗后使用,放疗诱导抗原释放后可增强效应T细胞的功能。因此,免疫联合放疗最佳时机的选择需要对免疫微环境(TME)进行更深入的探索。另一方面,从汇总分析中看到了pembrolizumab序贯或同步放疗的毒性均较小,并且患者对常规分割或低分割放疗的耐受性均较好,提示我们对于晚期肿瘤患者,免疫联合放疗可作为低风险治疗的选择,但对于合并其他基础疾病或身体状况较差、年龄较大的患者也需要注意放射性肺炎的发生。
王奇峰教授
副主任医师 副研究员 硕士生导师
四川省肿瘤医院放疗胸二病区主任
四川省卫健委学术技术后备/海外高层次留学人才
美国德州大学MD安德森癌症中心访问学者
中国医药教育协会放射治疗专业委员会副主任委员
西部放射治疗协会胸部治疗专业委员会副主任委员
CSGOR中国食管癌康复专家委员会副主任委员
四川省医学会放射治疗分会青年委员会副主任委员
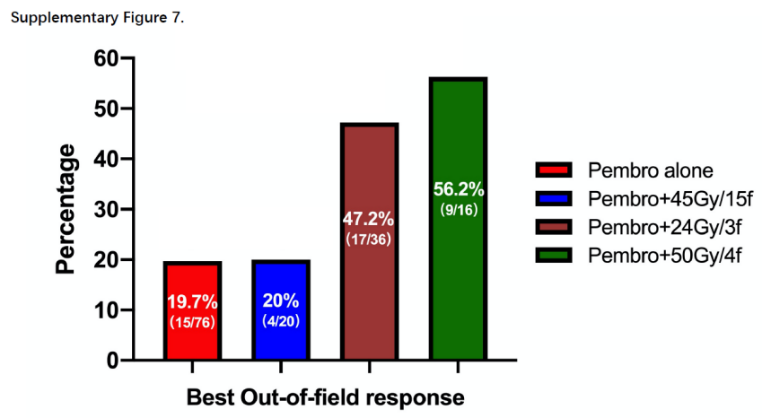
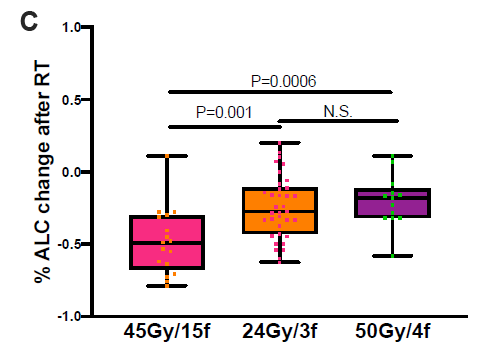
放射治疗可上调免疫原性细胞表面标志物如ICAM-1、MHC-1和Fas,诱导免疫原性细胞死亡,释放肿瘤抗原和细胞因子IFN、IL-1、IL-6等,增强免疫细胞对肿瘤的归巢。而激活的免疫反应可以进一步作用于远处的非照射转移灶,明显抑制转移灶的进展。另一方面,放疗会诱导免疫抑制作用,包括增加TGFβ等负性细胞因子的释放,抗放射抑制细胞的积累,以及PD-L1表达的上调。将PD-1/PD-L1抑制剂整合到放射治疗中,不仅可以增强正向免疫调节,还可以显著减弱负向免疫抵抗,从而实现强效抗肿瘤免疫。多项免疫联合化疗一线治疗III期NSCLC的临床试验已经展示出此治疗模式的有效性和可重复性。但目前尚无在晚期NSCLC患者中运用免疫联合放疗的phase III临床试验结果,所以该汇总分析对免疫联合放疗在晚期NSCLC中应用具有重要意义,也为后期开展III期临床试验提供了信心。由于该研究是对两项前瞻性研究的汇总分析,所以不可避免纳入患者异质性较大。由于样本量更加受限,所以亚组分析结论需要谨慎解读。但我关注的是,和单纯免疫治疗组相比,确实发现SARB技术增加了照射野外肿瘤的缓解率,这就是所谓的远隔效应或者说放射免疫“1+1>2”的效果,另一方面也解释了既往报道的单纯放疗远隔效应发生概率较低的原因。文章对照射部位也进行了亚组分析,发现对于原发灶、转移淋巴结和转移病灶的照射需要分开考虑,结果提示在使用免疫治疗过程中,原发灶和转移灶放疗均提高了疗效,但是照射淋巴结并无获益,这可能是因为淋巴结和原发灶一起照射引起照射范围增大抵消了生存获益,或者是照射淋巴结通常会选择45Gy/15f照射技术,发现这种方式淋巴细胞下降最严重,这提示我们临床在IV期患者纵隔淋巴结照射的时候,应该仅仅选择有转移的淋巴结,而不需要针对淋巴结区域进行照射。特定放疗计划可能对免疫治疗诱导的抗肿瘤免疫应答产生不同影响,这也为我们后期研究设计提供了思路。
参考文献
1. Theelen WSME, et al. Pembrolizumab with or without radiotherapy for metastatic non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Respir Med. 2020.
2. Qin R, et al. Safety and efficacy of radiation in advanced melanoma patients treated with ipilimumab. Int J Radiat Oncol Biol Phys. 2016 Sep 1;96(1):72-7.
3. Meng X, et al. The Role of Radiation Oncology in Immuno-Oncology. Oncologist. 2019 Feb;24(Suppl 1):S42-S52.
查看更多