查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





来源:奇点网
千呼万唤始出来的,往往是值得等待的惊艳。
就在本周二,中国的HER2阳性乳腺癌患者,盼到了翘首以待的好消息:曲妥珠单抗+帕妥珠单抗的双靶方案配合化疗,在中国正式获批第三项适应症——晚期转移性患者的一线治疗!
 您来啦,又是您两位啊
您来啦,又是您两位啊
(图片来源:www.roche.com)
一年内获批三项适应症,让双靶方案终于在中国做到了与国外使用范围的同步。HER2靶向治疗当前的最强音,本次获批也和此前的新辅助适应症类似,依照了国内外两方面试验的权威数据。
亮眼数据的背后有哪些学问,它们又将怎么指导临床诊疗,造福患者呢?奇点糕这次就做个条分缕析的解读,把疑惑统统扫干净。
“黄金搭档”组合史
对于双靶方案两位主角——帕妥珠单抗和曲妥珠单抗背后的精彩故事,奇点糕们虽说唠叨过不少次,但经典说多了也不腻嘛。至少这两大单抗如何携手抗癌的故事,就得再帮大家巩固一下记忆。
虽说是单抗药物,但帕妥珠单抗的制敌招数,却不像曲妥珠单抗那样直接诱导杀伤,而是叫做“二聚化抑制”,它能阻断癌细胞表面HER2形成同源或异源二聚体,HER2被激活促癌的过程,就会被明显限制。
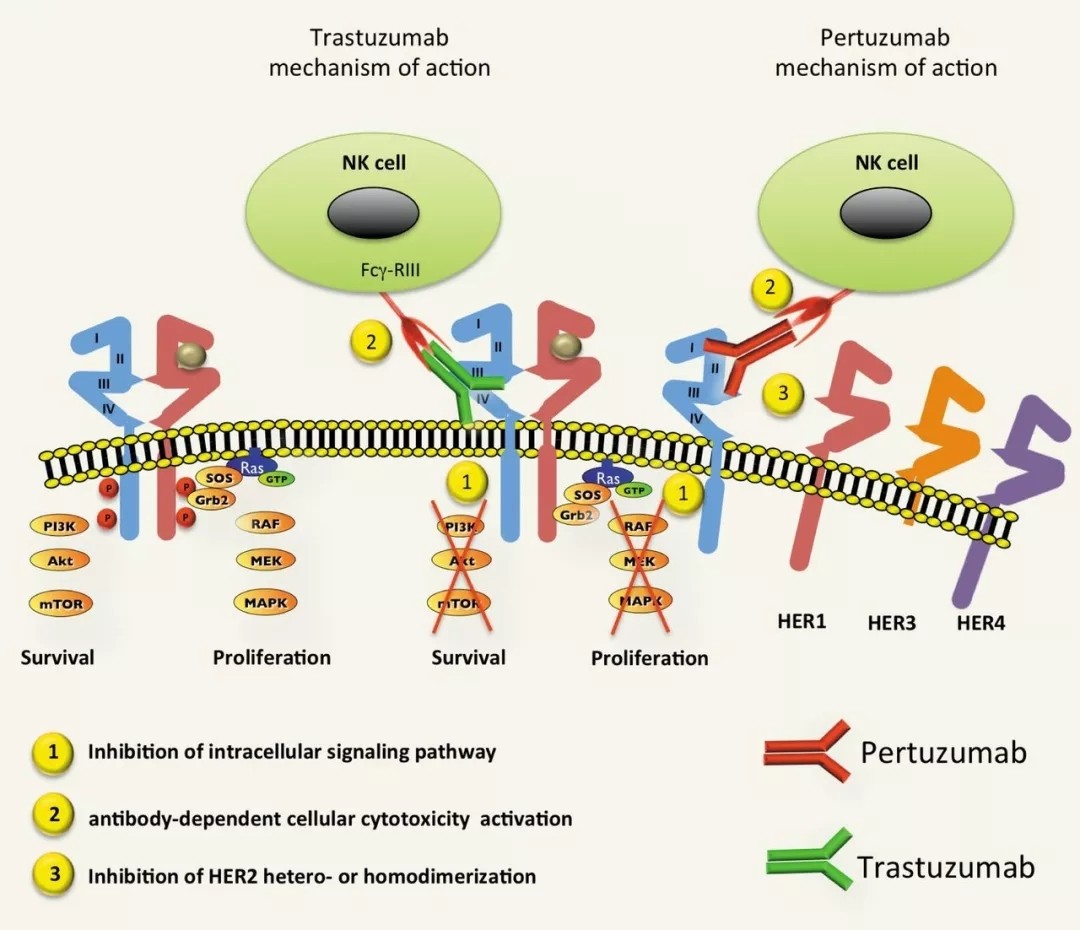
这套机制早该进教科书了吧?
(图片来源:Anticancer Research)
曲妥珠单抗是世界上第一种治疗实体瘤的单抗类药物,而帕妥珠单抗则是第一种靠二聚化抑制原理抗癌的药物,要论开创先河,这两位可都不差[1]。
携手使用的增效性,让两大单抗在今天的乳腺癌治疗中密不可分。而双靶方案最早取得的成功,就是在转移性HER2阳性乳腺癌上。
和其他晚期癌症相比,乳腺癌的特殊性,让这个患者群体多了一些复杂之处。
“敌情通报”
跟潜伏在五脏六腑的癌症不同,乳腺癌是很容易被发现的,筛查手段也相对成熟,所以在初次确诊癌症时,只有不到10%的乳腺癌患者属于转移性晚期(又称De novo患者),这些患者占到全部转移性患者的大约一半[2]。
而另外一半转移性患者,则是在经过完整的新辅助+手术+辅助治疗流程后,癌症复发转移了。曲妥珠单抗诞生后,早期HER2阳性乳腺癌患者的10年无进展生存率已经突破了70%[3],帕妥珠单抗加入早期治疗,更进一步降低了复发风险。
还没有靶向治疗的时候,HER2阳性乳腺癌可是预后最差的那种
(图片来源:CancerResearch.org)
但这些进步,毕竟还没有把癌症的长期复发风险降到0。卷土重来的癌症,往往会更加危险,对此前接受过的HER2靶向治疗可能也会产生耐药性,因此治疗起来难度相对更大,患者的预后也相对较差[4-5]。
这两大类患者,就是HER2双靶+化疗的主要对手。CLEOPATRA试验的成功,让双靶+化疗的方案横扫各大指南,成为转移性HER2阳性乳腺癌一线治疗的标准选择(辅助治疗后超过12个月复发属于一线,不足12个月则是二线[6])。
不过这次双靶+化疗方案在中国获批的证据,并不止一个CLEOPATRA试验,还有在中国开展,于今年美国临床肿瘤学会(ASCO)年会上公布结果的PUFFIN试验。
温故而知新,CLEOPATRA和今年的PUFFIN两项试验,以及一系列类似研究,能为双靶方案的使用提供哪些信息,打消多少疑惑和顾虑呢?
从试验到实践,优秀不会变
说双靶方案晚期适应症的表现,肯定要先从鼎鼎大名的CLEOPATRA试验说起。
在今年ASCO年会上,CLEOPATRA试验的8年随访数据公布:双靶+化疗的中位生存期57.1个月,显著优于曲妥珠单抗+化疗的40.8个月,患者8年生存率37%对23%,这两项数据,都堪称转移性HER2阳性乳腺癌治疗的历史最佳[7]。
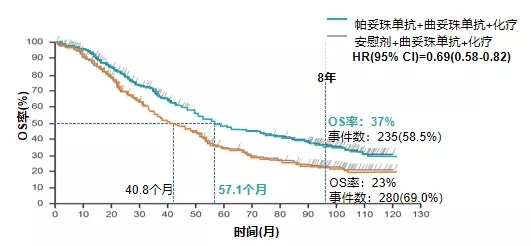
能够随访八年的晚期癌症治疗试验,可真不多
一个试验不够?那还可以多来几个。
在验证不同化疗药物与双靶方案配伍使用安全性的PERUSE试验中,双靶与三种化疗药(多西他赛/紫杉醇/白蛋白结合型紫杉醇)分别单独组合,安全性不仅有保证,疗效方面的PFS数据,甚至还稍稍好于CLEOPATRA试验[8]。
作为CLEOPATRA的中国桥接试验,设计几乎相同的PUFFIN试验虽然总体生存期(OS)数据尚未出炉,但在PFS、ORR两项主要的疗效数据上,都体现了与CLEOPATRA试验中,亚洲患者亚组相近的获益趋势[9-10],可以说初获成功。

放到临床实践中,双靶+化疗方案的疗效也毫不褪色。比如在意大利开展的两项真实世界研究中,RePer研究的PFS数据与上面两项试验基本相当,另一项研究的PFS更是达到27.8个月,比两项试验表现更好[11-12]!
用CLEOPATRA试验主研究者Sandra Swain博士在今年ASCO年会上的话说,双靶+化疗方案让一部分患者实现的长期生存,已经很接近让她用“治愈”来形容了,现在哪怕医生让患者们停药,患者都不乐意[13]。
可能对整个转移性HER2阳性乳腺癌患者群体来说,“治愈”两字还不能轻用,但双靶+化疗方案的价值,已经非同小可了,至少能让一部分患者的寿命接近正常人。
不信?跟奇点糕一起算算吧。在中国,乳腺癌的好发年龄是50岁左右,如果患者确诊时是早期,新辅助+手术+辅助全程都接受了双靶+化疗方案治疗,那么癌症10年内不复发的比例,肯定要比曲妥珠单药靶向治疗时代的70%[3]要高。
10年不复发,就已经算癌症治愈了。而对占比不到30%的复发患者,双靶+化疗再次使用,还能争取到5年、8年甚至更久的生存,再加上复发前的时间,就离患癌有接近20年了吧?50岁+20年,不就接近中国女性的人均寿命了?
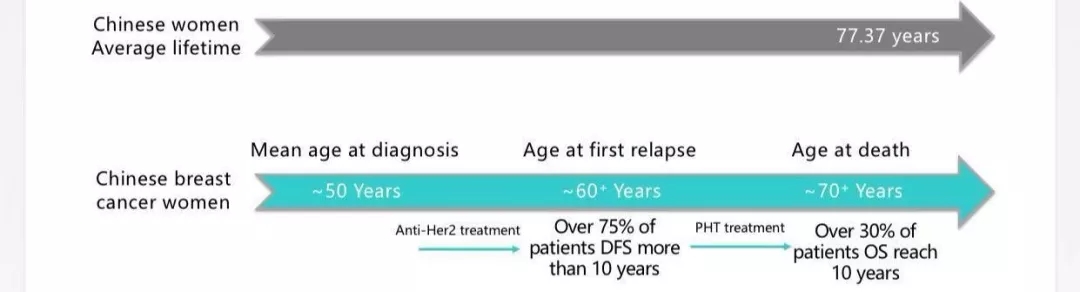
可能看图算数更直观一些
能做到这一步,双靶+化疗也算是鞠躬尽瘁了。
不过,抗癌方案从数据转化到实践,能否对各种细分情况的患者亚组实现全方位获益,往往也是一大挑战,“老年患者能不能用”、“之前用过XX方案能不能用”之类的疑惑,不光患者和家属有,医生也可能犯嘀咕。
打消疑惑的最好方法,还得是扎实的亚组数据。双靶+化疗,算不算全能战士呢?
过五关斩六将
癌症不同,亚组分析的重点自然也不同。在转移性HER2阳性乳腺癌上,除了年龄、癌症转移部位这两个因素之外,既往是否接受过HER2靶向治疗、雌/孕激素受体是否阳性,同样与患者预后关系密切。
先从最好理解的HER2靶向治疗史说起。很多转移性患者,此前可能都在癌症治疗的不同阶段用过曲妥珠单抗。再用双靶+化疗,效果会不会好,应该是很多患者的关心点吧?
首先看CLEOPATRA试验,PFS方面的初步结果就显示,对使用过曲妥珠单抗的患者,双靶+化疗对比曲妥珠单靶+化疗的优势,是与未使用过曲妥珠单抗患者基本一致的。这种优势,最终也转化到了生存期的延长上[14]。
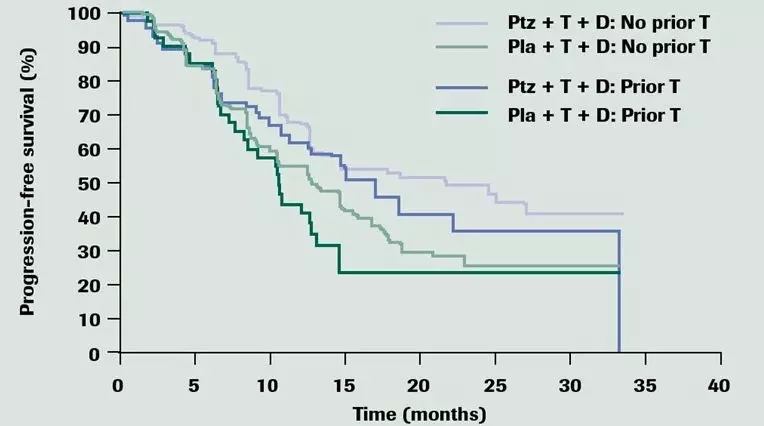
PTZ+T+D就是双靶+化疗,而Pla+T+D则是曲妥珠单靶+化疗
(图片来源:ASCO)
既往使用曲妥珠单抗单药,对双靶+化疗效果影响不大,也在上面几项真实世界研究中得到了证实。而且从一项小规模研究来看,即使此前使用的就是双靶+化疗,也可以在转移性癌症阶段,通过改变化疗用药再次实现获益[15]。
这第一关算是过了。接下来是第二关:年龄关。
有至少三分之一的乳腺癌患者,是在65岁以后发病的[16]。老年患者的情况往往比年轻患者复杂,临床试验入组的比例也低。老少皆宜,对抗癌疗法来说可不那么容易,双靶+化疗的表现又如何呢?
CLEOPATRA试验中入组了127名65岁以上的老年患者,大约占到试验整体的15%,而从疗效来看,这些患者不管是PFS还是OS获益,都比65岁以下的患者更明显(PFS HR 0.52/0.65,OS HR 0.53/0.70)[17-18]!
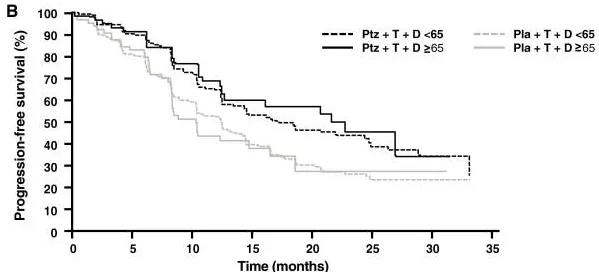
是患者老当益壮,还是靶向治疗宝刀不老呢?
(图片来源:Breast Cancer Research and Treatment)
从治疗安全性上来说,老年患者对双靶+化疗的整体耐受性也很好,不良事件中只有腹泻的发生率稍高,近年来备受关注的心脏安全性问题并没有出现。除了传统的静脉给药,节拍化疗配合HER2双靶,对老年患者同样是安全高效的[19]。
再接下来是第三关,就对应数字,看看雌/孕激素受体阳性,也就是常常被称为三阳性(双激素受体+HER2阳性)的患者吧。有不少科研证据显示,激素受体和HER2可能相互支援,导致对HER2靶向治疗或者内分泌治疗的耐药[20-21]。
信号通路能玩团队作战耐药,抗癌药物更能合作啊。CLEOPATRA试验中入组的患者,有接近一半属于三阳性,双靶+化疗方案对他们同样体现了良好的治疗效果,与只有HER2阳性的患者差异不大[18]。
这也让NCCN指南,把双靶+化疗列入了三阳性患者治疗的优选方案(Preferred),而双靶+诱导化疗的基础上,再加用内分泌治疗作为维持治疗,也同样是一种选择[22]。
其实三阳性乳腺癌的治疗,相比HER2乳腺癌还不那么体系化
(图片来源:FreeRange)
最后再来说说不同部位的癌症转移,乳腺癌常见的转移是脑转移、骨转移和内脏转移,结合CLEOPATRA和真实世界研究的结果[11,23,24]来看,双靶+化疗对转移部位不同患者的获益趋势,基本都是和患者整体一致的。
总结来看,不管面对什么样的难题,双靶+化疗都能让患者获益。近年来HER2阳性乳腺癌,尤其是转移性阶段患者生存率的不断上升,接近预后最好的Luminal A型乳腺癌,绝对少不了治疗方案这种见招拆招的功劳[25]。
无差别打击,全方位覆盖,强悍的HER2双靶+化疗方案,让中国患者真的久等了。而且在近期的医保谈判中,这双靶也是一个续约成功,一个成功入围,患者用起来的负担显然也要小得多。更好更可及的新方案,真的触手可及啦。
查看更多