查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





北京大学人民医院 北京大学肝病研究所 杨甲 饶慧瑛 魏来
2018欧洲肝脏研究学会(EASL)年会期间发布了新版丙型肝炎治疗推荐意见。新版推荐意见最重要的改变是,为实现世界卫生组织(WHO)提出的2030年消除丙型肝炎(简写为丙肝)威胁的宏伟目标而做出相应更新,从筛查、诊断、治疗、管理等各方面做了较为详尽的描述和建议,力求发现和治疗更多患者。
一、新版推荐意见亮点
1. 降低对筛查诊断试剂的要求。新版推荐意见提出所有怀疑感染丙型肝炎病毒(HCV)者都应该接受筛查,HCV中高流行区≥2%~5%的普通人群都应该接受筛查,可使用唾液筛查抗-HCV。新版推荐意见多次对中低收入国家或地区如何实施筛查诊断给出建议。例如,对于治疗终点持续病毒学应答(SVR)的评估,可以使用替代的终点,可于停药后24周检测HCV抗原,以及可使用灵敏度低的试剂检测HCV RNA。
2. 降低对基因型检测的要求。新版推荐意见对欧洲当前可用的丙肝药物进行了分类:全基因型和基因特异型,前者包括索磷布韦/维帕他韦(velpatasvir)和格卡瑞韦(glecaprevir)/哌仑他韦(pibrentasvir)方案。在基因分型无法进行和(或)无法负担的地区,或是为了简化治疗、提高可及性,新的全基因型药物治疗可在基因型和基因亚型未知的情况下启动。不过新版推荐意见也指出,既往治疗史、有无肝硬化和基因型(包括基因1型的亚型)仍然对选择方案和疗程有帮助。
3. 降低对治疗监测的要求。新版推荐意见提出在确保依从性的前提下,使用高治愈率的全基因型方案药物治疗时,在治疗结束后12周检测HCV RNA用以判断持续病毒学应答(SVR12)并非必需。耐药检测方面,仍然不推荐在治疗前广泛检测HCV耐药。其理由除当前仍无标准化、商品化的耐药检测手段以外,对于基线可检测到耐药相关置换(RAS)的患者,现在已有高效的治疗手段。因此,对于直接抗病毒药物(DAA)初治的患者,不推荐在治疗前广泛检测HCV耐药。不过,针对DAA治疗失败的患者,应该进行RAS检测,对于补救治疗方案的选择具有指导意义。
注 新版推荐意见采用的循证等级仍为GRADE系统,证据等级分为高质量(A):进一步研究也不可能改变该疗效评估结果的可信度;中等质量(B):进一步研究很有可能影响该疗效评估结果的可信度,且可能改变该评估结果;低质量(C):进一步研究极有可能影响该疗效评估结果的可信度,且该评估结果很可能改变,任何疗效评估结果都很不确定。推荐强度分为:强推荐(1)和弱推荐(2)。
二、推荐意见摘登
丙肝筛查诊断
急慢性丙肝的诊断 对于所有可疑HCV感染者,均应将血清或血浆抗-HCV检测作为一线诊断方法(A1)。对于可疑急性HCV感染、免疫抑制和血液透析患者,血清或血浆HCV RNA检测应被纳入基线评估(A1)。若抗-HCV阳性,应采用高灵敏度分子学方法(检测下限≤15 IU/ml)进行HCV RNA检测(A1)。
在中低收入国家以及高收入国家的特殊人群中,定量HCV RNA(检测下限≤1000 IU/ml)可广泛应用于HCV诊断和管理(B2)。
抗-HCV阳性但HCV RNA阴性者,应在12或24周后复查HCV RNA以确定HCV是否自发清除(A1)。血清或血浆HCV核心抗原是HCV复制的标记物,在HCV RNA检测不可及或无法负担时,可替代HCV RNA用于诊断急性或慢性HCV感染(A1)。
慢性丙肝的筛查 HCV筛查应基于酶免疫分析法的血清或血浆抗-HCV检测(A1)。干血斑点法的全血样本可替代静脉采血的血浆或血清抗-HCV检测样本,运送至中心实验室采用酶联免疫法进行检测(A2)。快速诊断试验(RDT)采用血清、血浆、指尖全血、唾液作为标本,可取代医疗中心传统的酶联免疫检测法,从而简化抗-HCV筛查、提高患者管理可及性(A2)。干血斑点法的全血样本可替代静脉采血的血浆或血清HCV RNA检测样本,送至中心实验室采用分子学法进行检测(A2)。
若抗-HCV阳性,应进一步行血清或血浆HCV RNA或HCV核心抗原(若HCV RNA检测不可及或无法负担时)检测(A1)。抗-HCV阳性患者应检测HCV RNA,以加强检测和治疗的衔接(B1)。如果即时HCV RNA检测方法(检测下限 ≤1000 IU/ml)或HCV核心抗原可及且或合算时,可代替抗-HCV 用于HCV感染筛查(C2)。
丙肝治疗目标、终点、治疗禁忌与治疗指征
治疗目标 治愈HCV感染,预防HCV相关肝脏及肝外疾病并发症,包括肝坏死性炎症、肝纤维化、代偿期肝硬化、失代偿期肝硬化、肝细胞癌(HCC)、严重肝外表现和死亡;改善生活质量、治愈HCV感染;预防HCV的持续传播(A1)。
治疗终点 治疗结束后12或24周用敏感检测法(检测下限 ≤15 IU/ml)血清或血浆HCV RNA阴性(SVR12或24)(A1)。若HCV RNA不可及或无法负担,可将SVR24血清或血浆HCV核心抗原检测阴性作为治疗前HCV核心抗原阳性者的治疗终点(A1)。若敏感HCV RNA检测不可及或无法负担,可将治疗结束后24周时血清或血浆HCV RNA(检测下限≤1000 IU/ml )阴性(SVR24)作为替代治疗终点(B1)。进展期肝纤维化或肝硬化患者应持续监测HCC,因SVR只能降低但未完全消除HCC发生风险(A1)。
治疗禁忌 特定细胞色素酶P450(CYP)/P糖蛋白诱导剂(如卡马西平、苯妥英钠)可显著降低DAA的血药浓度,禁止与所有DAA治疗方案合用(A1)。Child-Pugh B和C级失代偿期肝硬化患者或既往发生失代偿患者禁用包含蛋白酶抑制剂的治疗方案(A1)。仅当严重肾功能不全患者无可用获批治疗药物时,才考虑对估计肾小球率过滤(eGFR)小于30 ml/(min·1.73 m2)的患者应用索磷布韦(B1)。
治疗指征 所有HCV感染者均需考虑治疗,包括初治和既往治疗未达到SVR者(A1)。明显肝纤维化或肝硬化患者[肝纤维化分期(METAVIR)评分F2、F3或F4],包括代偿期(Child-Pugh A期)和失代偿期(Child-Pugh B、C期),显著肝外表现患者(HCV相关混合冷球蛋白血症所致的血管炎、HCV免疫复合物相关肾病、非霍奇金B细胞淋巴瘤)、肝移植后HCV复发患者、合并加速肝脏疾病进展的疾病[非肝脏实质器官或干细胞移植术后、乙型肝炎病毒(HBV)/HCV共感染、糖尿病]、有传播HCV风险的患者(静脉瘾者、高危性行为男男同性恋、有生育愿望的育龄期女性、血液透析患者、囚犯)需即刻治疗(A1)。
具备肝移植指征[终末期肝病模型(MELD)评分≥18~20]的失代偿期(Child-Pugh B或C)肝硬化患者,应先行肝移植,再行抗HCV治疗(B1)。失代偿期肝硬化患者(Child-Pugh B级,MELD评分≥18~20),若肝移植等待时间>6个月,可于移植前开始抗HCV治疗,但此类患者临床获益尚不明确(B2)。对于因非肝脏合并症所致预期寿命有限患者,不推荐抗HCV治疗(B2)。
药物治疗
治疗HCV的DAA药物相互作用(DDI)复杂且多见。因此所有患者开始DAA治疗前和治疗期间,加用其他药物前需充分评估DDI风险(详见www.hep-druginteractions.org)(A1)。在HIV/HCV共感染患者中,尤其需要重视DDI,有些抗HIV药物禁止或不推荐与DAA合用,或需调整剂量再与之合用。
慢性HCV治疗 无干扰素(IFN)、无利巴韦林的DAA治疗方案适用于无肝硬化或代偿期(Child-Pugh A)肝硬化患者,包括初治患者和经治患者(包括聚乙二醇干扰素联合利巴韦林,聚乙二醇干扰素、利巴韦林和索磷布韦,或索磷布韦和利巴韦林)(A1)。无干扰素、无利巴韦林的DAA治疗方案同样适用于HIV合并感染患者,该类人群中药物病毒学应答与无HIV人群相同。如DAA与抗逆转录药物有相互作用,治疗方案和药物剂量需调整(A1)。为尽量避免药物副作用及DDI,在相同疗程可获得相似的SVR率时,两药联合使用优于三药联合(B1)(详见表1、表2)。
全基因型药物方案 高效、安全、耐受性好的全基因型抗HCV药物获批,使得简化抗HCV治疗成为可能(B1)。治疗前仅需评估是否有HCV复制(血清或血浆HCV RNA或HCV核心抗体阳性)以及是否有肝硬化[采用简单非侵入性方法:基于4因子的纤维化指数(FIB-4)或天冬氨酸氨基转移酶/血小板比值指数(APRI)]以决定是否需要治疗后随访(B1)。初治和经治无肝硬化或代偿期肝硬化患者无需检测基因型,可用索磷布韦/维帕他韦治疗12周或格卡瑞韦/哌仑他韦12周(B1)。通过非侵入性方法排除肝硬化,初治患者可采用格卡瑞韦/哌仑他韦8周治疗方案(A1)。
如果供应商能够保证质量控制达标,可采用仿制药治疗(A1)。需严密监测潜在DDI,必要时调整药物剂量(A1)。由于这些药物在所有依从性好的人群中SVR12率都很高,治疗结束后12周检测SVR12并非必要(B1)。高危人群及再感染风险人群应进行SVR12检测,如果条件允许应每年监测SVR(B1)。如果可提供HCC治疗,进展期肝纤维化(F3)或代偿期肝硬化(F4)患者获得SVR后需监测HCC并加强管理(A1)。
表1 丙型肝炎病毒(HCV) 各基因型感染的治疗
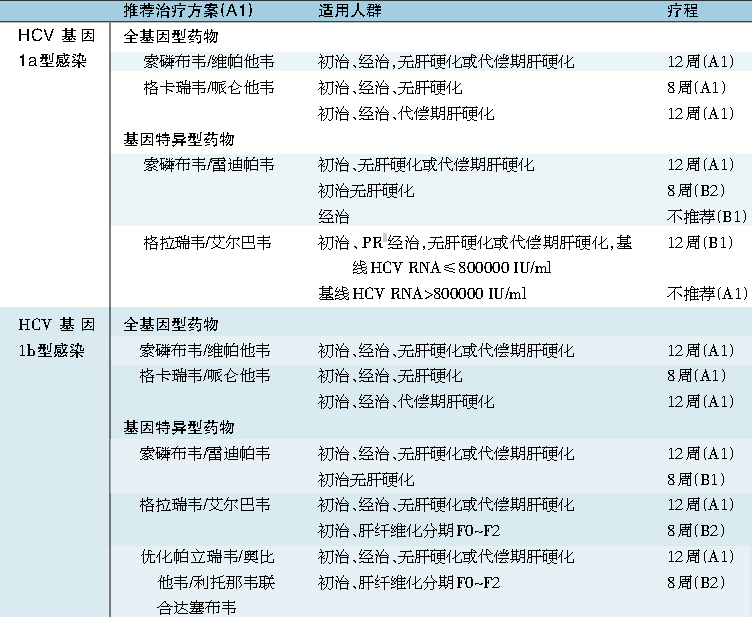
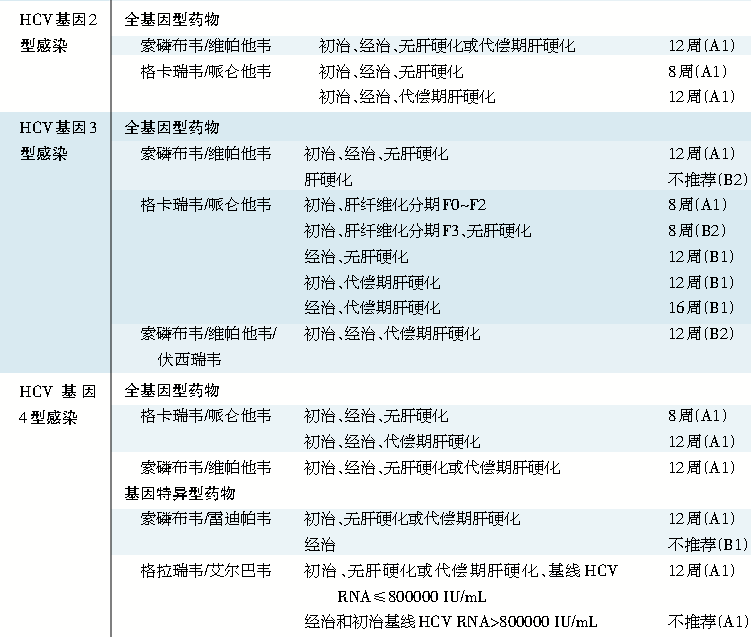
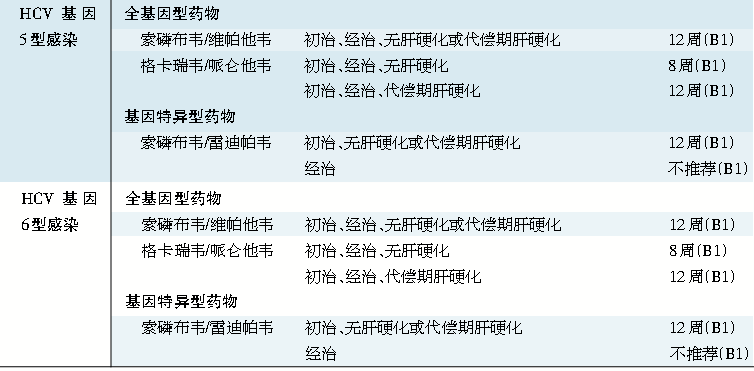
注:全基因型药物或组合药物:400 mg 索磷布韦,1片/次,1次/日。400 mg 索磷布韦/100 mg维帕他韦,1片/次,1次/日。400 mg索磷布韦/100 mg维帕他韦/100 mg伏西瑞韦,1片/次,1次/日,与餐同服。100 mg格卡瑞韦/40 mg哌仑他韦,3片/次,1次/日,与餐同服。
基因特异型药物或组合药物:400 mg索磷布韦/90 mg雷迪帕韦,1片/次,1次/日。75 mg帕立瑞韦/12.5 mg奥比他韦/50 mg利托那韦,2片/次,1次/日,与餐同服。250 mg达塞布韦,1片/次,2次/日(早、晚)。100 mg格拉瑞韦/50 mg艾尔巴韦,1片/次 ,1次/日。
*PR:聚乙二醇干扰素联合利巴韦林。
表2 初治或者经治(PR、PR+SOF或SOF+RBV)的丙型肝炎病毒(HCV)感染者*治疗方案
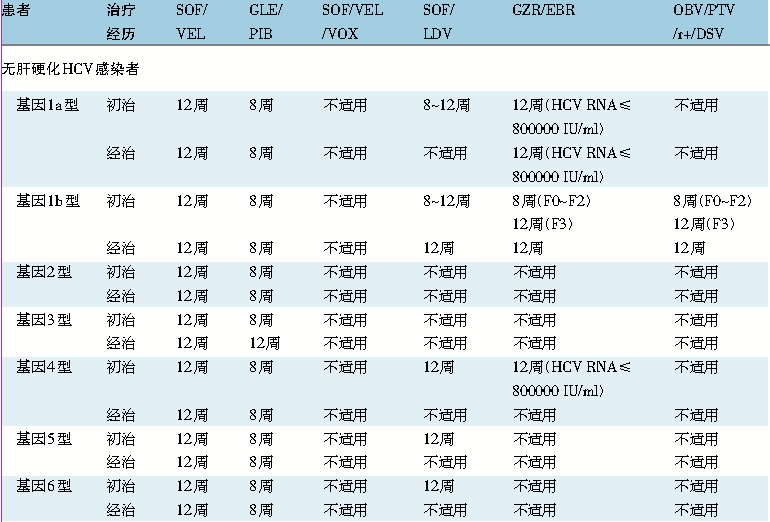
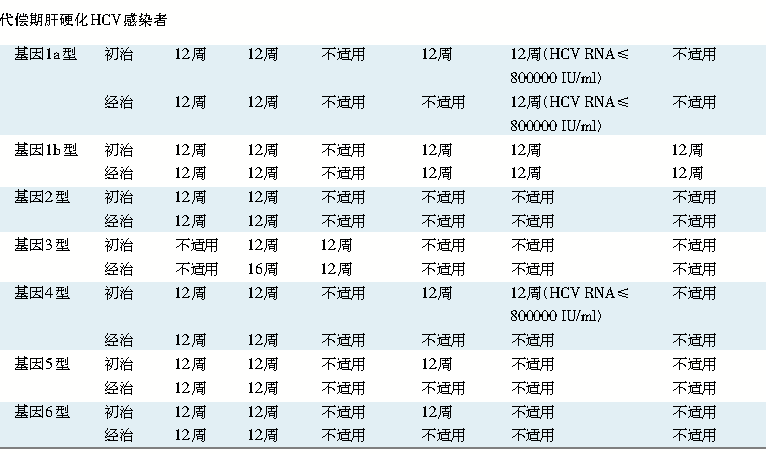
注 *HCV感染者可合并或不合并HIV(人类免疫缺陷病毒)感染。PR:聚乙二醇干扰素联合利巴韦林;RBV利巴韦林;SOF:索磷布韦;VEL:维帕他韦(velpatasvir);GLE:格卡瑞韦(glecaprevir);PIB:哌仑他韦(pibrentasvir);VOX:伏西瑞韦(voxilaprevir);LDV:雷迪帕韦(ledipasvir);GZR:格拉瑞韦;EBR:艾尔巴韦;OBV:奥比他韦;PTV:帕立瑞韦;r:利托那韦;DSV:达塞布韦(dasabuvir)。
严重肝脏疾病、肝移植患者的治疗
无干扰素方案由于其有效、易于应用、安全、耐受性好,是HCV单独感染和合并HIV感染且处于失代偿期(Child-Pugh B、C级)肝硬化患者(无论是否有肝移植指征)以及肝移植后患者的唯一选择(A1)。
包含蛋白酶抑制剂的药物禁用于失代偿期肝硬化患者(A1)。
失代偿期肝硬化、无HCC、有肝移植适应证患者的治疗
失代偿期肝硬化患者应在有HCV治疗经验、可行肝移植的临床中心进行,治疗期间需要密切监测,如果发生严重失代偿应停止治疗(A1)。
失代偿期肝硬化、无HCC、等待肝移植且终末期肝病模型(MELD)评分<18~20分患者应在移植前开始治疗;应尽快启动治疗以便在移植前完成全部治疗疗程,并进一步评估获得持续病毒学应答(SVR)后的肝功能,如果肝功能有显著改善,有些患者甚至可能从移植等待名单中移除(A1)。
包含蛋白酶抑制剂的药物禁用于失代偿期肝硬化患者(A1)。
失代偿期肝硬化、无HCC、等待肝移植且终末期肝病模型(MELD)评分<18~20分患者,可用索磷布韦/雷迪帕韦(基因型1、4、5和6)或索磷布韦/维帕他韦(全基因型)以及利巴韦林(<75 kg,1000 mg/d;≥75 kg,1200 mg/d)治疗12周(A1)。利巴韦林起始剂量可以从600 mg/d,根据耐受性逐渐调整(B1)。
失代偿期肝硬化且有利巴韦林禁忌或无法耐者,应采用无利巴韦林的索磷布韦/雷迪帕韦(基因型1、4、5和6)或索磷布韦/维帕他韦(全基因型)方案治疗24周(A1)。
等待肝移植的失代偿期肝硬化患者副作用发生风险极高,抗HCV治疗期间或之后仍需要进行临床或检验评估(B1)。
失代偿期肝硬化、无HCC、等待肝移植且MELD评分≥18~20分者应首先进行肝移植。移植后再进行抗HCV治疗(B1)。
失代偿期肝硬化、无HCC、等待肝移植且MELD评分≥18-20分但等待时间超过6个月的患者可根据具体情况在移植前进行抗HCV治疗(B2)。
无肝硬化或代偿期肝硬化、有HCC及肝移植指征
合并HCC等待肝移植的HCV感染患者,肝移植应作为主要治疗目标,可通过多学科讨论个体化制定抗HCV方案(A1)。抗HCV治疗并不影响肝移植等待名单上患者的管理,可在肝移植前开始抗病毒治疗以预防感染复发及移植后并发症(A2)。也可在肝移植后进行抗病毒治疗,可获得较高SVR(A2)。无肝硬化或代偿期肝硬化、有HCC且在肝移植等待名单上的患者应在肝移植前后进行抗HCV治疗(A1)。
无肝移植指征患者的治疗
无肝移植指征的失代偿期肝硬化患者 失代偿期肝硬化且不在移植等待名单的患者(Child-Pugh B或Child-Pugh C级,评分不超过12分),如无影响其生存时间的合并症,应即刻开始治疗(A1)。
包含蛋白酶抑制剂的治疗方案禁用于失代偿期肝硬化患者(A1)。
失代偿期肝硬化且不在移植等待名单的患者可用固定剂型索磷布韦/雷迪帕韦(基因型1、4、5和6)或索磷布韦/维帕他韦(全基因型)以及利巴韦林(<75 kg,1000 mg/日;≥75 kg,1200 mg/日)治疗12周,利巴韦林起始剂量可从600 mg/d,随后根据耐受性逐渐调整剂量(A1)。
失代偿期肝硬化且不在移植等待名单的患者可用索磷布韦/雷迪帕韦(基因型1、4、5和6)或索磷布韦/维帕他韦(全基因型)以及利巴韦林治疗12周(A1)。
失代偿期肝硬化且不在移植名单的患者,且有利巴韦林禁忌或无法耐受利巴韦林患者,应采用无利巴韦林的索磷布韦/雷迪帕韦(基因型1、4、5和6)或索磷布韦/维帕他韦(全基因型)方案治疗24周(B2)。
失代偿期肝硬化患者发生不良事件风险极高,抗HCV治疗期间或之后仍需进行临床或检验评估(B1)。
治疗后肝细胞癌(HCC)且无肝移植指征的患者 肝硬化患者也应进行抗HCV治疗,这些患者有感染复发或HCC的风险,故在持续病毒学应答(SVR)后仍需进行HCC监测(A1)。
对于接受过HCC(HCV相关的HCC)治疗的人群,抗病毒治疗是否能降低HCV相关HCC复发风险,从而让患者长期获益目前尚不明确。但这类患者常合并进展期肝纤维化或肝硬化,必须接受适当的抗病毒治疗,且需密切监测HCC的发生(B1)。
未达SVR患者的再治疗
对于聚乙二醇干扰素联合利巴韦林,聚乙二醇干扰素、利巴韦林联合索磷布韦或索磷布韦联合利巴韦林方案治疗失败的患者必须再次进行治疗,参照推荐,根据基因型选择经治患者的治疗方案(A1)。
包含直接抗病毒药物(DAA)治疗方案失败的患者可在再治疗前进行HCV耐药检测,有经验的治疗人员以及病毒学家组成的多学科团队可根据他们的耐药经验指导治疗(B2)。
无肝硬化或代偿期肝硬化、包含蛋白酶抑制剂或非结构蛋白 5A(NS5A)抑制剂方案治疗失败患者,应予以索磷布韦/维帕他韦/伏西瑞韦联合治疗12周,最好基于有治疗经验的人员和病毒学家组成的多学科团队(A1)。
无肝硬化或代偿期肝硬化、包含蛋白酶抑制剂或NS5A抑制剂方案治疗失败、且存在低应答因素[终末期肝病、长疗程DAA治疗、复杂NS5A 耐药相关置换(RAS)改变]的患者可予以索磷布韦联合格卡瑞韦/哌仑他韦治疗12周,基于有治疗经验的人员和病毒学家组成的多学科团队制定个体化治疗(B2)。
失代偿期肝硬化、包含蛋白酶抑制剂或NS5A抑制剂方案治疗失败患者禁用蛋白酶抑制剂,应再次予以索磷布韦/维帕他韦,同时加用利巴韦林(<75 kg,1000 mg/日;≥75 kg,1200 mg/日)治疗24周,基于有治疗经验的人员和病毒学家组成的多学科团队的个体化治疗(B2)。
治疗监测
治疗效果监测 应采用敏感分子学方法(检测下限≤15 IU/ml)监测血清或血浆HCV RNA水平(A1)。在特殊人群中,定量HCV RNA(检测下限≤1000 IU/ml)可广泛应用于HCV的诊断和管理(B1)。在HCV RNA检测不可及或无法负担的情况下,用酶联免疫法检测血清或血浆的HCV核心抗原可替代HCV RNA用于监测治疗效果(A1)。无干扰素(IFN)治疗方案的患者,应分别监测基线、治疗结束后12、24周HCV核心抗原水平(A1)。在某些国家或地区,基于DAA方案的SVR 12率极高,除非是高危行为或再感染风险人群,SVR监测并非必须(B2)。
治疗安全性监测 接受包含DAA治疗方案的患者每次就诊时均需评估临床副作用(A1)。须监测基线、治疗后12、24周的丙氨酸氨基转移酶(ALT)水平,以发现无显性症状患者(B1)。对于接受利托那韦/帕立瑞韦/奥比他韦、达塞布韦方案治疗的患者需监测间接胆红素(A1)。估计肾小球率过滤(eGFR)下降的患者需每个月监测肾功能(A1)。蛋白酶抑制剂在严重肝脏损伤患者中的不良反应发生率很高,因此含有蛋白酶抑制剂治疗方案(格卡瑞韦/哌仑他韦、格拉瑞韦/艾尔巴韦、利托那韦/帕立瑞韦/奥比他韦联合达塞布韦、索磷布韦/维帕他韦/伏西瑞韦)禁用于失代偿期肝硬化患者(B1)。
药物相互作用(DDI)监测 治疗期间应监测合并症药物的有效性和毒性以及潜在的DDI(A1)。可在治疗期间停用有相互作用的合并用药或替换为相互作用较小的药物(B1)。
减量治疗 出现严重不良事件或ALT突增至10 倍正常值上限时应停止治疗(B1)。在需要利巴韦治疗的患者中(失代偿期肝硬化),如果血红蛋白(Hb)下降至100g/L,利巴韦林应以每次200 mg减量,若Hb下降至85 g/L,则需停用利巴韦林(A1)。
(详见中国医学论坛报 5月24日D2~D4)
查看更多