查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






癌情报告
儿童肿瘤流行病学与防治研究进展
孙桂英, 张耀东, 王凯娟
(河南省儿童医院)
摘要
儿童肿瘤是儿童健康的重大威胁,较成人肿瘤有独特的生物学特性与临床转归,既影响患儿生长发育与生存质量,也加重家庭及社会的负担。本文总结了儿童肿瘤的流行病学特征、危险因素、检测方法以及治疗策略的研究进展。值得注意的是,不同社会人口指数(socio-demographic index,SDI)区域因医疗与公共卫生差异,导致儿童肿瘤呈现SDI较高区域发病率高和SDI较低区域死亡率高的特点;基因组学与免疫学的快速发展为儿童肿瘤精准医疗提供了重要技术支撑。本文从分级预防的视角展开综述,为科学完善儿童肿瘤防治体系提供一定的理论参考与实践方向。
前言
儿童肿瘤大多来源于中胚层(如血液系统恶性肿瘤)或外胚层(如脑肿瘤),主要分为血液肿瘤和实体肿瘤两大类[1]。研究数据显示,全球儿童癌症实际发病约为 39.7 万例,然而受诊断条件、登记体系等因素限制,仅有 22.4 万例能被及时检出,大量病例仍处于 “隐匿” 状态[2]。我国儿童和青少年肿瘤的发病率研究显示,白血病约占32%,淋巴瘤约占9.7%,其余约60%是实体肿瘤[3]。儿童肿瘤防治面临多重问题,包括高危人群监测不足,早期症状隐匿且缺乏针对性筛查手段,导致诊断滞后;专属药物研发不足,常依赖成人方案存在局限性等。本文将系统综述其流行特征、发病因素、检测方法与治疗进展。
01
流行病学
1.1 儿童肿瘤发病率与死亡率时间趋势
在1991年至2010年期间,0~14岁欧洲儿童的肿瘤发病率每年增加0.54%,增加趋势稳定;在15~19岁人群中,儿童肿瘤每年增加0.96%,在2001年至2008年期间增长趋势减缓[4]。Smith等[5]分析了6个国家在2001年至2015年儿童肿瘤的死亡率,发现死亡率稳步下降,其中白血病的儿童死亡率下降幅度最大,每年下降2.5%~6.0%。我国0~14岁儿童肿瘤发病率低于全球水平,发病率下降6.6%,死亡率下降62.2%,伤残调整寿命年率下降62.0%,过早死亡损失寿命年率下降60.7%,下降幅度均高于全球总体水平[6]。
1.2 儿童肿瘤年龄和性别分布
儿童肿瘤的发病年龄具有显著的双峰分布特征,0~4岁是第一个高峰期,15~19岁为第二个高峰,中间年龄段(5~14岁)发病率相对较低但仍有特定肿瘤高发[7]。在0~4岁阶段以胚胎性肿瘤和血液系统肿瘤为主,尤其是白血病、中枢神经系统肿瘤、神经母细胞瘤和肾母细胞瘤。在5~14岁阶段有一些特定肿瘤需要关注,如甲状腺癌和恶性黑色素瘤。在15~19岁阶段以淋巴瘤和白血病为主要类型,且生殖细胞肿瘤、甲状腺肿瘤、骨肿瘤等青春期相关肿瘤逐渐增多。全球疾病负担(global burden of disease,GBD)数据库分析显示,0~9岁儿童肿瘤呈现显著性别差异,男性的发病率和死亡率均高于女性,以急性粒细胞白血病(acute lymphoblastic leukemia,ALL)为例,男性发病率(2.26/万例)、死亡率(1.03/万例)分别高于女性的1.77/万例和0.69/万例[8]。
1.3 儿童肿瘤全球地域差异
儿童肿瘤在全球范围内呈现地域差异。据GBD数据显示,社会人口指数(socio-demographic index,SDI)较高区域的儿童肿瘤发病率最高,而SDI较低区域的儿童肿瘤死亡率和残疾调整生命年最高[9]。儿童ALL是全球紧迫的健康问题,近年来,全球儿童ALL死亡率虽呈下降趋势,但发病率存在波动,且区域差异显著,高SDI地区发病率较高但死亡率较低,低SDI地区疾病负担则呈增加趋势[10]。这种差异可能因为高收入国家医疗资源可及性高、肿瘤登记系统完善、诊断能力强、诊断数据反映真实发病情况,而中低收入国家的公共卫生体系覆盖不足和诊断能力薄弱,导致漏诊率高。
02
儿童肿瘤危险因素
一级预防又称为病因预防,重点在于消除或减少危险因素暴露,阻断儿童肿瘤发生发展的因果链条。儿童肿瘤的发生发展往往源于遗传因素与环境因素的长期交互作用,前者为肿瘤发生提供了“遗传易感性基础”,后者则通过直接损伤DNA或干扰细胞调控通路,成为触发儿童肿瘤的“外部驱动因素”。儿童肿瘤的危险因素见图1。
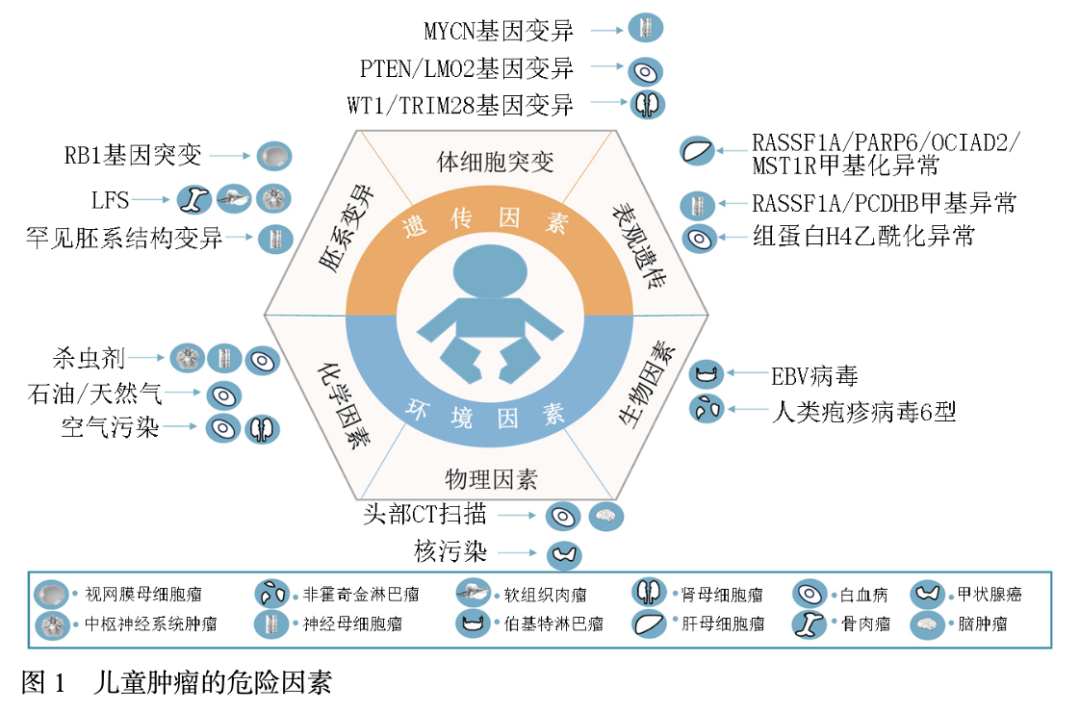
2.1 遗传易感因素
儿童肿瘤的遗传暴露因素研究主要集中在胚系变异、体细胞变异和表观遗传变异。Li-Fraumeni综合征携带者患肿瘤的风险高达80%,包括儿童期常见的骨肉瘤、软组织肉瘤和中枢神经系统肿瘤[11]。有研究[12]发现跨越编码和非编码位点的罕见胚系结构变异是儿科实体瘤的重要危险因素。Pölönen等[13]发现95.1%的T系急性淋巴细胞白血病中具有推测的驱动因素,其中59%位于基因组的非编码区。研究表明,经典易感性变异(如WT1或TRIM28)比对照组更早产生肾母细胞瘤(10个月 vs. 36个月)[14]。遗传因素也并非“绝对致病”,多数携带遗传变异的儿童仍需接触环境因素才会发生肿瘤。如苯可能通过诱导氧化应激和表观遗传改变等导致儿童白血病的发生[15]。因此“预防”仍是降低儿童肿瘤风险的关键。
2.2 环境暴露因素
儿童处于免疫系统和神经系统发育的关键期,对环境污染物的敏感性更高。一项关于环境污染和儿童肿瘤风险的研究提示,在纳入的174项研究中,不同环境污染暴露与儿童肿瘤呈正相关的研究数量占比均较高,其中,产前及产后暴露于室内空气污染、室外空气污染、杀虫剂的正相关研究占比分别为84%、79%和82%[15]。在接受CT扫描的每10 000例儿童中,在12年内会因辐射暴露而发展为血液系统恶性肿瘤的人数为1.4(95%CI:1~2)[16]。美国科罗拉多州的研究发现,居住在石油和天然气井场13公里范围内的儿童患ALL的风险升高,与参考组相比,低、中、高的强度校正逆距离加权模型组的OR值分别为1.59(95%CI:1.03~2.37)、1.40(95%CI:1.09~1.80)和2.64(95%CI:1.80~3.86)[17]。Epstein-Barr病毒(Epstein-Barr virus,EBV)状态比患者年龄更显著地影响伯基特淋巴瘤(Burkitt's lymphoma,BL)的生物学特征,EBV在儿童BL和成人BL中的阳性率分别为64%和33%[18]。EB病毒潜伏膜蛋白1可能通过LMP1-TRAF6复合物,激活NF-kB信号通路,促进B细胞淋巴瘤细胞存活[19]。
03
儿童肿瘤筛查诊断方法
二级预防的核心目标是通过早期发现、早期诊断和早期干预,在肿瘤尚未发生转移或形成明显临床表现的“临床前期”阻断肿瘤进展,显著提升治愈率并降低治疗难度。在儿童肿瘤的诊断体系中,与成人肿瘤诊断方法基本一致,主要依赖的技术手段包括:影像学评估(多层螺旋CT成像、磁共振成像和正电子发射断层扫描CT)、形态学评估(组织病理学及免疫组化分析)、分子遗传学检测(基于PCR的融合基因分析、染色体核型分析技术)、免疫表型解析(多参数流式细胞术)和高通量测序技术(全外显子组/转录组测序及单细胞测序平台)。
随着基因测序技术的发展,病因学中遗传易感因素的发现也为遗传筛查和早期诊断提供了重要依据。有研究[20]开发了一款针对儿童肿瘤监测与早期检测的泛癌基因组合(SJPedPanel),其覆盖范围包括5 275个编码外显子、297个融合/结构变异相关的内含子区域以及7 590个拷贝数改变的单核苷酸多态性位点;在实时临床基因组学(RTCG)队列报告的485种致病性变异中,SJPedPanel覆盖了86%的变异。Christodoulou等[21]采用低通全基因组测序和血浆中无细胞DNA的靶向测序检测全基因组拷贝数改变(copy number alterations,CNAs)和基因融合,37例诊断时未接受过治疗的儿童肿瘤患者中有26例(70%)检测到循环肿瘤DNA,所有对照组均未检测到体细胞CNAs。此外,基于人工智能(artificial intelligence,AI)的影像诊断技术也为儿童肿瘤的检测带来了助力。一项纳入9 902张眼底图像的研究表明,AI结合眼底图像分析检测视网膜母细胞瘤的灵敏度和特异度分别为98.2%和98.5%[22]。
04
儿童肿瘤治疗进展
儿童肿瘤的治疗以多学科综合治疗为核心,多学科团队(multidisciplinary team,MDT)由儿科、肿瘤、外科、影像、病理、营养、心理等多领域专家组成,以定期会诊协作,围绕患儿病情充分研讨,制定个性化方案。实践中MDT可能存在以下难点:1)不同学科医生因专业背景差异可能出现沟通偏差;2)各科室工作人员紧张导致会诊协调难、易延迟。医院可组织跨学科培训、搭建线上平台,以改善沟通与协作效率。本文主要介绍儿童中的血液系统肿瘤代表白血病、实体肿瘤中枢神经系统肿瘤代表脑肿瘤和颅外实体肿瘤代表神经母细胞瘤的治疗进展。
近年来,传统治疗在微创手术技术、风险分层化疗方案及精准放疗等方面持续优化。Blanc等[23]分析了89例儿童中切除的100个肿瘤,实现了切除的预期目标。因此,在特定的病例中,小儿肿瘤的机器人手术是一种安全的选择。Furman等[24]以化疗联合抗双唾液酸神经节苷脂(disialoganglioside,GD2)单抗hu14.18K322A等药物治疗高危神经母细胞瘤患儿,无患儿诱导期出现进展,3年无事件生存期达73.7%。Zhang等[25]根据临床和遗传特征将ALL儿童分为低、中、高危组,于第19、46天通过流式监测可测量残留病灶(measurable residual disease,MRD)并调整分层,此研究指出,第19天MRD≥1%的高危患儿,行强化化疗方案可优化个体化治疗。
基因组学与免疫学发展推动儿童肿瘤治疗进入精准医疗时代,ALK抑制剂等靶向治疗及抗体、免疫细胞治疗等新兴疗法,为难治/复发性患儿带来新希望。Lau等[26]为384例高危肿瘤患儿(预期治愈率<30%)开展精准引导治疗(precision guided treatment,PGT),患儿均进行下一代测序技术检测,256例(67%)收到PGT建议,2年无进展生存率高于标准护理组(26% vs. 12%)和非分子指导靶向组(26% vs. 5.2%)。拉罗替尼在治疗TRK基因融合的儿童肿瘤方面的应用正逐步成为中国专家的共识[27]。关于MEK抑制剂司美替尼在治疗复发/进展性儿童低级别神经胶质瘤(pediatric low-grade glioma,pLGG)中的试验表明,其在多个pLGG亚组中呈现稳定的治疗效果,可实现长期的疾病控制[28]。一项研究对8例复发或难治性急性髓系白血病(R/R-AML)患儿评估自体C型凝集素样分子-1(CLL1)CAR-T细胞免疫疗法,4例达到形态学无白血病和MRD阴性,无致命不良反应,初步证实其安全有效[29]。Li等[30]采用靶向GD2的CAR-T治疗复发/难治性神经母细胞瘤患儿,实现长期疾病控制,15年无事件生存率达31.6%,未发现长期后遗症。靶向人巨细胞病毒抗原pp65的多肽疫苗,在复发性高级别神经胶质瘤(high grade glioma,HGG)或髓母细胞瘤儿童和年轻人中耐受性良好,可引发HGG患者抗原特异性免疫反应[31]。
05
儿童肿瘤防治策略
儿童肿瘤的预防应遵循“病因预防-早期筛查-规范治疗与康复”的三级预防体系,从而降低儿童肿瘤的发病率和提高生存质量,见表1:1)重点针对可改变的病因进行干预,从源头减少儿童肿瘤发生;2)应对儿童肿瘤幸存者和肿瘤易感综合征患者进行定期筛查,同时借助大数据分析建立儿童健康监测模型,对不明原因的肿块、持续腹痛、连续发热等症状进行预警,还可开展社区儿童肿瘤筛查活动及加强社区宣传教育,以便早期发现儿童肿瘤,提高治愈率;3)针对已确诊肿瘤的患儿,儿童肿瘤的生物学特性与治疗复杂性决定了三级预防需以“精准治疗”与“全程管理”为核心,提高生存质量。

06
结语
本文通过对儿童肿瘤流行病特征的描述、发病高危因素的分析、检测方法和治疗进展的总结,为进一步制定儿童肿瘤防治策略提供科学的依据。总之,儿童肿瘤的三级预防需家庭、医院、社会共同努力,为患儿健康成长构建更坚实的防护网络。
End
来源丨中国肿瘤临床
查看更多