查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





免疫治疗已经成为驱动基因阴性晚期非小细胞肺癌(NSCLC)患者的主要治疗模式,临床研究数据显示吸烟史、性别、病理分型以及是否肝转移均为影响免疫治疗疗效的影响因素,但是30%~40%的晚期NSCLC患者会发生骨转移,骨转移是否会影响免疫治疗疗效目前尚无研究证实。近期,来自上海交通大学附属胸科医院的储天晴教授团队[1]和广东省中医院张海波教授团队[2]在2022年初发表了两篇回顾性研究分析,均证明——骨转移会影响PD-1治疗疗效。

储天晴 教授
上海交通大学附属胸科医院
上海交通大学附属胸科医院呼吸内科主任医师
中国临床肿瘤学会抗血管靶向专业委员会副主任委员
中华医学会中华肺癌学院执行秘书长
中国抗癌协会肿瘤精准治疗专业委员会常委
中国抗癌协会整合肿瘤专委会肺癌学组副组长
中国抗癌协会肿瘤多学科诊疗专委会委员
中国抗癌协会肿瘤微环境专业委员会委员
中国临床肿瘤学会老年肿瘤防治专业委员会委员
中国医药教育协会肺部肿瘤专业委员会委员
泛长三角胸部肿瘤联盟专委会委员
世界华人肿瘤医师协会委员
上海市女医师协会肺癌专业委员会秘书长
上海市医学会科普专委会委员
CSCO晚期NSCLC抗血管生成药物治疗中国专家共识执笔人
张海波 教授
广东省中医院
肿瘤科主任,主任医师,教授,博士研究生导师,医学博士
肿瘤辨证论治与精准治疗团队PI
MD 安德森肿瘤中心(MDACC)、纪念斯隆凯特琳癌症中心(MSKCC)及中国香港浸会大学访问教授
广东省杰出青年医学人才
广东省“千百十”工程人才培养对象
世中联肿瘤精准治疗专业委员会副会长
中国临床肿瘤学会 (CSCO) 第一届青年委员
广东省中医药学会肿瘤精准与整合治疗专委会主任委员
广东省胸部疾病学会肿瘤免疫治疗专业委员会副主任委员
广东省临床试验协会理事
主持国家科技部重大研发项目、国家自然科学基金项目及广州市健康医疗协同创新重大专项3项、国际合作项目2项、省部级项目10余项。在JAMA Oncology、Science advances、JNCCN等知名期刊发表SCI论文20余篇。


骨转移会影响PD-1治疗疗效吗?
●骨转移的发生影响晚期NSCLC患者使用PD-1免疫检查点抑制剂(ICI)治疗疗效,患者生存降低
张海波教授团队回顾性分析了2018年1月至2020年9月广东省中医院肿瘤科以PD-1为基础治疗的144 例晚期NSCLC患者,其中59例患者伴骨转移。结果显示相较于未发生骨转移的患者(BoM-),骨转移患者(BoM+)疾病控制率(DCR)从76.9%降至45.8%,P<0.001;同时,无进展生存期(PFS)和总生存期(OS)均显著降低[PFS:3.0 vs 12.3m,HR=3.95,P<0.0001;OS:10.1m vs 未达到(NR),HR=3.41,P<0.0001],如图1。
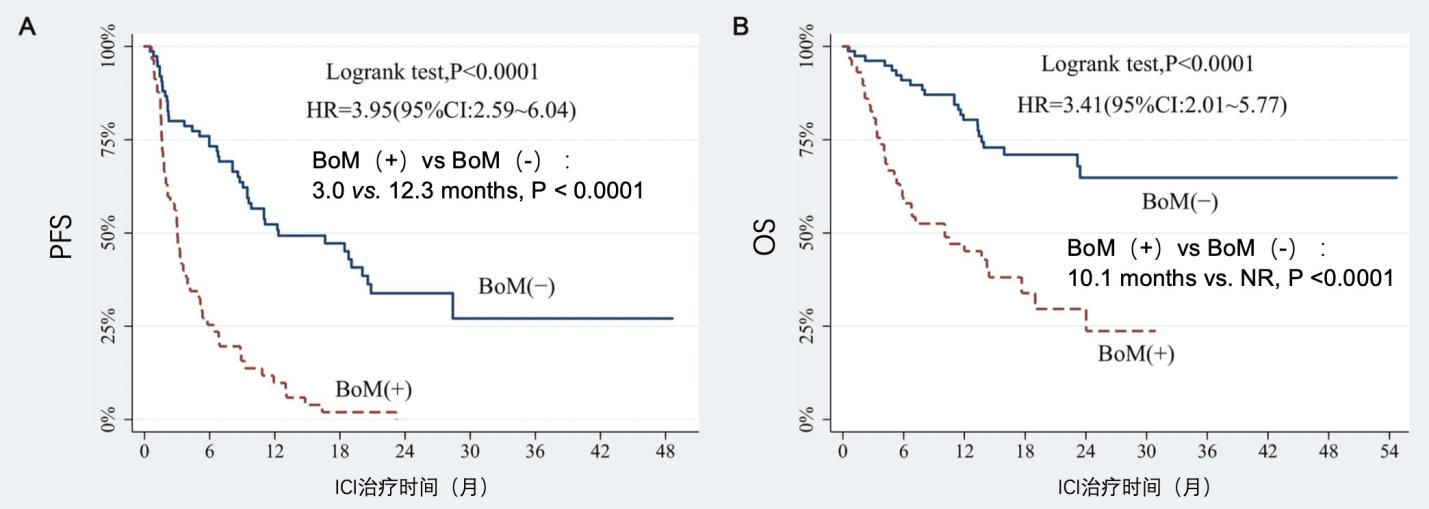
图1. 骨转移的发生影响晚期NSCLC患者ICI治疗的PFS和OS
●骨转移病灶数量影响帕博利珠单抗治疗晚期NSCLC患者疗效
储天晴教授团队回顾性分析,纳入2017年7月至2020年7月间在上海交通大学附属胸科医院接受帕博利珠单抗治疗的晚期NSCLC骨转移患者共计110例,包括单药治疗和联合治疗,不同PD-L1表达,以及不同治疗线数的患者。其中50例患者只有1处骨转移,60例患者伴2处及以上骨转移,结果证实多发骨转移患者OS低于单发骨转移患者,如图2。可能是因为仅有1处骨转移部位的患者肿瘤负荷较轻;骨相关事件较少,包括骨痛和病理性骨折;以及东部肿瘤协作组体力状况(ECOG PS)评分较低。
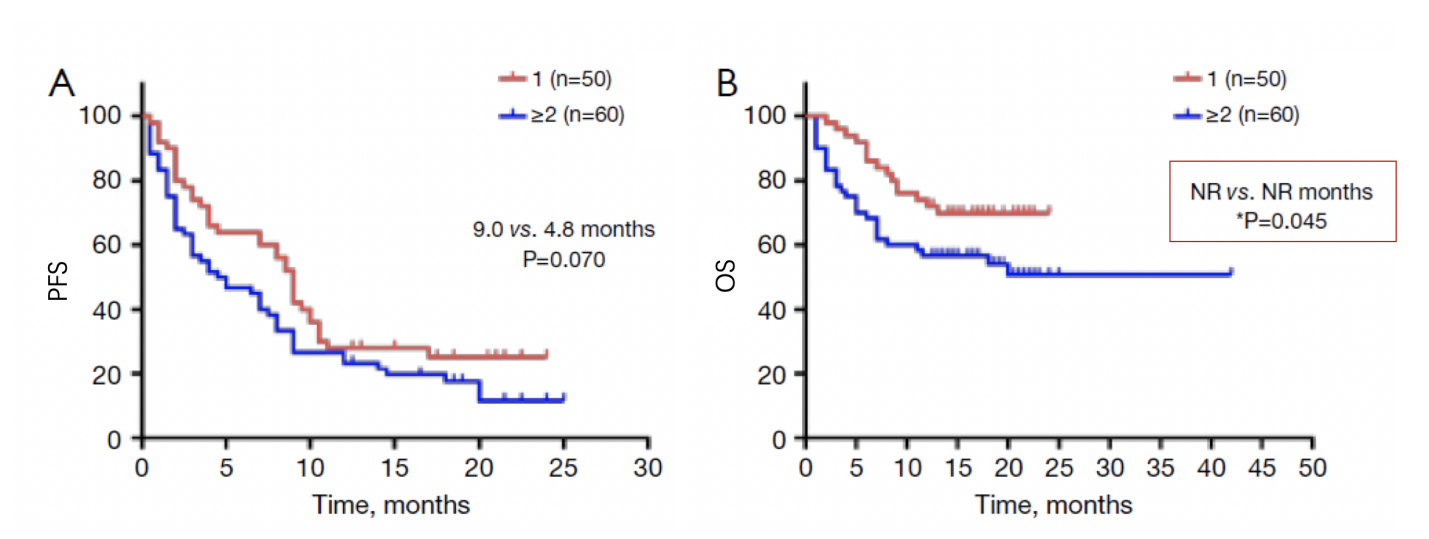
图2. 多发骨转移影响帕博利珠单抗治疗晚期NSCLC患者OS
骨转移为什么会影响
PD-1治疗的疗效?
张海波教授团队对骨转移患者的肿瘤免疫微环境进行了分析,试图探寻这些患者使用PD-1治疗疗效不尽如人意的原因。
●骨转移患者PD-L1表达更低
PD-L1表达中位值:骨转移患者vs无骨转移患者:3% vs 40%,P=0.002。骨转移患者原发肺癌PD-L1肿瘤比例评分(TPS)≥1%及TPS≥50%患者比例均更少,如图3。
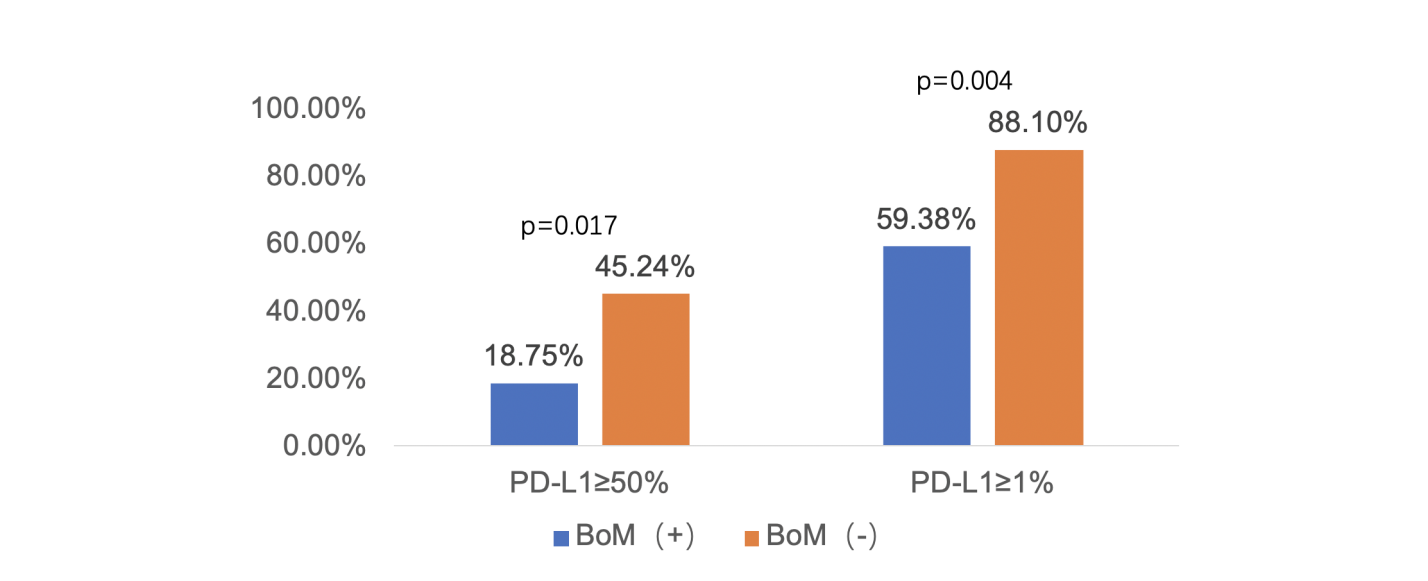
图3. 骨转移患者PD-L1表达更低
●骨转移患者的免疫微环境呈现“冷”肿瘤的特征
对另外60名未经治疗的NSCLC患者的原发肺癌组织使用多重免疫荧光染色的方法测试了十种免疫标志物,结果显示“冷”肿瘤亚组中骨转移患者比例更多(66.7% vs 21.7%,P=0.001),多因素logistic回归分析表明骨转移与“冷”肿瘤免疫特征独立相关(OR = 0.19,95%CI:0.04~0.84,P=0.028)。CD3+T细胞、CD8+T细胞、CD68+肿瘤相关巨噬细胞(TAM)等免疫细胞在骨转移患者肿瘤组织中浸润更少,如图4所示。
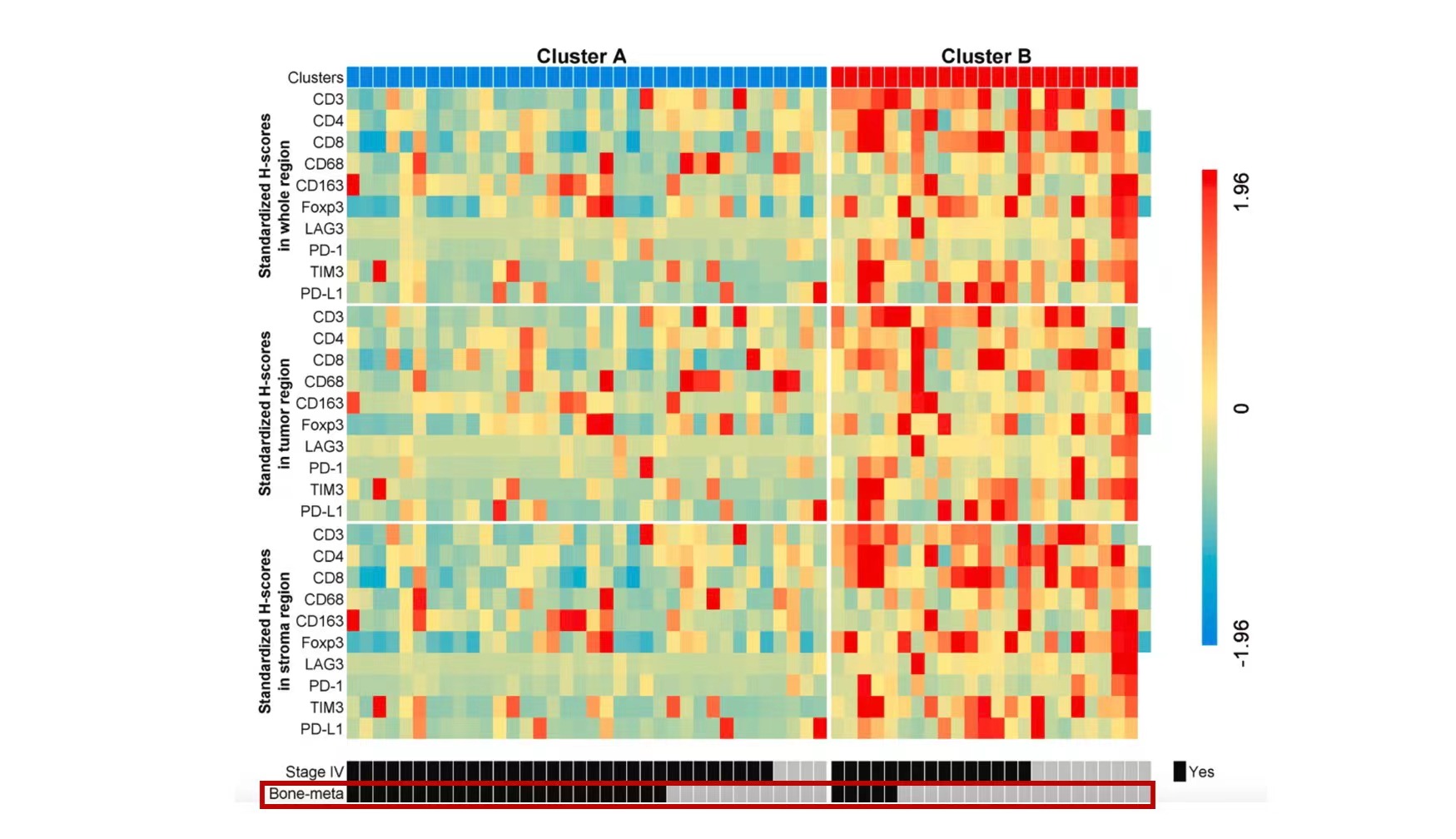
图4. 骨转移患者的肿瘤免疫微环境更多聚集于免疫标志物表达较低的A类免疫亚型
如何提高骨转移患者使用PD-1的疗效?
两位教授的研究均证明PD-1联合骨靶向药物(BTA)能够提高PD-1的疗效。
●张海波教授团队:PD-1+BTA提高免疫治疗患者PFS和OS
研究纳入的59例接受PD-1治疗的晚期骨转移NSCLC患者中,有29例(49.2%)患者同时接受了骨改良药物的治疗,相较于未接受骨改良药物治疗的患者,PFS和OS都有显著的提高(PFS:5.1m vs 2.1m,HR=0.44,P<0.0039;OS:17.7m vs 4.4m,HR=0.46,P<0.02),如图5。
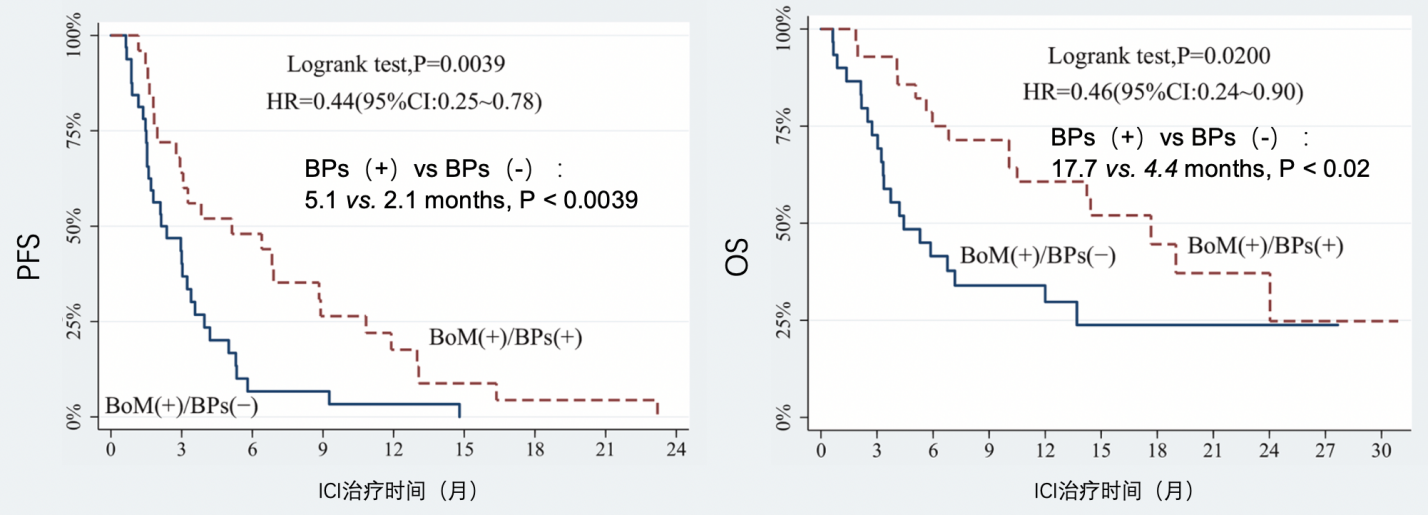
图5. 晚期NSCLC骨转移患者在接受ICI治疗的基础上联合使用BTA类药物,延长PFS和OS
●储天晴教授团队:帕博利珠单抗+BTA提高患者客观缓解率(ORR)和PFS
研究中纳入的110例骨转移患者中,83例(75.5%)接受了针对骨病灶的治疗,其中57例(68.7%)只接受了骨改良药物治疗,15例(18%)只接受了姑息性放疗,11例(13.3%)同时接受了上述两种方式治疗。如图6所示,接受了骨改良药物治疗的患者ORR和PFS均有提高,并达到统计学显著差异;OS数值显示有延长,但未达到统计学差异。尤其要强调的是,只接受姑息性放疗的患者,并未提高帕博利珠单抗的疗效,不论是ORR、PFS或OS,究其原因可能是因为接受放疗的患者数较少,存在一定偏倚。
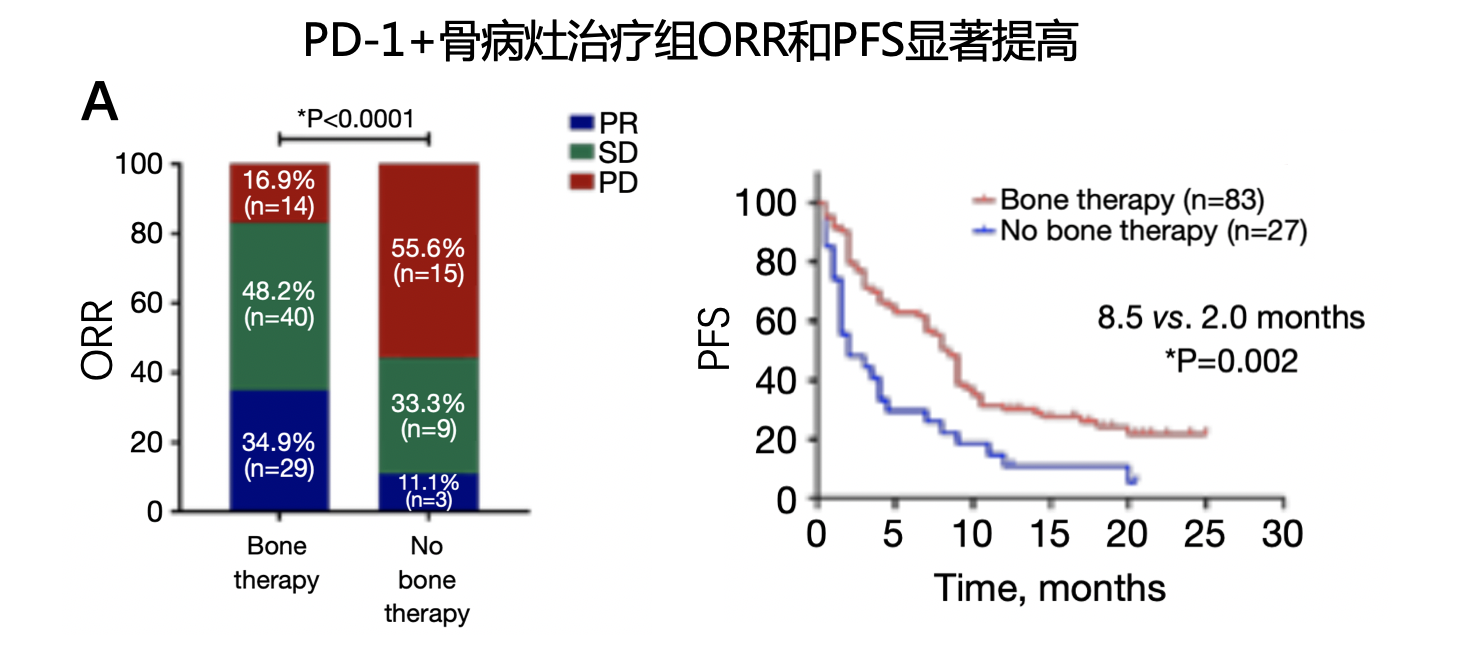
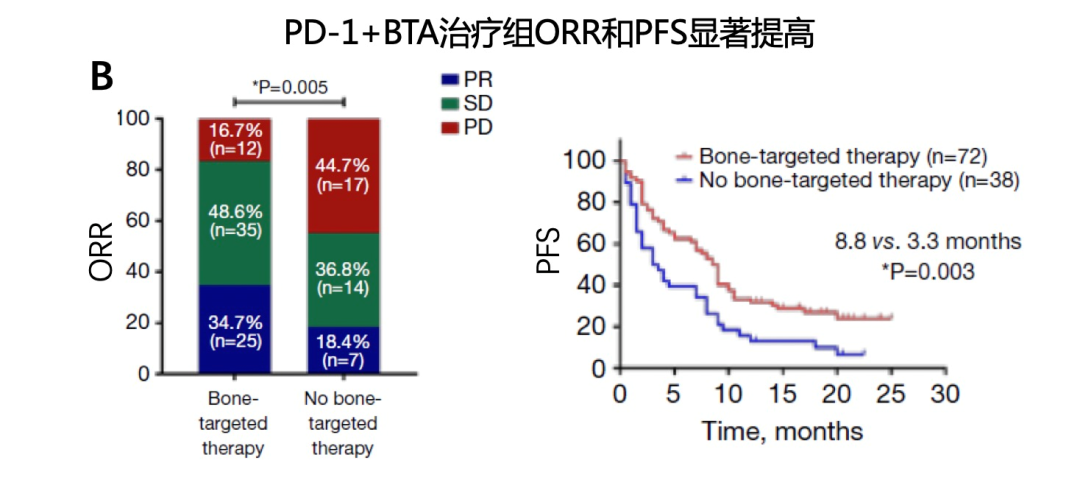
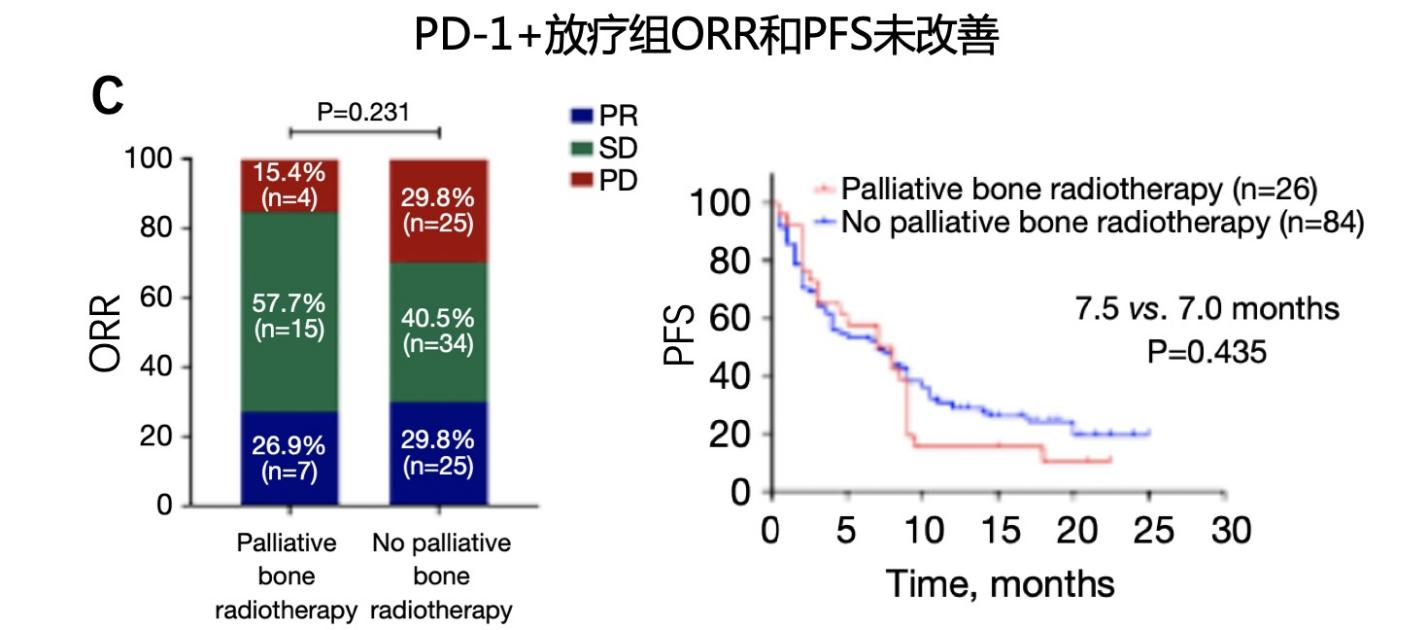
图6. 晚期NSCLC骨转移患者,联合骨改良药物提高帕博利珠单抗的疗效
骨改良药物为什么能提高
免疫治疗疗效?
●储天晴教授团队分析阐述:
骨改良药物通过抑制破骨细胞,控制患者骨转移引起的症状,比如缓解疼痛,延迟骨折,避免患者丧失自主生活能力,从而提高患者的生活质量,增加治疗依从性和信心。此外已有研究数据表明,对于肺癌骨转移的患者,地舒单抗联合PD-1治疗,可以改善生存[3],如图7。
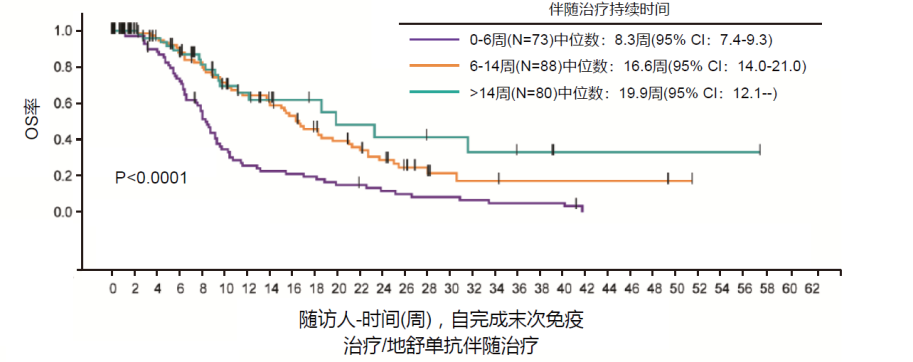
图7. NSCLC队列,PD-1联合地舒单抗治疗,两者联用的时间越长,OS获益越多
●张海波教授团队讨论阐述:
1)骨转移“恶性循环”导致疗效不佳
骨转移病灶中,肿瘤细胞与骨微环境相互作用形成“恶性循环”[4]。肿瘤细胞释放多种细胞因子如IL-1、IL-6、TNF-α、M-CSF、VEGF等,刺激破骨细胞的分化和活性,从而破坏骨重建平衡。破骨细胞的过度活化导致骨质破坏,释放多种促肿瘤生长因子,包括TGF-β、IGF、FGF、PDGF等,如图8所示[5],可能解释了骨转移患者治疗疗效不佳的原因。BTA可以通过抑制核因子κB受体活化因子配体(RANKL)抑制破骨细胞介导的骨吸收,从而中断骨转移“恶性循环”。
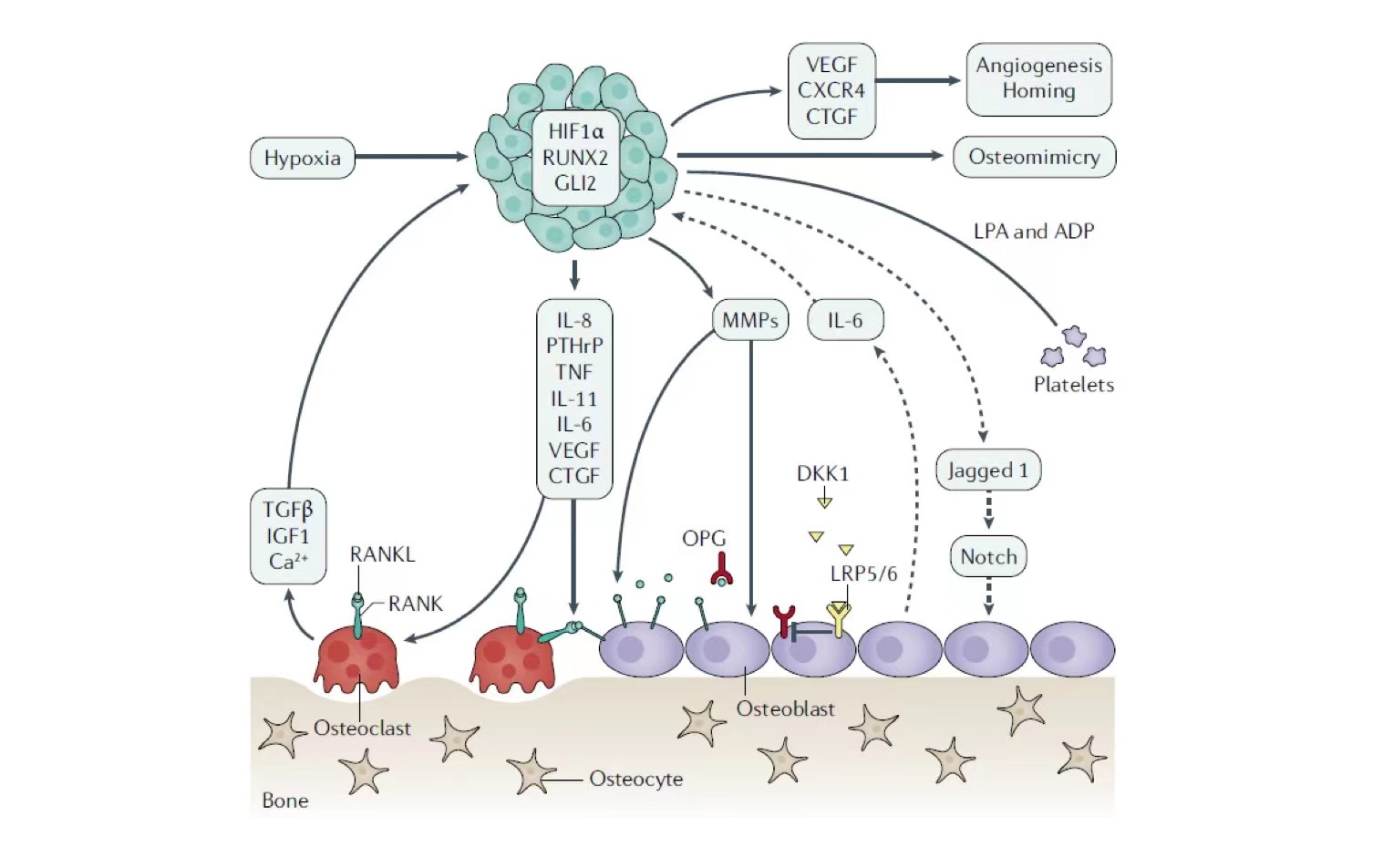
图8. 骨转移“恶性循环”
肿瘤和骨微环境互相影响
2)骨转移影响原发灶的免疫微环境
本研究也证明了骨转移的患者原发灶更偏“冷”肿瘤特征,这也给我们一些提示,骨转移和原发灶之间可能存在相互影响。事实上,骨转移瘤细胞与免疫系统“恶性循环”的概念已被提出,如骨吸收释放的TGF-β可增加抑制性Th17极化并抑制Th1效应T细胞的发育等[6]。正如本研究结果显示,这些免疫失活导致“冷”肿瘤特征的免疫微环境和免疫治疗疗效的降低。
●骨改良药物打破“恶性循环”,改善免疫微环境:
骨转移的恶性循环导致成骨细胞RANKL表达升高,其与RANK受体结合,促进了破骨细胞的增殖与激活,进一步释放出更多的细胞因子促进肿瘤的增殖。地舒单抗作为RANKL抑制剂,能够阻断此通路的激活[7]。除了成骨和破骨细胞,肿瘤细胞、肿瘤微环境的免疫细胞也表达RANK、RANKL,通过阻断RANK/RANKL信号通路,从而阻断肿瘤骨转移恶性循环带来的免疫抑制,可能是骨改良药物带来获益的原因。
值得注意的是,多个临床前和早期临床研究显示,地舒单抗可以通过抑制RANK/RANKL结合,从而解除免疫抑制,发挥免疫协同效应[8],如图9所示。虽然已有多项回顾性临床研究证明,ICI联合地舒单抗可以增加疗效[9,10],但仍需大规模临床研究证实。
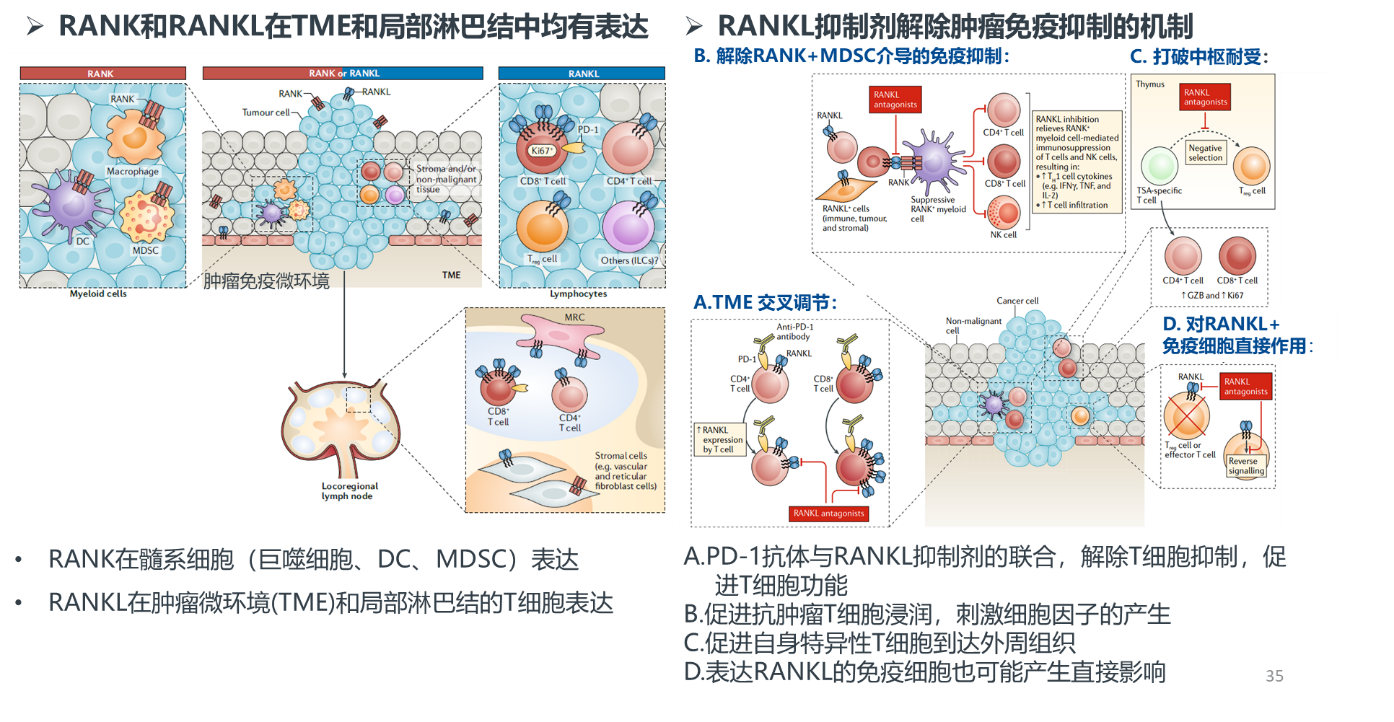
图9. RANKL抑制剂发挥免疫协同效应的可能作用机制
参考文献:
[1] Huiping Qiang,et al. Transl Lung Cancer Res. 2022 Jan;11(1):87-99
[2] Yan-Juan Zhu,et al. Lung Cancer. 2022 Mar 10;166:189-196.
[3] Liede A, et al. Oncoimmunology. 2018 Sep 5;7(12):e1480301
[4] Anthony Turpin, et al. Transl. Oncol. 13 (2020) 308–320.
[5] Robert E Coleman, et al. Nat Rev Dis Primers. 2020 Oct 15;6(1):83.
[6] S. Jiao, et al.Cell. 179 (5) (2019) 1177–1190.e13.
[7] Chirgwin JM, et al. Crit Rev Eukaryot Gene Expr 2000;10:159-78
[8] Ahern E, et al. Nat Rev Clin Oncol. 2018 Nov;15(11):676-693.
[9] 2021 World Conference on Lung Cancer. September 8-14, 2021.
[10] Yenong Cao, et al. J Thorac Dis. 2021 Aug;13(8):4668-4677.
▼往期精彩回顾▼
牛晓辉教授:精准骨靶向药物——RANKL抑制剂地舒单抗的研发历程
查看更多