查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





【编者按】
随着AI技术的不断深化,其在消化领域的应用已日臻广泛,在疾病的诊断、治疗及预后等方面取得了丰硕的研究成果。通过提高诊断的特异度和灵敏度,AI助力临床医生作出更为精准的决策,从而优化患者的临床获益并,提升医疗效率。中国医学论坛报社特邀四川大学华西医院胡兵教授团队总结2023年度AI在消化领域中的应用进展,进一步探讨AI在此领域所展示的巨大潜力。
作者:四川大学华西医院消化内镜中心刘霜 袁湘蕾 叶连松 王舜尧 胡兵
胡兵教授
近年来,随着深度学习、机器学习算法的发展以及硬件水平和数据库的不断完善,人工智能(artificial intelligence, AI)在医学领域的应用日益广泛,特别是在疾病的筛查、诊断、治疗及预后等方面。AI技术已取得显著成果,为医学行业带来了巨大革新,为传统医疗模式注入了勃勃生机。2023年AI技术在消化领域中的应用硕果累累,取得了诸多重要进展。
我国食管癌高发,发病人数和死亡人数均位列全球之首,早诊早治至关重要。浅表食管癌及癌前病变特征在内镜下不典型,对内镜医师的诊断水平要求较高。我国内镜筛查质量参差不齐,食管癌早诊早治面临严峻考验。四川大学华西医院胡兵教授团队于胃肠病学国际顶级期刊《柳叶刀·胃肠病学与肝脏病学》(Lancet Gastroenterol Hepatol)发表了一项多中心随机对照临床试验结果,该研究评估了AI辅助内镜诊断技术在真实临床应用中对浅表食管鳞状细胞癌及癌前病变的诊断效能。本研究连续招募在12家参与医院行无痛胃镜检查者11982例。受试者被随机分配至试验组(AI辅助检查优先组)或对照组(常规检查优先组)。同一名内镜医师在同一天依次为受试者进行两次食管检查。研究发现AI辅助内镜检查显著提高了浅表食管癌及癌前病变的检出率,展现出减少病变被漏诊的潜力,并具备良好的安全性。该研究是全球首个在真实临床实践中评估AI模型实时辅助诊断浅表食管癌及癌前病变的报道。
在此基础上,胡兵教授团队使用AI发现了全球最小的早期食管鳞癌病例。AI可在临床常用的四种内镜模态下实时、准确地检测并精准描绘病灶边界(图1)。这一成果已在消化内镜领域的顶级期刊《内镜》(Endoscopy)杂志上发表。
图1 AI模型在4种内镜模式下(白光内镜、窄带光谱成像、放大窄带光谱成像、碘染色)
检测并精准勾画一例大小约3.0 mm×2.6 mm的平坦型早期食管癌
(左上)白光内镜;(右上)窄带光谱成像;(左下)放大窄带光谱成像;(右下)碘染色。
AI与结直肠息肉
结直肠癌(colorectal cancer, CRC)是全球常见的消化道恶性肿瘤之一,全世界每年新增病例约190万。在所有恶性肿瘤中,结直肠癌的发病率和死亡率分别位居第三和第二位,严重威胁人类生命健康。在结直肠癌的发病机制中,结直肠息肉(包括腺瘤性息肉和锯齿状息肉)主要通过“腺瘤-腺癌顺序”发展成CRC。结直肠息肉的早诊早治能够有效地阻断“腺瘤-腺癌”的发病进程,是降低结直肠癌发病率和死亡率的根本途径。
内镜检查是筛查结直肠息肉的主要方法,但结直肠息肉的漏诊率较高,AI被引入以提高结直肠息肉的检出率。吉林大学联合中国香港中文大学等机构开展了一项前瞻性随机临床试验,研究AI辅助结肠镜在筛查人群时的结直肠息肉检出率(adenoma detection rate, ADR)。该研究招募了3059例45至75岁的无症状患者,随机分配至AI辅助肠镜组和常规肠镜组。该研究首次大规模在仅包含无症状对象的人群中探究了AI辅助肠镜筛查结直肠息肉的效力。研究发现,AI实时辅助显著提高了总ADR,表明在无症状人群中使用AI辅助可以帮助内镜医师发现更多结直肠息肉,从而促进早期诊断和治疗,降低结直肠癌的发病率。
AI与溃疡性结肠炎
溃疡性结肠炎(Ulcerative colitis, UC)的内镜评估与患者的临床结局密切相关。目前,UC的常规内镜评估局限于镜下所观察到的肠道黏膜受累最严重的区域,并采用传统的梅奥内镜评分(MES)。然而,内镜观察所获细节不全面,且有文献表明使用MES评分相同的UC严重程度和疾病进展可能不同。鉴于MES在UC患者个体化内镜评估中的不足,其他人工评分系统相继产生,但它们的可行性和可及性受到限制。
近年来,AI技术的发展为临床医生评估炎症性肠病提供了新的工具。《胃肠病学》(Gastroenterology)杂志发布了一项研究介绍了计算机视觉技术在量化评估UC内镜下炎症中的应用。该研究利用深度学习算法,在MES评分基础上,通过空间映射生成了累积疾病评分(Cumulative Disease Score, CDS)(图3)。研究比较了CDS和MES在评估乌司奴单抗治疗应答和症状缓解方面的一致性。结果显示,乌司奴单抗组的CDS在治疗第8周和第44周均低于安慰剂组。CDS相较于MES,在评估内镜下炎症的变化方面更敏感。因此,CDS作为一种AI赋能的自动化定量测定方法,可以更全面、更有效地评估UC的镜下炎症和疾病严重程度。
图3 研究流程图:对某一内镜视频计算CDS步骤示意图
(A)步骤1:内镜视频转换为静止帧(每秒15帧);(B)步骤2:静止帧传递给训练后的信息帧与非信息帧分类器,分离质量不合格、不利于评估的信息帧;(C)步骤3:保留的信息帧经MES评分;(D)步骤4:使用位置估计模块定位结肠全段计算相应各处MES评分,生成全动态录像带;(E)步骤5:统计评分:举例展示其中3例研究对象在乌司奴单抗治疗第0、8和44周内镜检查视频左半结肠CDS评分;(注:为了强调重症UC的重要性,使用MES评分数值的平方,考虑到大多数受试者仅进行了乙状结肠镜检查,仅使用左半结肠分布CDS评分)
AI与胆胰疾病
超声内镜(Endoscopic ultrasound, EUS)是诊断肝胆胰疾病的常用手段,而在临床应用中,EUS内镜医师的表现差异大,且由于监督不足和医疗环境的快节奏,质量控制指标成效有限。在检查过程中,肝胆胰复杂的解剖结构使检查易出现盲点,发生漏检,影响患者的临床结局。过去几年里,尽管AI在EUS领域有所应用,但多集中在静态图像分析,而AI用于监测EUS检查质量的研究尚不明确。
针对此问题,武汉大学湖北省人民医院团队进行了一项单中心前瞻性随机对照试验。利用深度学习技术,研究团队扩展了前期研究的EUS图像数据集,自主开发了新的“胆胰8站识别模型”——“EUS-IREAD”。该模型经过精细训练,实现了胆胰系统的可视化(图4)。该研究共纳入297例患者,随机分配至EUS-IREAD辅助组和常规EUS检查组。EUS-IREAD辅助组要求AI设备在检查过程中实时为内镜医师提示标准站扫描进度及解剖结构,检查完成后,视频被发送给数据分析团队进行审核。研究发现,EUS-IREAD辅助能显著降低内镜医师的漏检率,体现了AI技术在提高EUS检查质量方面的重要作用与潜力。
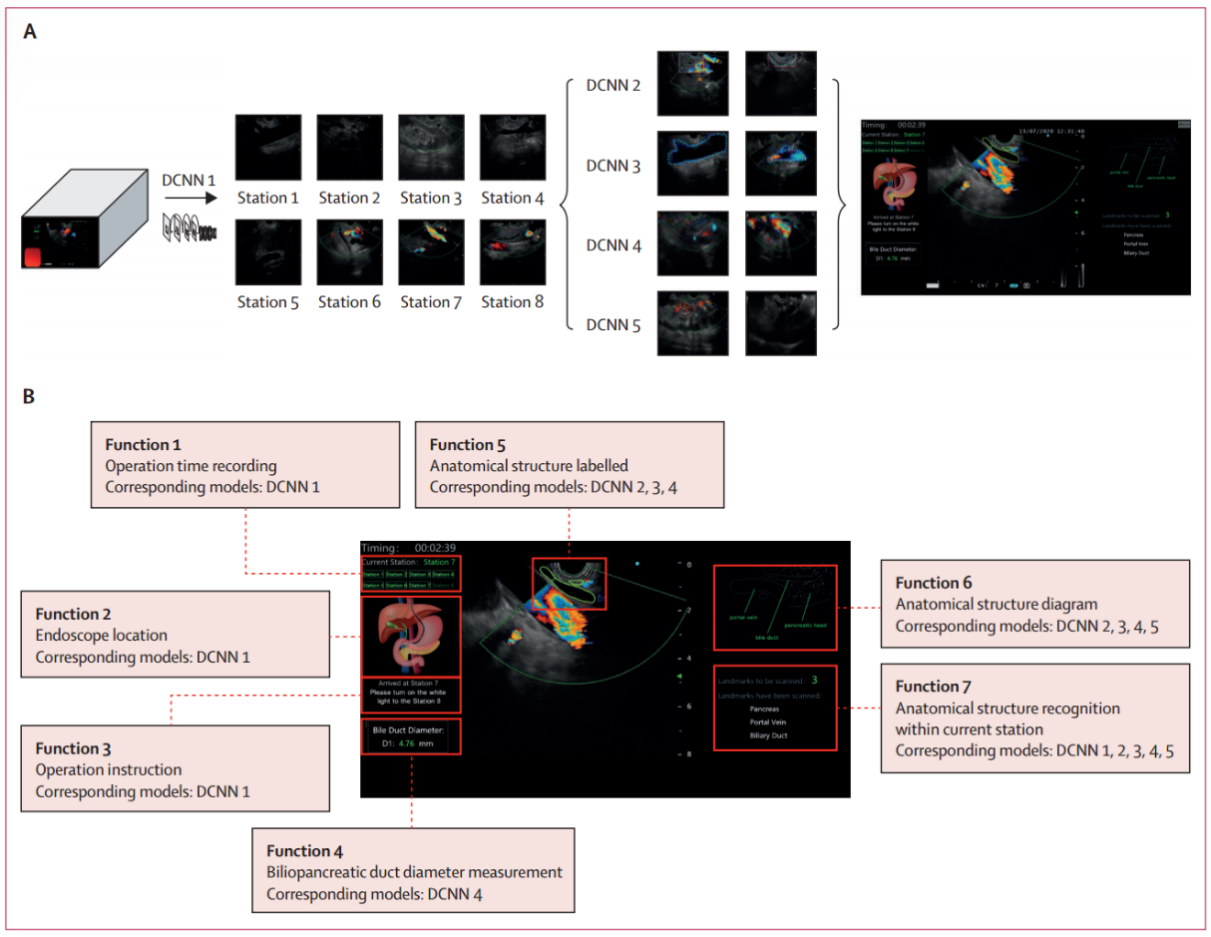
EUS-IREAD工作流(从左向右) DCNN1识别8个占位:1号站识别腹主动脉,2号站识别胰体,3号站识别胰尾,4号站识别汇合处,5号站识别肝门,6号站识别胰头,7号站识别十二指肠球部,8号站识别十二指肠降部;解剖定位模块构成和各部分功能:DCNN2用于胰腺的分段标注,DCNN3 用于血管的分段标注,DCNN4用于胆道的分段标注,DCNN5 用于肾脏和脾脏的分段标注;(B)EUS-IREAD的工作界面和功能
此外,AI技术还应用于识别结直肠息肉的分型、内镜评估幽门螺杆菌感染、EUS鉴别诊断胰腺囊肿等。AI同传统诊断方法和技术相结合,大大提高了消化系统疾病的诊断灵敏度和特异度。
AI与胆总管结石
约7%~12%的胆石症患者存在胆总管(Common bile duct,CBD)结石。内镜逆行胰胆管造影术(Endoscopic Retrograde Cholangio-Pancreatography, ERCP)是治疗CBD结石的首选方法。然而由于技术难度和多种因素的影响(CBD远端成角、CBD结石尺寸等),该术式的操作具有挑战性。评估ERCP技术难度有助于提高手术质量。
为更准确地评估和预测CBD取石过程中ERCP技术难度,武汉大学湖北省人民医院团队在过往研究成果基础上开展一项多中心前瞻性观察性研究,旨在验证计算机辅助系统(CAD)在评分、分类和评估ERCP难度中的有效性。试验连续纳入诊断或疑似CBD结石须经ERCP治疗的患者,在ERCP操作过程中,当造影剂填充整个胆管时,内镜医师冻结影像图片,此时CAD系统会在一个外挂屏幕上自动生成技术难度评分和视觉标签,而不会干扰内镜医师查看手术操作界面(图5),ERCP程序根据CAD评分将患者划入“困难”组或“容易”组,研究者收集比较两组临床资料。研究结果表明CAD评分系统可以有效评估ERCP过程中内镜下取石的技术难度并进行分类,为手术提供可量化的指导。
图5 ERCP取石过程中胆总管造影成像和视觉标签。左图:容易组;右图:困难组。
AI与肝细胞癌
阿替利珠单抗-贝伐珠单抗是经FDA批准首个用于肝细胞癌治疗的一线免疫疗法,但仅在部分肝细胞癌患者中观察到较显著的临床获益,因此需要开发生物标志物来改善临床管理。阿替利珠单抗-贝伐珠单抗反应标记(Atezolizumab–bevacizumab response signature,ABRS)是经RNA测序技术确定的与该一线免疫治疗开始后患者无进展生存期相关的一组基因标签。然而,RNA测序技术成本高昂,故在临床实践中将基因标签作为生物标志物存在挑战。
2023年12月《柳叶刀·肿瘤》(Lancet Oncol)杂志发布了一项多中心回顾性临床研究,该研究将AI热图技术与空间转录组学相匹配,利用热图深入了解与预测相关的分子特征。研究首先利用TCGA-LIHC公共数据库中的全切片扫描组织学图像和RNA测序结果中的ABRS标签,开发了ABRS-P模型。然后相继采用两个外部样本(先手术样本,后肝组织活检样本)验证了ABRS-P模型。接着在不同中心正接受阿替利珠单抗-贝伐珠单抗治疗的122例肝细胞癌患者中测试ABRS-P模型的预测值。最后研究者利用AI热图技术将ABRS-P模型预测值与空间转录组学数据进行匹配,研究手术切除样本中预测区域的原位基因表达。ABRS代表阿替唑珠单抗-贝伐珠单抗的治疗反应标记。
研究结果表明肝细胞癌组织切片可通过AI热图技术估计ABRS活性(图6),在接受阿替唑珠单抗-贝伐珠单抗治疗的患者中可作为无进展生存的生物标志物,降低医疗成本,服务于临床应用。
图6 左图:样本D2血红蛋白-嗜eosin染色切片;右图:对应预测热图
(ABRS-P值在0到1之间重新缩放)
AI在医学图像诊断领域和消化内镜检查方面显现出卓越性能,许多专家共识和临床指南肯定了AI在消化领域中所展现的巨大潜力,但其在临床实践中的应用和涉及的医学伦理有待进一步深入研究。
2023年,AI在消化疾病的诊断、治疗以及预后等均取得了丰富的研究成果。过往几年里,AI在消化领域中的研究成果主要集中于识别结直肠息肉等病变,随着AI技术进一步的发展以及与医学更深层次的融合,AI在消化领域不同疾病、不同诊疗环节中均表现出了极大的潜力:帮助临床医生提高诊断的灵敏度和特异度,服务于临床决策,改善患者临床收益,提高医疗效率。在研究者们的共同努力下,AI在消化领域中的角色得到了更深更广的拓展,本文仅展示国内外各研究团队所做工作的一部分。AI在消化领域前景广阔,相信其在消化领域的应用将会越来越广泛,也将有更多高质量的临床研究支持。

本文版权属于中国医学论坛报社,转载须授权
查看更多