查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:东部战区总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所 樊璠 梁丹丹 吴燕 刘志红
病历摘要
主诉及现病史
患者男性,42 岁,因“尿检异常、贫血10年,血肌酐升高1年”入院。
2005年,患者体检发现贫血(具体值不详),尿蛋白(PRO)3+,尿隐血+,予纠正贫血治疗,血红蛋白(Hb)上升,尿液未复查。
2014年1月,患者无明显诱因出现腹痛、黑便,当地医院查PRO 3+,Hb 73 g/L,血小板(PLT)89×109/L,血清肌酐(Scr)131 μmol/L,腹部增强计算机体层摄影(CT)示巨脾,肝门部、腹主动脉周围、脾门内侧胰尾上方多发肿大淋巴结,胃底静脉曲张,予输血、止血等对症治疗后大便转黄。
同年5 月,患者再次解黑便。外院行腹部B超示肝脾肿大,胰腺尾部多发肿大淋巴结。手术切除脾脏及肿大淋巴结,术中可见胰腺尾部肿大淋巴结压迫脾静脉导致脾静脉回流受阻,脾静脉曲张。术后病理提示,胰腺尾部淋巴结Castleman 病(CD)伴淀粉样变性,脾脏淀粉样变性。术后患者未再出现黑便,Hb 逐渐恢复正常。
患者定期复查,尿检PRO波动于2+~3+,Scr逐渐升至215 μmol/ L。为进一步诊治,将患者收入院。
既往史及家族史
患者既往有“乙肝小三阳”病史20年,未治疗,余无特殊。个人史无特殊。母亲曾患“乙肝大三阳”。
体格检查
患者血压120/66mmHg,神志清楚,咽不红,扁桃体不大。双侧颏下、颈部可触及散在肿大淋巴结,轻度活动,周界清楚,质地中等,无压痛。心、肺查体未见明显异常。腹部正中见一纵行长约15cm陈旧性瘢痕,双下肢无浮肿。
实验室检查
尿液PRO定量9.32 g/24 h;红细胞计数2万/ml;红细胞形态为多形型;管型定型阴性;尿N- 乙酰-β-D- 葡萄糖苷酶(NAG)28.7 U/g·cr,视黄醇结合蛋白(RBP)27 mg/L,溶菌酶5.6 mg/L。
血液血常规及血生化:Hb144 g/L,PLT 444×109/L,白细胞11.8×109/L,白蛋白(ALB)29.4 g/L,球蛋白28.8 g/L,尿素氮27.7 mg/dl,Scr 1.92 mg/dl,胱抑素C3.55 mg/L,总胆固醇5.72mmol/L,甘油三酯2.03mmol/L,钾4.39 mmol/L,钠139.4 mmol/L, 氯105mmol/L,磷1.18 mmol/L,钙2.32 mmol/L,空腹血糖5.26 mmol/L,估计肾小球滤过率(eGFR)41.70 ml(/ min·1.73m2)。
免疫学IgG 14.6 g/L,IgA 1.98 g/L,IgE<20 IU/ml,IgM 1.55 g/L,抗链球菌溶血素“O”(ASO)40.7 IU/ml,类风湿因子(RF)<20IU/ml;抗可提取核抗原(ENA)抗体阳性,血清抗核抗体(ANA)1:128,抗双链DNA 抗体(A-dsDNA)阴性,抗磷脂酶A2受体抗体阴性,补体C3 1.01 g/L,补体C4 0.134 g/L。外周血淋巴细胞亚群:CD3+细胞3599 个/μl、CD4+细胞2289 个/μl、CD8 + 细胞1039 个/μl,血清单克隆游离轻链κ 84.0 mg/L、λ83.3 mg/L、κ/λ 1.0,免疫固定电泳图谱未见异常。
骨髓骨髓细胞学正常,骨髓活检正常。
其他乙肝核心抗体(-),乙肝E抗体(+),乙肝E抗原(HBeAg)(-),乙肝表面抗体(-),乙肝表面抗原(HBsAg)(+),乙肝病毒(HBV)-DNA 聚合酶链式反应检测4.79×103 IU/ml,肿瘤标志物阴性。
辅助检查
肾脏B超示,左肾/右肾110 mm /114 mm,皮质厚度不清,皮质回声增强。头颈部CT示,甲状腺右叶及峡部低密度结节,考虑腺瘤可能;颏下区及颈部散在小淋巴结。胸部CT示,纵隔、气管隆突下及气管前淋巴结肿大。腹部CT示,腹膜后多发淋巴结肿大;脾切除术后。心脏超声示,左室舒张功能减低。
组织活检病理
患者入院后借调外院切除的胰腺尾部肿大淋巴结、脾脏标本切片行轻链及A蛋白染色,并行肾活检。
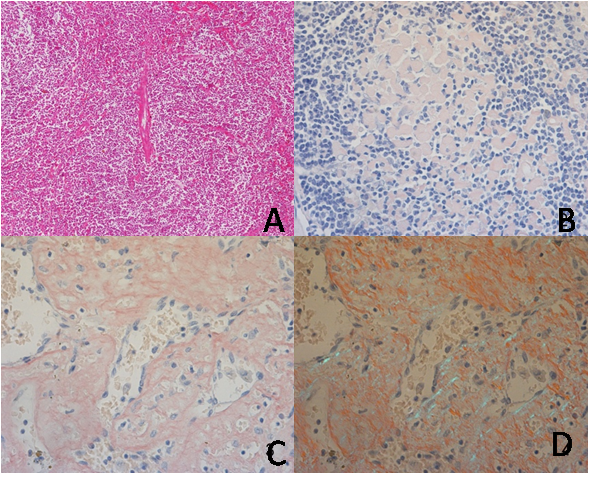
图1 淋巴结和脾脏病理改变 图A Castleman病HV型:淋巴滤泡生发中心见透明变样小血管插入(HE染色,×100);图B 淋巴结内可见大量淡红色均质状物质沉积,刚果红染色阳性(刚果红染色,×200);图C、图D 脾脏刚果红染色阳性,偏振光下见苹果绿双折光(刚果红染色,×200)
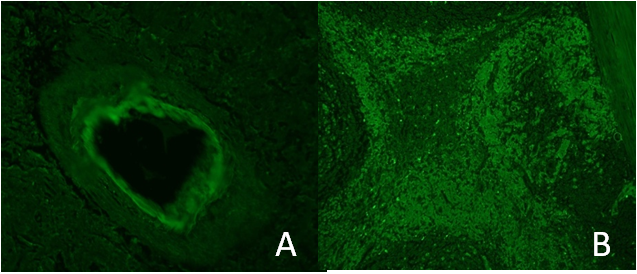
图2 脾脏和淋巴结组织A蛋白染色 图A、图B 脾脏血管壁、淋巴结滤泡及滤泡间质A蛋白染色阳性[免疫荧光(IF), ×200]
外院胰腺尾部淋巴结及脾脏病理① 胰腺尾部淋巴结CD伴淀粉样变性(图1A、1B);② 脾脏淀粉样变性(图1C、1D)。脾脏、胰腺尾部淋巴结淀粉样变性分型轻链染色阴性,A蛋白染色阳性,提示为淀粉样A蛋白(AA)型淀粉样变性(图2A、2B)。
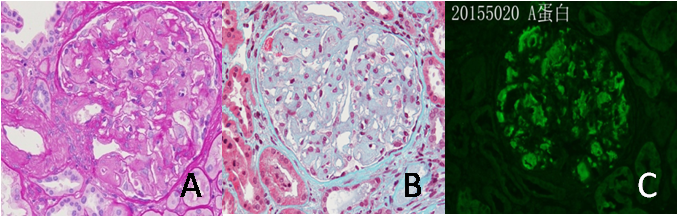
图3:肾组织病理改变 图A 肾小球系膜区见呈少细胞、均质PAS淡染的物质沉积(PAS,×400);图B 肾小球系膜区无细胞性嗜亮绿物质沉积(Masson-Trichrome,×400);图C 肾小球系膜区、血管袢及间质血管A蛋白阳性。(IF,×200)
肾活检病理① 光镜:48个肾小球中19个球性废弃或接近球性废弃,余正切肾小球体积增大,系膜区轻度增宽,系膜区弥漫苏木精- 伊红染色(HE)淡染,过碘酸雪夫染色(PAS)弱阳性,Masson染色嗜亮绿的均质物质沉积,毛细血管袢开放好,上皮侧较多毛刺样嗜银物。肾小管间质轻度慢性病变合并轻度急性病变,小灶性肾小管萎缩、基膜增厚。小叶间动脉内膜增厚、弹力层分层,小动脉透明变性,亦多见上述淡染物质沉积(图3A、3B);② 免疫荧光:冰冻切片荧光染色IgA+、IgM+,弥漫分布,呈颗粒状沉积于系膜区。IgG、C3、C1q均阴性。冰冻切片荧光染色HBsAg、HBcAg、HBeAg均阴性。肾小球A蛋白阳性,弥漫分布,呈团块状沉积于系膜区及血管袢。间质血管A蛋白阳性。肾组织轻链检查:冰冻切片荧光染色k、λ均阴性。肾组织刚果红染色示弥漫系膜区及多处间质血管壁阳性,偏振光下见苹果绿双折光(图3C);③ 电镜:观察1个肾小球,肾小球系膜区增宽,可见不均匀、淡染物质,高倍镜下可见节段毛细血管内皮下及皮侧上不均匀、淡染物质,肾间质血管见无定形的丝状结构沉积。足细胞足突节段融合,肾小球内皮细胞病变明显。
诊断与治疗
诊断
患者诊断为:① 多中心型CD(MCD);② AA型淀粉样变性(累及肾脏、脾脏、淋巴结),肾淀粉样变性(慢性肾脏病3 期);③慢性乙型病毒性肝炎。
治疗
诊断明确后,建议患者转血液科化疗,患者拒绝。予泼尼松30 mg/d、雷公藤多苷60 mg/d以减少蛋白尿,辅以保肾治疗。
出院1个月后复诊,患者PRO 降至5.24 g/24h,Scr 降至1.52 mg/dl,一般情况良好,无不适主诉,泼尼松缓慢撤减,停用雷公藤多苷。患者不规则服用泼尼松,PRO波动于4~5 g/24h,Scr 波动于1.5~1.8 mg/dl。
2016年11月复诊,患者PRO升至15.59 g/24 h,Scr 升至2.19 mg/dl,泼尼松加至30 mg/d,后多次复查PRO 再次降至5~6g/24 h,但Scr缓慢上升。\
2017年11月20日最后一次随访,患者泼尼松减至20 mg/d,复查PRO5.85 g/24 h,Scr 升至4.5mg/dl,白蛋白(ALB)36.5g/L,Hb 146 g/L,无贫血。
诊疗分析
本患者为中年男性,以贫血、黑便、脾大、无症状蛋白尿起病,病情逐渐加重,出现肾病综合征伴肾功能减退,具体有以下临床特点:①肾脏损害以大量蛋白尿为主要表现,高血压,肾功能减退,无血尿;② 有20 余年乙肝病史;③肾外表现为全身多处淋巴结肿大,脾大,反复黑便,贫血;④外院切除脾脏、胰腺尾部肿大淋巴结后,贫血改善,未再出现黑便,病理示胰腺尾部淋巴结CD伴淀粉样变性,脾脏淀粉样变性。据以上特点,患者CD诊断明确。
患者外院行脾脏、胰腺尾部肿大淋巴结切除,病理示胰腺尾部淋巴结CD伴淀粉样变性,脾脏淀粉样物质沉积,提示肾脏损害也可能为淀粉样变性。造成淀粉样变样的物质有20余种,其中系统性轻链(AL)型最常见,约占80%,其次为AA型及家族或遗传性淀粉样变性。入院后借调外院胰腺尾部肿大淋巴结、脾脏标本切片行轻链及A蛋白染色,并行肾活检,提示肾脏、脾脏、淋巴结均为AA型淀粉样变性,可以排除原发性肾小球疾病、乙肝相关性肾炎等继发性肾脏疾病。
患者多脏器AA型淀粉样物质沉积是否与CD相关?AA型淀粉样变性常见原因是慢性感染及自身免疫病,可见于类风湿关节炎、结核、慢性化脓性感染、肠道炎症、肿瘤等,以肾脏、肝脏、脾脏受累为主,肾脏损害表现为蛋白尿、肾病综合征,部分患者可进展为肾功能不全。进一步查阅文献,CD是AA型淀粉样变性的病因之一,CD患者体内多存在炎症介质升高,系统性炎症反应是其主要发病机制。
因此考虑患者肾脏、脾脏、淋巴结AA型淀粉样变性继发于CD。
讨论
概述
Castleman病由卡斯尔曼(Castleman)于1956年首次报告。这是一种淋巴组织增生异常性疾病,又称为血管滤泡淋巴组织增生或巨大淋巴结增生症,是一种临床上少见的、以全身无痛性淋巴结肿大为主要特征的疾病,其确诊主要依靠病理检查。临床上CD可分为单中心型(UCD)和多中心型(MCD);病理类型可分为透明血管型(HV)、浆细胞型(PC)、混合型(HV-PC)。
CD 可发生于任何年龄,男女发病率相近,多无特异性临床表现,不同临床分型的临床表现差异很大。
UCD患者发病年龄相对较小,多为HV型,常无明显临床症状,多表现为单一部位淋巴结肿大,可因肿大淋巴结压迫导致相应部位症状,实验室检查多正常。
MCD患者发病年龄相对较大,多为PC型,常表现为全身多部位淋巴结肿大,可累及多脏器、多系统。可出现发热、盗汗、乏力、消瘦等全身症状,可伴多浆膜腔积液、肝脾肿大等。实验室检查可见贫血、低白蛋白血症、血沉加快、C反应蛋白和白介素(IL)-6升高、肝肾功能异常、免疫球蛋白增高等。
本患者临床表现为全身多部位淋巴结肿大及多脏器受累,肝脾肿大、黑便、贫血、大量蛋白尿、低白蛋白血症及肾功能不全,淋巴结活检病理示CD(HV型),可诊断为MCD。值得注意的是,患者脾大、反复黑便,考虑与胰腺尾部肿大淋巴结压迫脾静脉导致脾静脉回流受阻和脾静脉曲张、胃底静脉曲张有关,而非CD直接侵犯脾脏、肠道所致。
CD相关性肾损伤的临床病理特征
CD 累及肾脏多为个案报告,发病率为8.5%~25%,以MCD多见,病理常表现为PC型。临床表现为血尿、蛋白尿、肾病综合征、急性肾损伤、肾小管损伤等,部分病例可进展为终末期肾功能衰竭。多数患者有蛋白尿,约一半患者可合并急性或慢性肾损伤。
CD相关肾损伤病理改变以血栓性微血管病(TMA)、AA型淀粉样变性多见,少数表现为新月体性肾小球肾炎、微小病变肾病、膜性肾病、间质性肾炎等。Yuan 等总结75 例经淋巴结及肾活检明确为CD并累及肾脏患者的临床病理资料,其中26例(35%)为UCD,49例(65%)为MCD;60 例(80%)为PC,20%为HV,46例(61%)表现为肾病综合征。肾脏病理结果示26例(35%)为AA型淀粉样变性,13 例(17%)为TMA,其中AA型淀粉样变性患者,蛋白尿是其主要临床表现,且以肾病综合征范围内的蛋白尿更多见,镜下血尿少见,易进展为终末期肾脏病。与AA型淀粉样变性相比,TMA型蛋白尿较少,进展为终末期肾脏病的概率低。
本患者病理改变为AA型淀粉样变性,肾脏临床表现为肾病综合征,已出现慢性肾功能减退,提示预后不佳。
CD相关性肾损害发病机制
CD病因和发病机制不清,目前较多研究表明CD发病与体内炎性介质IL-6、血管内皮生长因子(VEGF)分泌增多密切相关。此外,人类疱疹病毒(HHV)-8和人类免疫缺陷病(HIV)的感染及免疫紊乱等也与CD发病有一定关系。
目前认为CD导致肾脏AA型淀粉样变性的机制是CD患者病变淋巴结生发中心过度分泌IL-6,激活炎症反应后刺激肝脏合成血清淀粉样蛋白A(SAA),患者SAA 升高。
SAA为AA前体,是一种急性时相反应蛋白,在单核巨噬细胞的作用下形成不能降解的淀粉样蛋白,持续沉积于组织内,可形成肾淀粉样变性。有研究显示,阻止SAA 产生及肾组织中AA的沉积,可使蛋白尿有所减少,进一步证实SAA在发病机制中具重要作用。
目前认为TMA 发病与VEGF有关。有研究显示,CD患者淋巴结生发中心、滤泡间区浆细胞及血清中VEGF增加。IL-6可诱导VEGF 表达,进一步通过浆细胞的自分泌作用产生VEGF,使血清中VEGF表达升高。研究表明,将大鼠足细胞表达VEGF的基因敲除后,肾小球局部VEGF下降可致肾脏TMA 发生。穆特尼亚(Mutneja)等对CD合并肾脏TMA 样病变患者行肾活检,与正常人相比,患者肾小球足细胞VEGF表达下降。但血清VEGF 和IL-6的持续过高表达如何导致足细胞VEGF表达下降这一机制尚不清楚,有待进一步研究。
CD相关性肾损害治疗及预后
CD 相关性肾损害的治疗应以原发病治疗为主。UCD患者治疗以手术切除为主,治愈率高,预后较好,必要时对局部病灶行小剂量放射治疗,对改善患者预后具积极作用。MCD患者尚无标准治疗方案,手术切除疗效不佳,多采取综合性治疗,预后较差。目前治疗方案包括糖皮质激素单药或与化疗药物联合、抗病毒治疗、靶向治疗、免疫调节治疗、自体干细胞移植等。目前抗CD20单抗(利妥昔单抗)常作为MCD的一线治疗方案,且有报道显示,该药可降低MCD患者转变为淋巴瘤风险。对于一般情况较好且不伴有病毒感染的MCD患者,建议单独使用利妥昔单抗或联合糖皮质激素,若疗效不佳,则考虑换用抗IL-6抗体(西妥昔单抗)或抗IL-6受体抗体(托珠单抗)。评估患者病情缓解情况,若病情进展,考虑换用CHOP等传统化疗方案;对于一般情况较差的MCD患者,首选西妥昔单抗或托珠单抗联合糖皮质激素治疗,可有效降低患者体内炎症因子水平,改善患者临床症状。此外,也有使用硼替佐米、全反式维甲酸、γ干扰素等治疗病情缓解的病例,但其长期作用效果及毒副作用需要进一步验证。
目前CD继发AA型淀粉样变性患者的治疗多为个案报道。UCD主要采取手术切除,多数患者临床症状在手术后明显改善。对于未行手术切除的MCD患者,治疗较复杂。有研究表明,有5例患者使用托珠单抗,1例使用利妥昔单抗,疗效个体差异较大,部分患者临床症状有明显改善。另有报道称,接受糖皮质激素、环磷酰胺、秋水仙碱等治疗后,患者病情部分缓解。总体而言,CD合并肾AA型淀粉样变性患者较其它肾脏病理类型预后更差,肾功能呈长期缓慢升高趋势。本患者随访至2017年11月20日,仍有大量蛋白尿,PRO 5.85 g/24 h,Scr升至4.5 mg/dl,考虑与CD合并AA型淀粉样变性预后较差及患者未针对原发病进行化疗有关。
小结
本文报道1例CD继发AA型淀粉样变性病例。CD发病率较低,无特征性临床表现,如患者以肾脏损害为首发症状,极易漏诊、误诊。因此,当肾脏科医师遇到不明原因慢性贫血、肾脏损害及淋巴结肿大者,尤其肾活检病理示TMA或AA型淀粉样变性者,应高度考虑有无CD可能。应尽早行淋巴结活检,少数患者单次淋巴结活检可呈阴性,需要反复多部位淋巴结活检。对于诊断明确的患者要尽快进行针对性治疗。
(本文来自《中国医学论坛报》东部战区总医院肾病病例专题,转载请注明出处。)
查看更多