查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





点击进入专题:
作者:复旦大学附属华山医院神经内科 血管组 张怡然 洪澜
ApTOLL是一种能拮抗Toll样受体4(Toll-like receptor 4,TLR4)的单链核酸(ssDNA)适配体(aptamer),对TLR4具有高度亲和力[1],因而被认为能够阻断急性缺血性脑梗死[2]、急性心肌梗死[3]等疾病进程中的免疫应答。
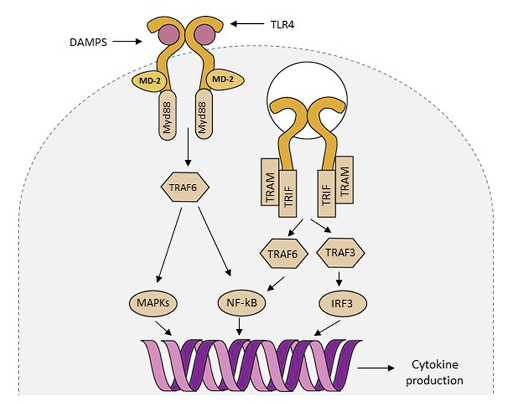
作为Toll样受体家族成员之一,TLR4也是一种识别受体,在识别内源性危险信号,即损伤相关的分子模式(Damage-Associated Molecular Patterns,DAMPs)后激活,启动包括MAPK在内的一系列信号传导,产生炎性介质和细胞因子,在固有免疫和炎症反应中发挥着重要的作用[4]。Lizasoain教授团队首次在2007年提出TLR4在缺血性脑梗中的作用,该研究发现,相比对照(正常表达TLR4)的小鼠,TLR4基因敲除或者TLR4基因突变的小鼠在大脑中动脉闭塞MCAO建模后具有更低的炎症介质、更小的梗死体积和更佳的神经行为评分[5]。在其后的另一项缺血再灌注小鼠模型中[6],TLR4基因的敲除显著减少了延迟再灌注治疗带来的出血转化风险,同时该研究再一次证明相较对照鼠,TLR4缺失小鼠中的金属蛋白酶-9(MMP-9)表达明显下降,而该蛋白酶被认为是诱导和调节脑组织损伤的重要活性物质。
通过指数富集的配基进化(systematic Evolution of ligands by Exponential Enrichment , SELEX)技术,同一个研究团队从构建的随机单链核酸序列库中筛选出与TLR4特异性结合的高度亲和力的核酸适体ApTLR#4FT[2],后被命名为ApTOLL。在临床前研究中,该适配体在包括小鼠和大鼠的多个MCAO动物模型中均被证实具有持续的脑保护作用;且在大鼠的缺血再灌注模型中,ApTOLL的安全性和有效性得到进一步说明,支持研究成果向脑梗死再灌注治疗患者的临床转化[2]。
2019-2020年,该研究团队和aptaTargets公司合作在健康志愿者中完成了ApTOLL首个在人体试验的临床1期研究[1]。通过剂量爬升试验和多剂量(multiple-dose)队列,研究发现药物的平均半衰期在9.3小时;药物暴露测量值在药物剂量达到14 mg以上后不再增加,药物多次间隔叠加也未显示出剂量累积效应,具有与脑梗急性期治疗适应的药物动力学特征(若半衰期长或者具有累积效应,药物可能会阻挡TLR4所启动的第二阶段修复反应)。同时令人惊喜的是,该试验[1]没有报告1例严重不良反应,具有可靠的安全性。
2023年2月8日,来自西班牙Vall d’Hebron医院的Macarena Hernández博士和Marc Ribó博士公布了APRIL(A Double-Blind, Placebo-Controlled, Randomized, Phase Ib/IIa Clinical Study of ApTOLL for the Treatment of Acute Ischemic Stroke)研究的结果。
APRIL研究由aptaTargets S.L.公司申办,Ribó博士和Hernández博士牵头,法国和西班牙共14个中心参与,是一项双盲、安慰剂对照、随机的Ib/IIa期临床试验。该研究旨在评估不同剂量的ApTOLL在计划行动脉内治疗的急性脑梗患者中的安全性及耐受性。

研究的纳入标准为:
1. 距离最后正常时间6小时内
2. NIHSS评分≥8分且≤25分
3. CTA证实的颈内动脉末端(TICA)或者大脑中动脉M1段或者M2段闭塞
4. 完善多模式CT或者MRI检查,且符合以下任一标准
a. CTP梗死核心(rCBF<30%)>5 ml 且 <70 ml
b. 或者MRI DWI弥散受限灶体积>5 ml 且 <70 ml
5. CT平扫ASTPECTS评分6~10分
6. 计划行血管内治疗,不论是否进行静脉溶栓
研究的排除标准为(节选自NCT网站):
1. 过去1年内发作过脑梗
2. 临床症状提示双侧脑梗死或者多处血管流域受累
3. 基线血小板<500×109/ml
4. 具有出血倾向、凝血功能障碍或者口服抗凝剂且INR>3
5. 脑血管炎
6. 活动性系统性感染……
研究终点:
主要结局(安全性):
1. 死亡
2. 症状性颅内出血
3. 恶性脑梗死
4. 再发脑梗死
次要结局(有效性):
1. 最终梗死体积(定义为72小时MRI-FLAIR上病灶大小)
2. 72小时NIHSS评分
3. 90天功能残疾(90天改良Rankin评分)
符合标准的患者将根据不同分期的要求纳入不同剂量或者对照组。受试者将在动脉穿刺前接受药物或者安慰剂的30 min静脉滴注。
研究分为两个部分:第一部分Ⅰb期为剂量筛选试验,四个剂量组(0.025、0.05、0.1、0.2 mg/kg)每组分别纳入8名受试者,每组按照3:1的比例给予ApTOLL和安慰剂,最终由DSMB根据四个剂量的安全性决定是否继续,并选择最合适的2个剂量进入下一阶段;在Ⅱb期中,以上2个剂量组和安慰剂组按照1:1:√2的比例继续纳入患者,与Ⅰb期对应剂量组的患者合并,按照分组(as allocated)对结果进行分析。

研究从当地疫情最严重2020年7月开始直到2022年4月结束,共纳入了151名患者。在Ⅰb期试验中明确了在患者体内ApTOLL的药物半衰期为13.4小时,约1.35小时达到剂量峰值;同时0.05 mg/kg和0.2 mg/kg被DSMB选择继续下一段的研究,最终两个药物组分别42人、安慰剂组55人纳入Ⅱa期的统计分析。

3组的平均年龄在68~71岁,基线NIHSS评分为17~19分,基线梗死核心约20~25 ml。0.05 mg/kg、0.2 mg/kg剂量组和安慰剂组分别有69%、64%和53%的患者接受了静脉溶栓治疗。平均发病值随机时间在150~175分钟之间。最终0.2 mg/kg剂量组达到eTICI评分2c-3的百分比在数值上稍高达到69%,而0.05 mg/kg和安慰剂组相似约64%左右。

就研究主要终点而言(安全性),研究发现0.2 mg/kg剂量组的ApTOLL能够显著降低患者的死亡风险,绝对降低值达14%(安慰剂18.2% vs 0.2 mg/kg 4.8%),同时在数值上也有降低症状性颅内出血、脑水肿风险的趋势。在有效性结局上,尽管三组在基线CTP的梗死核心大小和基线NIHSS评分并无显著差异,0.2 mg/kg剂量组较其余两组均在72小时有更小的梗死体积(P=0.0434)、更低的NIHSS评分(P=0.0127)。此外,相较对照组,0.2 mg/kg剂量组还显示出更良好的功能预后,在mRS评分位移分析中cOR值达到2.61(95%CI:1.27~5.35)。
本研究结果提示,0.2 mg/kg的TLR4受体拮抗剂ApTOLL联合血管内治疗处理发病6小时的急性前循环大血管闭塞的脑梗死患者是安全的,且相较对照组能显著降低90天的死亡率和残障比例,显示出潜在的临床价值。此初步结果亟待进一步大规模试验的验证。
随讲者一起回顾药物研发史,从2007年的TLR4在脑梗发病机制的明确到2023年如今的初步成果,横跨16年,不得感叹转化医学绝非一蹴而就,靠的是岁月的累积和证据的层层积淀。作为一种不依赖于生物制备的单纯化学合成的小分子,ApTOLL具有无可挑剔的生产优势——可以大规模制造,具有较高的稳定性和可调节性[1];同时也避免了生物制剂的生物学不相容属性[1],具有极高的应用价值。如今的证据也指向其生物学安全性及药效学稳定性,具有极大的潜力。
不过值得注意的是,本研究对6小时窗内的病人进行了多模式影像筛选,研究者的初心是剔除太轻(核心体积小)或过重(核心体积大)的患者,以避免以上人群冲淡药物的疗效。安慰剂组较低的静脉溶栓率可能也扩大了药物安全性和效应值的大小。ApTOLL在临床上的应用前景需要进一步研究的成果的证明。
参考文献:
[1] HERNANDEZ-JIMENEZ M, MARTIN-VILCHEZ S, OCHOA D, et al. First-in-human phase I clinical trial of a TLR4-binding DNA aptamer, ApTOLL: Safety and pharmacokinetics in healthy volunteers [J]. Mol Ther Nucleic Acids, 2022, 28: 124-35.
[2] FERNANDEZ G, MORAGA A, CUARTERO M I, et al. TLR4-Binding DNA Aptamers Show a Protective Effect against Acute Stroke in Animal Models [J]. Mol Ther, 2018, 26(8): 2047-59.
[3] RAMIREZ-CARRACEDO R, TESORO L, HERNANDEZ I, et al. Targeting TLR4 with ApTOLL Improves Heart Function in Response to Coronary Ischemia Reperfusion in Pigs Undergoing Acute Myocardial Infarction [J]. Biomolecules, 2020, 10(8).
[4] DURAN-LAFORET V, PENA-MARTINEZ C, GARCIA-CULEBRAS A, et al. Pathophysiological and pharmacological relevance of TLR4 in peripheral immune cells after stroke [J]. Pharmacol Ther, 2021, 228: 107933.
[5] CASO J R, PRADILLO J M, HURTADO O, et al. Toll-like receptor 4 is involved in brain damage and inflammation after experimental stroke [J]. Circulation, 2007, 115(12): 1599-608.
[6] GARCIA-CULEBRAS A, PALMA-TORTOSA S, MORAGA A, et al. Toll-Like Receptor 4 Mediates Hemorrhagic Transformation After Delayed Tissue Plasminogen Activator Administration in In Situ Thromboembolic Stroke [J]. Stroke, 2017, 48(6): 1695-9.
查看更多