查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





在过去的几十年里,以新辅助放化疗联合全直肠系膜切除术(TME)的多模式治疗已经成为局部晚期直肠癌(LARC)的标准治疗。其中外科技术的改进和新辅助放化疗(CRT)或短程放疗(SCRT)的应用虽然将LARC的5年局部复发率降低到5%-8%,但远处转移的发生率仍高达30%左右,这也是导致直肠癌患者死亡的主要原因。术后辅助化疗(CT)目前也被作为治疗推荐,但由于患者术后辅助化疗的完成度低,且临床获益尚不明确,仍然存在争议。未来,探索局部晚期直肠癌合理的全程管理策略,以减少远处转移的发生是亟待解决的问题。
近年来,全程新辅助治疗(TNT)策略受到广泛关注,它是一种在手术之前将化疗与放疗相结合的治疗方式,目的是提供持续的全身治疗以消除微转移,包括在新辅助CRT或SCRT之前或之后增加诱导或巩固CT,最后进行手术。TNT具有以下潜在优势:提高了治疗的耐受性和依从性,能够在早期对微转移进行干预治疗,提高了肿瘤完全应答率,克服了辅助CT的一些局限性。此外,该疗法也有可能会增加患者的毒性和过度治疗的风险。
既往只有少数随机对照临床试验评估了TNT在局部晚期直肠癌中的作用,结果并不一致。为了进一步阐明TNT对比标准新辅助在LARC治疗中的疗效与安全性,本文汇总了两篇近期发表的相关研究的系统评价和荟萃分析结果,以飨读者。
专家简介

朱梁军 教授
◆ 江苏省肿瘤医院内科主任医师;
◆中国医疗保健国际交流促进会消化道肿瘤多学科(MDT)分会 常务委员
◆ 中国医师协会结直肠肿瘤专业委员会第一届内科治疗专业委员会委员;
◆ 中国医药教育协会腹部肿瘤结直肠癌分会委员;
◆ 首届中国研究型医院学会精准医学与肿瘤MDT专业委员会委员;
◆ 中国临床肿瘤学会(CSCO)结直肠癌专家委员会委员;
◆ 中国临床肿瘤学会(CSCO)肝癌专家委员会委员;
◆ 中国临床肿瘤学会(CSCO)临床研究专家委员会委员;
◆ 江苏省肿瘤防治联盟大肠癌专家委员会副主任委员;
◆ 中华结直肠癌MDT联盟江苏分盟主席;
◆ 江苏省医师协会结直肠专委会委员;
◆ 江苏省抗癌协会大肠癌专业委员会委员;
◆ 江苏省医学会胰腺病分会委员;
◆《Annals of Oncology》肿瘤学年鉴(中文版)杂志编委
一、局部晚期直肠癌全程新辅助治疗vs标准治疗的系统评价与荟萃分析[1]
研究方法:
这项研究遵循了系统评价和荟萃分析的优先报告条目(PRISMA)指南,MEDLINE(通过PubMed)和Embase(通过OVID)检索了截止到2020年7月1日,以肛门/肛门直肠肿瘤或新辅助治疗或二者均含为关键词的随机临床试验或前瞻性/回顾性队列研究。根据以下标准筛选研究:(1)入组接受手术的LARC患者;(2)研究为TNT vs CRT+手术+术后辅助化疗(CRT+A);(3)有pCR率的结果和以下任何一项(如果有)结果:保留括约肌手术、回肠造口术、无病生存期或总体生存期,其他不符合筛选要求的研究排除。数据提取与综合包括:第一作者、发表时间、研究单位、样本量、pCR率、保留括约肌手术、回肠造口术、无病生存和总生存期。采用PRISMA提取数据,并采用随机效应模型(DerSimonian和Laird方法)进行汇总。主要研究终点:pCR率、保留括约肌手术、回肠造口术和无病生存期和总生存期。
研究结果:
在回顾了2165项研究后,筛选出了7项符合要求的研究,共2416例患者,其中1206例接受了TNT治疗。接受TNT治疗的患者中位年龄为57-69岁,其中58%-73%为男性,关于整体生存的数据并未得到一致的报道。
表1.荟萃分析中所包括研究的基线特征
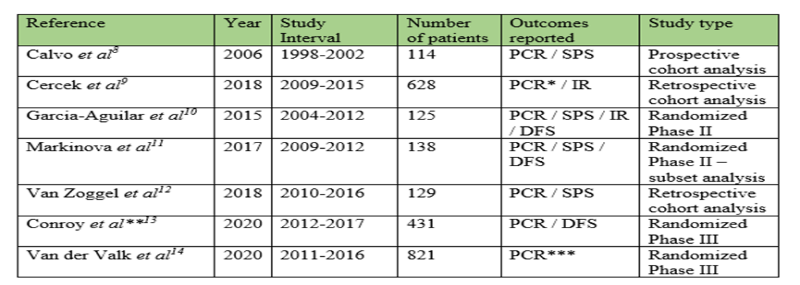
所有7项研究均报告了pCR的结果,TNT组pCR率为29.9% (范围, 17.2%-38.5%) ,CRT+A组为14.9% (范围, 4.2%-21.3%) ,图2森林图显示TNT治疗组与获得病理完全应答相关性高 (OR, 2.44; 95% CI, 1.99-2.98) 。
图2.研究组之间病理完全缓解比例的森林图比较
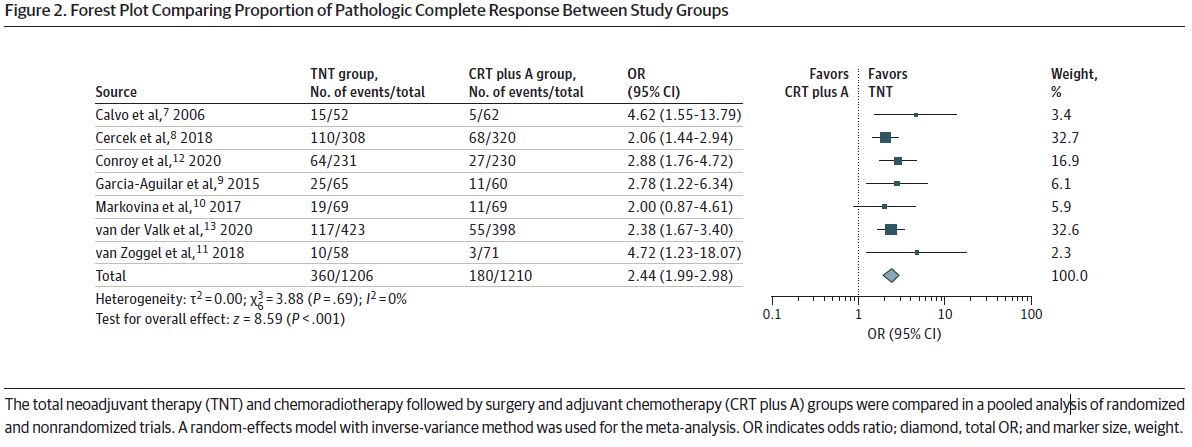
仅在4项研究中报道了保留括约肌的手术,同时,仅2项研究报告了回肠造口术的结果。经分析发现TNT组和CRT+ A组,保留括约肌手术 (OR, 1.06; 95%CI, 0.73-1.54) (如图3) 或回肠造口术 (OR, 1.05; 95%CI, 0.76-1.46) 的比例无统计学差异 (如图4) 。
图3.研究组之间保留括约肌手术比例的森林图
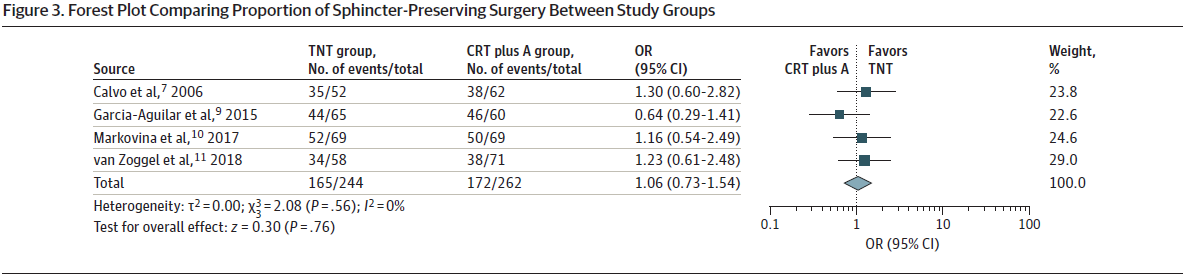
图4.研究组之间回肠造口术比例的森林图
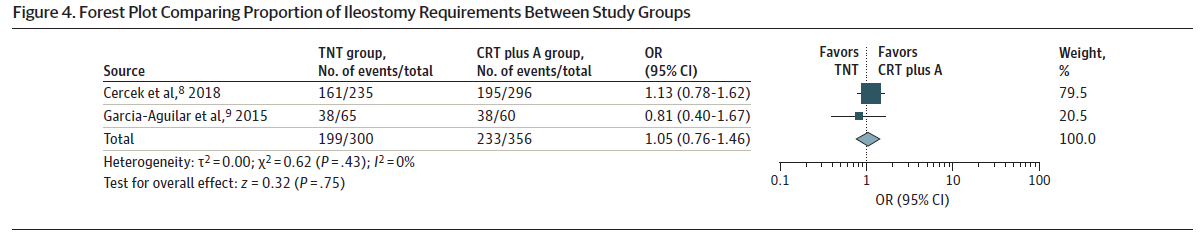
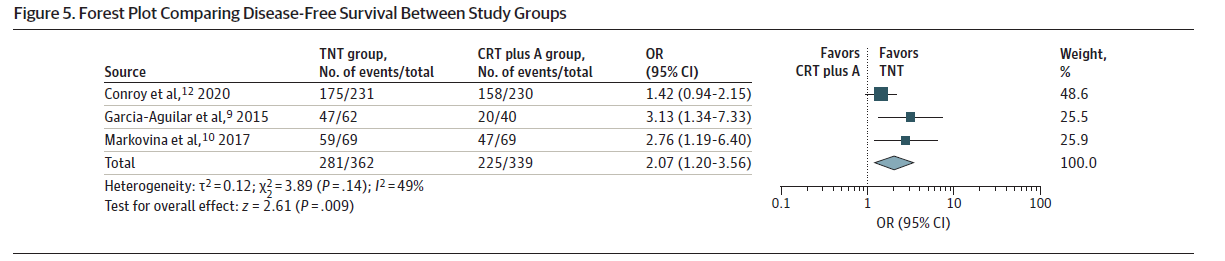
有3项研究提供了无病生存期的数据(如图5),汇总分析显示接受TNT治疗的患者无病生存期显著提高 (OR, 2.07; 95%CI, 1.20-3.56; I2=49%) 。关于总生存期的数据没有一致的报道。
图5.比较研究组之间无病生存率的森林图
结论
本系统回顾和荟萃分析的结果表明,对于局部晚期直肠癌,TNT是一种有前途的治疗策略,与标准治疗相比,pCR率更高,无病生存时间更长,然而,对疾病复发和总生存时间的长期影响则需要在未来的研究中进一步探讨。
二、全程新辅助治疗vs.标准放化疗对局部晚期直肠癌的影响:一项随机试验的系统评价和荟萃分析[2]
研究方法
通过系统搜索MEDLINE、EMBASE、Cochrane对照研究中央注册中心和会议摘要,筛选了截至2020年5月,以比较LARC患者CRT或TNT的临床研究,符合条件的研究必须满足以下所有纳入标准:(1)II-III期直肠癌;(2)II或III期RCT;(3)RCT包括:在试验组接受了TNT及对照组接受了标准CRT的直肠癌患者;(4)有完整的患者特征,研究设计和结果信息。研究选择和数据提取由两位独立的评审员按照PRISMA指南进行,Mantel-Haenzel方法用于获得主要结果的风险比。通过系统评价和荟萃分析,从病理完全缓解(pCR)率、无病生存时间和总生存时间来评价TNT vs. 标准CRT的疗效。主要终点指标:pCR率。次要终点:DFS,OS,G3–4 AE、R0切除率,TRG率。
研究结果
共筛选了8项比较TNT与标准CRT的RCT研究,共纳入2301例患者,其中1131例(49.2%)接受了标准新辅助CRT和1170例(50.8%)接受了TNT。其中4个RCT研究采用诱导CT(n = 717),4个RCT研究采用巩固CT(n = 1584)作为TNT治疗策略的一部分。在试验组中,6项(n = 874)RCT研究采用了CRT,2项(n = 1427)采用了SCRT。除一项研究采用5-FU单药治疗外,其他研究均采用联合化疗作为TNT方案的一部分,其中FOLFOX(氟尿嘧啶、亚叶酸钙和奥沙利铂)/ XELOX(卡培他滨和奥沙利铂)是最常用的治疗方案。TNT组的CT持续时间为1.5到4.5个月,五个试验报告了依从性数据,平均92%的患者完成了治疗。
所有研究均报告了pCR率,但只有4项研究提供了无病生存时间(DFS)和总体生存时间(OS)的数据。
Table 1.随机对照研究主要特征
病理完全缓解率
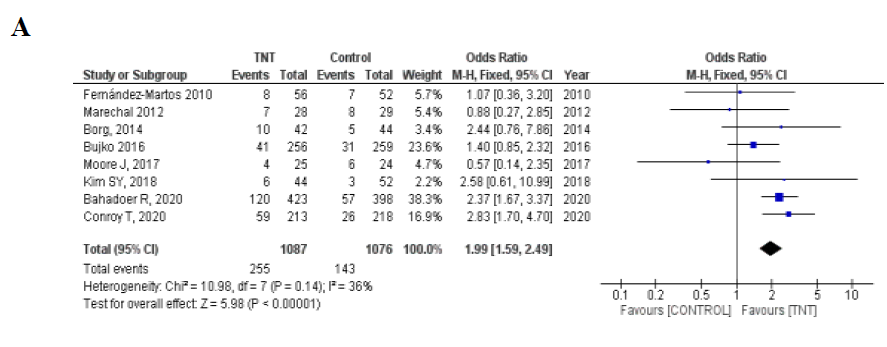
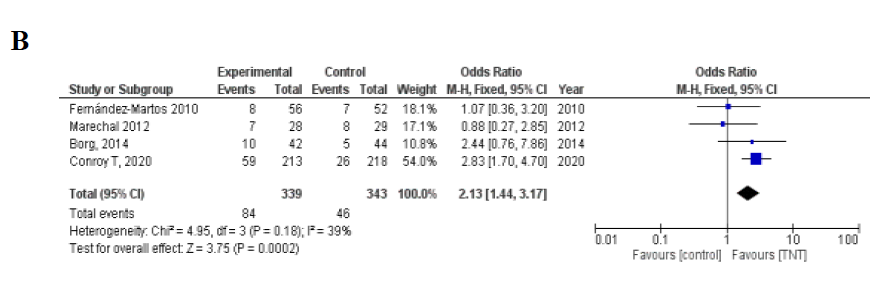
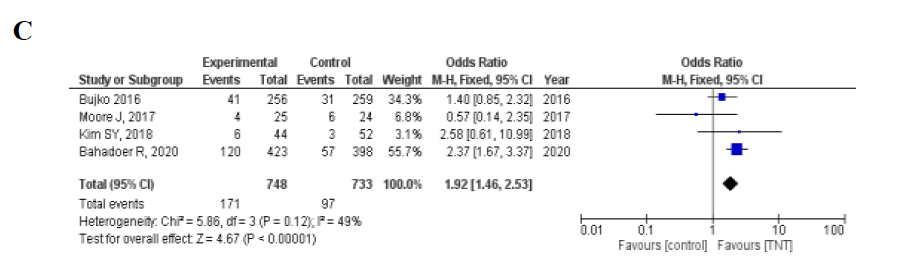
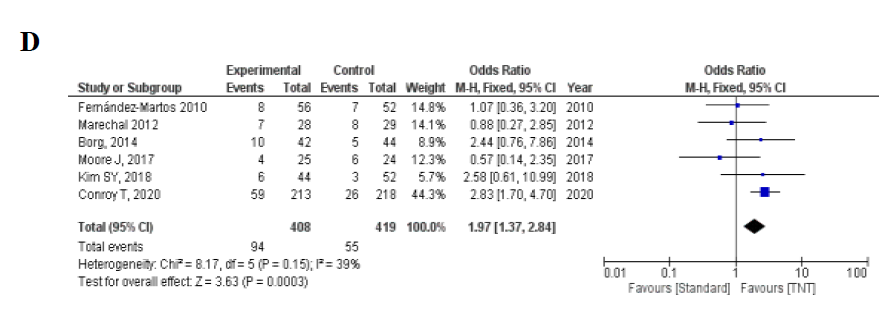
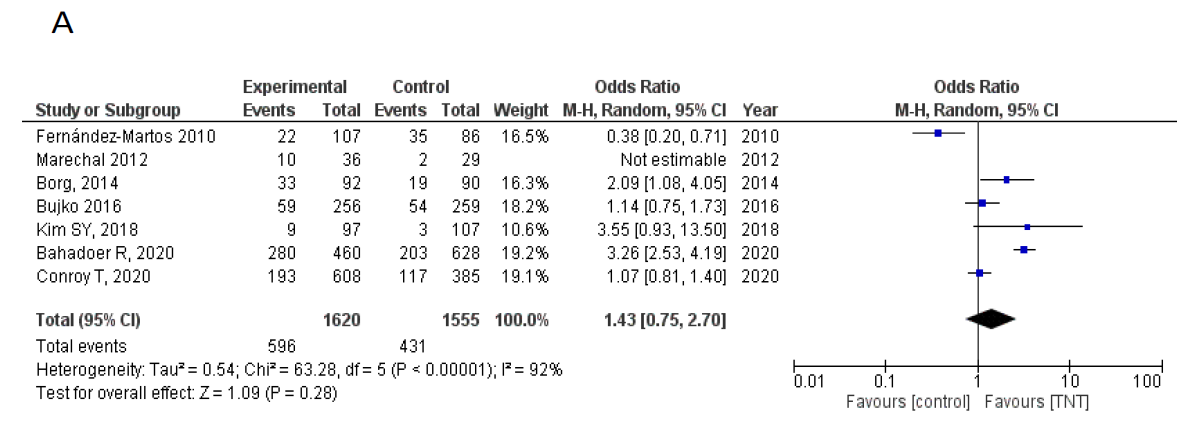
TNT组pCR率为23.5% (255/1087) ,对照组pCR率为13.3% (143/1076) ,TNT显著提高了pCR率 (OR 1.99, 95% CI 1.59-2.49; P<0.001) ,没有发现明显的异质性 (I2 = 36%,P = 0.14) (图2A) 。在采用诱导化疗的4项RCT中,TNT组pCR率为24.8% (84/339) 和对照组pCR率为13.4% (46/343) (OR 2.13, 95%CI 1.44–3.17, P <0.001; I2 = 39%, P = 0.18) 。 在采用巩固化疗的4项在RCT研究中,TNT组pCR率为22.9% (171/748) ,对照组pCR率为13.2% (97/733) (OR 1.92, 95%CI 1.46-2.53, P <0.001; I2 = 49%, P = 0.12) (图2B-C) 。
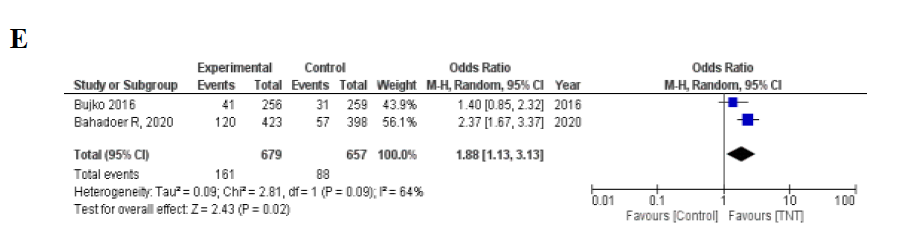
6项RCT研究中试验和对照组使用了CRT (n = 827) ,TNT组pCR率为23.0% (94/408) ,对照组pCR率为13.1% (55/419) (OR 1.97, 95%CI 1.37–2.84 , P<0.001; I2=39%, P = 0.15) 。 2项RCT在TNT组中使用SCRT ,TNT组pCR率为23.7% (161/679) ,对照组pCR率为13.4% (88/657) (OR 1.88, 95%CI 1.13-3.13, P=0.02; I2=64%, P=0.09) ,因此,无论放射治疗的类型如何(长程与短程分割计划),pCR率都有提高(图2D-E)
图2.(A)TNT vs.标准治疗的病理完全反应的森林图。(B)试验组进行诱导化疗;(C)在试验组进行巩固化疗;(D)试验组行长程化放疗;(E)试验组进行短程放疗。
DFS/OS
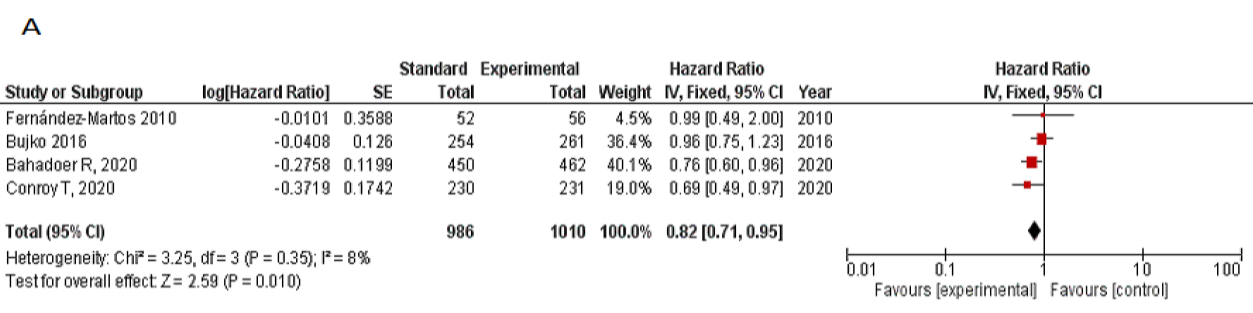
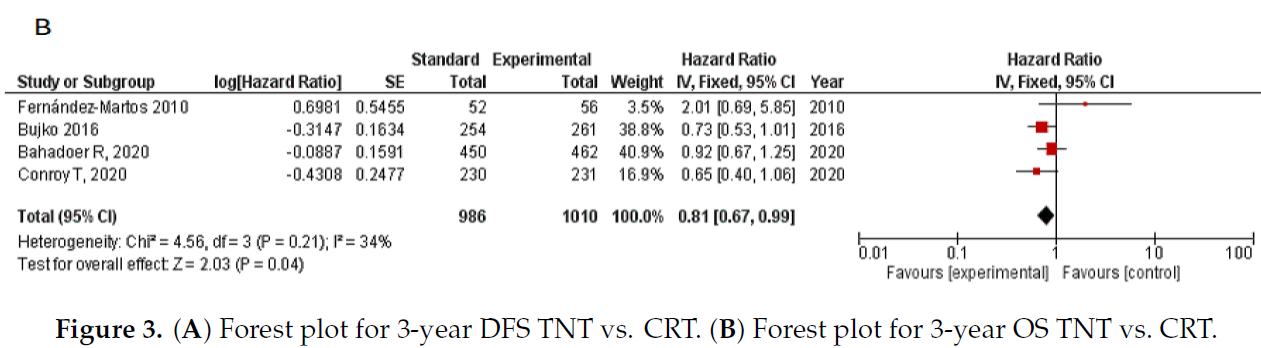
4项RCT报告了生存结果,Table 1总结了中位随访情况。DFS的荟萃分析分别包括1996例患者: TNT (n=1010) 和标准组 (n=986)。 采用固定效应模型分析了DFS的合并危险比(HR),结果显示:试验组有显著差异 (HR 0.82, 95%CI 0.71-0.95, P = 0.01),但没有显著的异质性 (I2 = 8%,P = 0.35)。 同样,在1996例患者中,固定效应模型的OS的合并HR为0.81(95%CI 0.67-0.99,P = 0.04; I2 = 34%,P = 0.21),TNT组获益显著(图3A,B)。
图3.(A)3年DFS的森林图 TNT vs.CRT(B)3年OS的森林图 TNT vs. CRT
3-4级不良反应
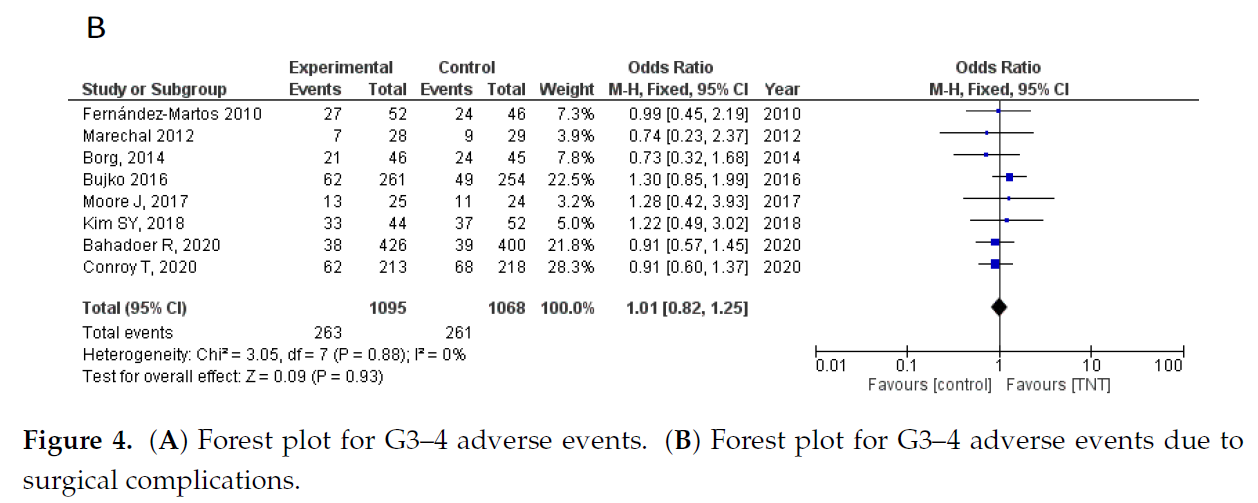
共7项 RCT提供了有关3-4级不良事件(AE)的数据。在总体G3–4 AE中,试验组和对照组之间没有发现统计学差异 (OR = 1.43, 95%CI 0.75–2.70) 。此外,还分析了手术后30天内发生的任何术后并发症的数据,没有发现统计学上的显著差异 (OR = 1.01, 95%CI 0.82–1.25) (图4A, B) 。
图4.(A)G3-4不良事件的森林图(B)因外科手术并发症引起的G3–4不良事件的森林图
结论:
荟萃分析的结果显示,与标准术前CRT相比,TNT能提高LARC患者的pCR率,DFS和OS也较对照组显著增加,而严重不良事件没有显着增加。TNT可能成为LARC的一种新的安全且更有效的治疗选择,尽管需要更长时间的随访来进一步评估其对生存的长期影响。
讨论:
在过去的几十年中,新辅助CRT,全直肠系膜切除术(TME)和术后辅助CT一直是LARC的标准治疗模式。 然而由于术后辅助CT在该策略中顺应性差,毒副作用大,治疗失败率居高不下,因此其所起的作用值得怀疑。近来,全程新辅助治疗(TNT)模式的推广应用,克服了传统方法的局限性,进一步改善了LARC患者的预后,引起了大家的广泛关注。
专家观点
以上两篇系统综述和荟萃分析,在多个关键指标中比较了TNT对比标准CRT在局晚期直肠癌中疗效。结果显示:与标准新辅助治疗相比,TNT组的pCR率相较对照组绝对值分别增加了10.2% (23.5% vs 13.3%, OR 1.99, P <0.001)和15% (29.9% vs 14.9%, OR 2.44; 95% CI, 1.99-2.98) ,尽管这些研究中高危特征(例如T4,N2或切缘阳性)的患者占了很高比例,TNT组pCR率仍分别高达23.5%和29.9%。此外,不管采用长程或短程同步放化疗,采用诱导或巩固化疗,都看到一致的效果:TNT组pCR率相较对照组更高。生存分析的结果均显示,TNT组的无病生存期较对照组更长。
TNT治疗策略带来的pCR率的增加,使越来越多的患者更倾向采取非手术的watch-and-wait的治疗策略,从而赢得保全器官的可能,这也对准确评估cCR(临床完全缓解)提出了更高的要求。watch-and-wait策略是由Habr-Gama等人提出的,他们报道在获得cCR后没有手术的患者,经过十年的观察总体生存率为97.7%,无病生存率为84%。另一项国际多中心注册研究也发现这样的治疗方式5年总生存率为94%,远处转移率为8%。在最近的一项荟萃分析中,患者在选择新辅助放化疗达到cCR后接受watch-and-wait策略,与手术切除达到pCR的患者在局部复发或与癌症相关的死亡率方面无明显差异。watch-and-wait方法被认为是可取的,因为手术可能导致直肠或膀胱失禁以及性功能障碍和短期或永久性造口。TNT策略带来的pCR率增加,不仅能够显著改善生存,而且也具有保全器官,改善患者生活质量的潜在优势。
在TNT治疗模式中,从新辅助治疗到手术的最佳时间间隔目前仍不清楚,欧美尚没有统一的标准,欧洲和美国指南尚未对新辅助治疗结束到手术间隔4-12周给出具体指导建议。既往研究表明,与新辅助治疗后2周内进行手术相比6-8周后进行手术,可进一步提高患者的pCR率。这两项荟萃分析中所有的研究均报告了手术时间间隔的数据,6-8周最常见(75%, 6/8 RCT),也有间隔时间为11-12周。因此,鉴于研究之间的一致性,新辅助治疗后最少8周的间隔疗效更佳。
与传统的术前长程放疗相比,延长短程放疗和手术之间的间隔也已显示出更大的肿瘤缩小和更高的PCR率(10.4% vs 2.2%)。具有里程碑意义的RAPIDO试验,比较了短程放疗联合新辅助CAPOX(卡培他滨和奥沙利铂)或FOLFOX化疗,短程放疗结束6个月后进行全直肠系膜切除术与传统模式相比,短程放疗组pCR率翻了一倍(28% vs 14%;P <0.001),3年(远处无转移生存率提高了7%(26.8% vs 20%;P = 0.005),毒副作用相当,并且手术或术后并发症未增加,两组3年总生存率相似均为89%。在排除了时间间隔因素之后,短程放疗也已被证明与术前常规长程CRT相比具有相似的总体生存率,局部复发率或毒性作用。此外,短程放疗放射剂量更小,患者更容易接受。
TNT模式有两种,新辅助CRT之前进行诱导化疗,或新辅助CRT之后以巩固化疗的方式治疗。OPRA研究结果显示,与诱导性TNT组相比,巩固性TNT组的器官保留率更高,但在3年无病或远处转移方面无显著差异。
研究发现,在TNT组和标准CRT治疗组中没有观察到3–4级AE的显著差异,也没有观察到手术后死亡率差异,且与辅助化疗相比,TNT模式的患者依从性更高。在PRODIGE 23研究和RAPIDO研究中,TNT组分别有11.7%和4%的患者出现3级周围神经病变。虽然在RAPIDO研究发现TNT队列中3至4级腹泻的发生率更高(18% vs 7%)。但是,在PRODIGE 23研究中发现,6个月后标准CRT组的3至4级所有毒性反应均显著增加,例如中性粒细胞减少症,血小板减少症,淋巴细胞减少症,疲劳,腹泻,厌食症,体重减轻和周围神经病变,因此,对于相同的化疗持续时间,术前治疗比术后辅助治疗耐受性更好。
目前,免疫检查点抑制剂 (如pembrolizumab, durvalumab, avelumab, nivolumab) 及其他新型药物(如DNA蛋白激酶抑制剂peposertib,血管生成抑制剂aflibercept及veliparib)也开展了多项在全程新辅助治疗中的探索,期待未来能够给TNT治疗模式带来新的惊喜。
综上所述,全程新辅助治疗模式能够给LARC患者带来更高的pCR率,更长的无病生存期,此外能够更好保护器官功能和改善患者的生活质量,值得在临床中大力推广,造福更多的局晚期直肠癌患者。
审批号:MI-PD1-1713-CN
本资讯由默沙东医学团队提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
转载来自医默相通
查看更多