查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





远隔效应(AE)指的是肿瘤放疗时,未接受放射治疗的远处肿瘤出现缩小或消失的现象。远隔效应因其能够延展放疗作用至远端转移病灶,成为近年来肿瘤治疗领域的研究热点。随着免疫治疗的迅速发展,放疗与免疫治疗联合使用增加了远隔效应的发生率。然而,远隔效应的临床表现依然罕见且难以预测。
现总结分享复旦大学附属中山医院放疗科团队诊治的一例肝癌肺转移放疗后发生的远隔效应案例,与各位同道交流学习。
作者丨复旦大学附属中山医院 孙太伟 杜世锁
患者,男性,67岁,2017年8月患者因“腹胀不适3月”就诊当地医院,2017.08.26外院行胸部CT检查示:1、肝右后叶低密度肿块,考虑巨块型肝癌伴肝内转移;2、肝右静脉内低密度影,考虑癌栓形成可能。遂来我院(复旦大学附属中山医院)就诊。
2017.08.29行上腹部MRI检查:肝右叶MT伴瘤内出血,门脉右支受侵犯,下腔静脉及肝右静脉栓子形成。同日肝脾及门脉超声:肝右叶实质占位伴周五多发子灶形成。AFP:426 ng/ml。
图1. 2017-08-29上腹部MRI增强。
2017.09.06行“肝右叶切除+胆囊切除+下腔静脉取栓”。术后病理:HCC. 术后AFP:31.4 ng/ml。
2017.10.10行辅助TACE治疗1次,后定期随访。
2018.08.21在瑞金医院行胸部CT检查:双肺多发结节影,考虑肺部多发转移。腹部MR检查:肝脏未见复发病灶。AFP:213 ng/ml。未予以特殊治疗。
2018年12月出现咯血症状,2018.12.05继续在瑞金医院行胸部CT检查:双肺多发结节,较前增大;纵隔多发淋巴结肿大,考虑转移。AFP:385 ng/ml。
2019.12.08行E-bus穿刺,病理:结合病史,考虑转移性HCC。
2019.01.05来我科(复旦大学附属中山医院放疗科)就诊,考虑纵隔转移淋巴结肿大,压迫气管及支气管,拟予以纵隔肺门淋巴结姑息放疗;肺部转移病灶较多,且分散,暂不处理。
对纵隔转移淋巴结瘤,2019-01-15开始继续予以姑息照射:DT=5000 cGy/25 Fx,继观病情;
图2 纵隔转移淋巴结放疗剂量分布图
5 Fx后(至2019-19,累计10 Gy)因个人原因暂中止治疗(外院消化道出血,住院止血处理);
2019年4月再来我科就诊,拟继续放疗。2018年4月28日复查胸部CT:双肺多发结节较前明显缩小、消失;纵隔未见肿大淋巴结。AFP:51.3 ng/ml。
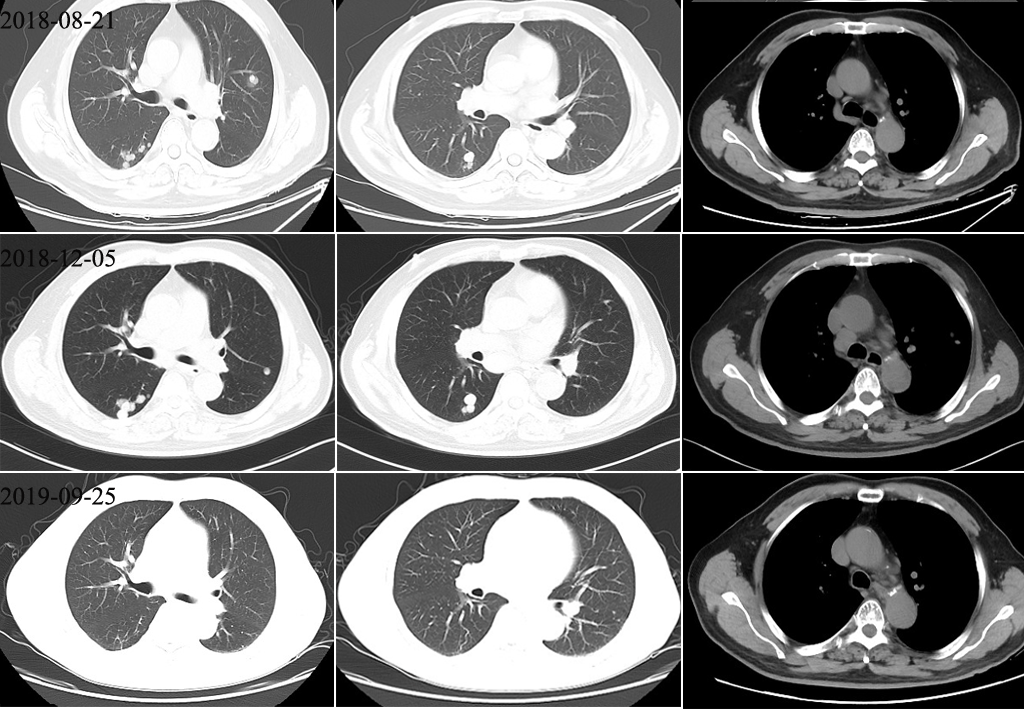
图4.放疗后随访AFP的变化趋势
2022年1月,本院及外院随访,无特殊。
2022-02-23胸部CT检查:左肺上叶(2个)、左肺下叶、右肺上叶、右肺下叶多发转移灶;大者位于左肺上叶前段。
2022-02-23行CT引导下肺穿刺,病理:转移性肝细胞癌,免疫组织化学PDL1(-)。
图5.左上肺前段转移灶穿刺
考虑患者前次发生远隔效应的可能性较大,与家属充分商讨后,决定针对左上肺较大病灶行SBRT放疗,剩余肺部其他较小病灶予以观察;
2022-03-17至2022-03-24行左上肺病灶SBRT:5400 cGy/6 Fx。
图6.左上肺病灶靶区及剂量曲线分布图
2022-07-19胸部CT复查:左上肺病灶基本毁损,余病灶未再显示。
图7.左上肺病灶放疗前后变化(2022-02-23 VS 2022-07-19)
图8.双肺剩余病灶(未行放疗)基本不再显示(2022-02-23 VS 2022-07-19)
截至2023年11月,本院随访,肝肿瘤无殊。 期间2023-04-19因“腹主动脉瘤”行覆膜支架植入。2023-12-26行上腹部MRI增强:左外叶复发活性病灶,右侧肾上腺转移。
图9.患者右侧肾上腺及肝左外叶转移
2024-01-03因右侧肾上腺、肝左外叶转移,再次行切除术,术后病理:转移性HCC PDL1(-).
远隔效应指的是肿瘤放疗时,未接受放射治疗的远处肿瘤出现缩小或消失的现象。AE因其能够延展放疗作用至远端转移病灶,成为近年来肿瘤治疗领域的研究热点。随着免疫治疗的迅速发展,放疗与免疫治疗联合使用增加了AE的发生率。然而,AE的临床表现依然罕见且难以预测。根据现有文献报道,其可能存在的机制有以下几种:
(1)免疫原性细胞死亡。放疗通过诱导肿瘤细胞发生免疫原性细胞死亡(ICD),这是AE的核心机制之一。ICD是指肿瘤细胞在放疗等损伤下,通过一种特殊的方式死亡,释放出一系列损伤相关分子模式(DAMPs)。这些DAMPs具有强大的免疫刺激功能,能够激活先天和适应性免疫反应。
(2)肿瘤微环境的变化肿瘤相关巨噬细胞(TAM)在放疗作用下由M2型(促肿瘤)转化为M1型(抗肿瘤)。M1型巨噬细胞释放促炎细胞因子,激活更多免疫细胞,同时减少免疫抑制细胞(如Tregs和MDSC),从而增强全身抗肿瘤反应。
(3)肿瘤引流淋巴结(TDLN)高剂量放疗作用于肿瘤引流淋巴结(TDLN),重新激活抗肿瘤免疫反应。放疗能清除免疫抑制细胞,激活新的免疫细胞进入肿瘤区域,增强全身免疫监视,促进AE的发生。
(4)p53与外泌体的作用高剂量放疗通过p53介导肿瘤细胞的凋亡或衰老。外泌体则作为信号传递工具,将免疫激活分子从受照射肿瘤传递到远端,进一步增强免疫反应。

回顾该病例的整个诊疗过程,患者首次放疗后近3年的无进展生存期,第二次放疗后近2年无进展生存期期,进一步证实了免疫治疗的“拖尾效应”,鉴于其明显的拖尾效应及潜在的治愈价值,由以下几点问题值得我们深思:
首先是后续右侧肾上腺及肝脏左外叶手术的必要性? 其实,虽然右侧肾上腺肿块较大,但由于周边无特殊危机器官,放疗仍然具有较大可行性。由于患者前后2次发生了放疗后的远隔效应,再次发生远隔效应可能性仍然较大,此时既可以避免手术带来的巨大创伤,又能通过拖尾效应实现对其他亚临床病灶的持续压制。
其次,以往的文献多倾向于大分割放疗和远隔效应的关系,但该患者首次治疗采用常规分割,前后总剂量仅10Gy,但仍然意外地产生了远隔效应,低剂量免疫调节效应或许可以解释此现象,即通过给予肿瘤或整个机体极低剂量的辐射,一般低于5 Gy(0.5-5 Gy)的低剂量放疗,可重塑肿瘤微环境,增强免疫细胞浸润,并降低免疫抑制细胞比例,使免疫学上“冷”的耐药肿瘤对免疫疗法敏感。
最后,临床研究显示当放射治疗与免疫检查点抑制剂(如PD-1/PD-L1抗体)结合时,远隔效应更为明显。多项临床试验正在评估放疗与免疫治疗结合的疗效,包括在非小细胞肺癌、黑色素瘤、头颈部鳞状细胞癌等不同类型癌症中的应用。但该例患者,穿刺及手术病理显示PDL1表达阴性,难以解释免疫疗法和TPS的关系,或许可以解释临床实践中,某些PDL1表达阴性者,亦能从免疫治疗中获益的现象。
整理丨中国医学论坛报 胡岳
肿瘤疾病复杂多变,每一个宝贵的临床病例都凝结着医生的智慧,也承载着患者的希望。然而,单一的诊疗思路往往难以应对所有的临床问题,正如《诗经》有云,“他山之石可以攻玉”,借鉴与学习,正是我们不断前行的重要动力。因此,我们特设立“他山之石”专栏,旨在打造一个肿瘤学科病例讨论与分享的平台。
在这里,我们将精选有代表性的肿瘤病例,展示诊治过程中的思路与方法。希望能够给临床医生提供丰富的病例资源,拓宽诊疗视野,期待每一位读者都能从中汲取智慧,将“他山之石”转化为自己手中的“攻玉之器”,共同为肿瘤患者的健康与福祉贡献力量。
本专栏也将持续面向广大临床肿瘤医生征集病例,欢迎投稿至邮箱:huyue@cmt.com.cn,期待您的加入!
查看更多