查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





在上期一文说清人类肿瘤微环境(上)中,我们已经对肿瘤免疫学及癌症的发展进行了简要介绍,并对肿瘤微环境中的各种成分(如肿瘤相关巨噬细胞、NK细胞、树突状细胞、三级淋巴结构、T细胞、B细胞等)进行了描述。
那么,肿瘤微环境中的这些成分对患者的临床预后还有一些疗法的效果有着什么样的意义呢?这将是本期的重点内容。
2.4 肿瘤微环境(TME)影响患者的临床预后
免疫浸润的量化及其与预后的关系已经有20多年的研究历史。在观察到卵巢癌中T细胞密度较高与较长的生存期相关后,Galon、Pagès和Fridman首次在大肠癌(CRC)患者的大队列研究中证明了记忆T细胞密度与早期转移和患者生存之间的关系,在这一领域取得了重大突破。从那时起,免疫组化 (IHC)、高通量自动定量成像技术的发展,使得对TME 免疫细胞组成的研究大大增多。随着逆转T细胞衰竭的免疫检查点抑制疗法(CBT)的出现,全球许多团队开始研究TME中的T细胞丰度及其与CBT的结果和/或反应之间的联系。
2.4.1 T细胞
2.4.1.1 CD8+ T细胞
TME内的T细胞丰度已经在大多数肿瘤类型中被广泛研究。2012年,本书编者发表了一篇关于免疫细胞群肿瘤浸润和预后的综述。我们报道了CD3+ T细胞,CD8+细胞毒性T细胞和CD45RO+记忆T细胞的高密度与大多数肿瘤(包括黑色素瘤、头颈部、乳腺、膀胱、尿路上皮、卵巢、结直肠癌和肺癌)更长的无病生存期(DFS)和/或总生存(OS)期相关,而肾透明细胞癌(ccRCC)是少见的例外之一。我们去年更新了这些数据并发现了类似的结果。此外,我们报道了新的肿瘤类型,如胃肠道间质瘤、甲状腺癌或口咽癌,其中,CD8+ 细胞浸润与良好预后相关。
我们证实了ccRCC中 CD8+ T 细胞的不良预后相关性,无论是在肾原发性肿瘤还是在ccRCC肺转移中都是如此。除了ccRCC,在肺腺癌和HCC的研究中也报道了与CD8+ T细胞浸润增加相关的不良预后,这与其他已发表的研究相矛盾。同样在前列腺癌中,CD8+ T细胞密度与预后不良相关,与我们自己的数据一致。
CRC的“经典”案例
结直肠癌是肿瘤中高CD8+ T细胞密度与良好的预后相关的类型。事实上,CD8+ T细胞的高浸润,尤其是效应记忆亚型 (TEM),与低转移扩散和PFS期 、 OS期的延长有关,表明T细胞可以控制原发性肿瘤的局部侵袭并提供长期的全身保护以防止转移。
此外,IHC研究表明T细胞在肿瘤中心和浸润边缘的区域化是重要的。Jerome Galon的团队开发的免疫评分 (IS) 方法在全球约4000例CRC患者中测量了中心以及肿瘤的侵袭性边缘的CD3+ 和 CD8+ T 细胞的密度。结果显示即使在一些高T细胞密度的较小肿瘤和MSI-阳性肿瘤中,IS也是独立于TNM分期和MSI状态的预后因素。此外,IS对早期结直肠癌患者的预后预测更为准确。
ccRCC的“特殊”案例
我们最近报道了ccRCC中CD8+ T 细胞浸润与预后之间存在明显的负相关。在一组135例原发性RCC肿瘤患者中,根据 IHC评估,我们发现高CD8+细胞密度与DFS期和OS期相关。
这些结果在 51 例(切除的)ccRCC 肺转移患者的独立队列中得到了验证。高密度CD8+ T细胞出现这种不良预后的潜在机制尚不完全清楚,不过我们发现大多数瘤内T细胞表型为衰竭表型,这反映了可能由于存在表型不成熟的功能失调性树突状细胞从而导致抗原递呈受损(Fig 2.2Ad)。
这些功能失调性树突状细胞表达成熟 DC 的 DC-Lamp 标志物,但缺乏成熟DC表达的高水平MHC II类分子和 CD83,它们可能与T细胞抗肿瘤反应受损有关。同样地,三级淋巴结构(TLS)内DC密度较高的患者中,高密度的 CD8+ T与良好的预后相关。
因此,根据我们之前在肺癌中的观察,TLS中成熟DC的抗原呈递似乎是驱动 ccRCC抗肿瘤反应的关键。此外,我们通过免疫荧光 (IF) 显示CD8+ T细胞表达免疫调节受体,如PD-1 和/或 LAG-3,表明这是高度衰竭的表型,并且两者都与不良预后相关。
2.4.1.2 CD4+ T ,TH2和TH17
与CD8+T 细胞浸润一样,Th1 型的CD4+T细胞浸润增加与几乎所有研究的肿瘤类型(包括乳腺癌或 CRC)的良好预后相关。其他 T 细胞亚群(Th2、Th17)的预后价值研究较少,首先是因为在大多数肿瘤中出现频率较低,其次是专门识别这些亚群存在技术难度。
2.4.1.3 调节性T细胞(Tregs)
Tregs 的例子很有说服力。高Treg密度首先被证实与卵巢癌的不良预后相关,随后在多种肿瘤中得到证实,如乳腺癌、肺癌、黑色素瘤或结直肠癌。然而,其他研究报告称在结直肠癌、膀胱癌、头颈癌或卵巢癌中,高密度Treg与较长的OS期相关。产生这些相反结果的原因之一是很难确定Treg亚群。
Treg 是一个异质性较高的群体,理想情况下应该通过多种标志物(CD4+、CD25+、Foxp3+、T 细胞)来联合识别。多色荧光成像技术的发展使得可检测到的细胞表面标记物数量显著增加。除了技术挑战,这些结果显示免疫细胞群对预后的影响取决于肿瘤类型和TME状态。
2.4.2 B细胞
B细胞在抗肿瘤免疫中的积极或消极作用已经讨论了很多年,主要以小鼠研究为基础。与 T 细胞相比,很少有临床研究报道肿瘤内 B 细胞的预后作用。大多数临床研究表明,TME内高密度的 B 细胞与更好的预后相关,包括乳腺癌、NSCLC、头颈癌、卵巢癌、转移性结直肠癌、胆道癌和原发性皮肤黑色素瘤。
几种非排他性机制可以解释 B 细胞在抗肿瘤免疫反应中的积极作用,有些是抗体依赖性的,因为它们能够触发补体和抗体依赖性细胞毒性作用(CDC 和 ADCC),或者形成免疫复合物激活抗原提呈细胞,进而激活CD4和CD8+ T 细胞反应。
事实上,已有研究表明B细胞在CD4+ T 细胞的初始启动和扩增过程中发挥重要作用,还有报道显示它能够将抗原交叉呈递给CD8+ T 细胞,并且可以促进细胞毒性 T 淋巴细胞的存活和增殖。
相反,很少有临床研究报告B细胞在TME中的促肿瘤作用。它可能通过维持慢性炎症、促进新血管生成和/或直接抑制细胞毒性T细胞反应来发挥促肿瘤作用。
此外,已经发现了一种称为“Bregs”的免疫调节B细胞亚群,该亚群已被证明有利于Tregs的分化和招募,从而放大免疫抑制环境。
除了 B 细胞的密度之外,越来越多的研究报告称,这些细胞的空间定位对患者的预后有影响。特别是 TLS 特有的滤泡型B细胞密度与预后呈正相关。M.C.Dieu-Nojean和col的研究表明 TLS 内 B 细胞密度的增加与非小细胞肺癌(NSCLC) 患者的生存期延长有关,在CRC和口腔鳞癌中也有类似的报道。
2.4.3 巨噬细胞
肿瘤相关巨噬细胞 (TAM) 是 TME 的主要组成部分,存在于肿瘤核心和浸润边缘。TAM 的预后价值似乎取决于肿瘤类型。TAM 密度的增加与结直肠癌、肝癌、前列腺癌和宫颈癌的良好预后相关。相反,在子宫内膜、胃、尿路上皮、肝癌、黑色素瘤、乳腺、卵巢、膀胱、非小细胞肺癌和原发性CRC中,TAM密度增加与预后不良有关。
这些差异可以用这些细胞的可塑性来解释,因为我们知道TAM有两个亚型,它们可以从促肿瘤功能 (M2) 转换为抗肿瘤功能 (M1),反之亦然。M2 TAMs 的生存期较短,而 M1 TAMs 的生存期较长。不幸的是,没有特定的或一致同意的标志物来定义 M1/M2 TAMs。大多数研究使用CD11c或NOS2标记M1 TAMs,使用CD163、CD204或CD206标记M2 TAMs,但这些标志物的使用仍存在争议。
肿瘤包含另一种不同的骨髓来源的细胞亚群,骨髓来源抑制性细胞(MDSC)。这种细胞具有不成熟的表型并具有较强的免疫抑制活性。在人类TME中仍然需要特定的强大的工具来识别它们。
2.4.4 评估肿瘤免疫细胞浸润的新技术
定量肿瘤浸润免疫细胞最常用的方法是通过IHC或IF检测特异性标志蛋白的表达。这些技术在过去十年中得到了改进,已经可以检测多种蛋白质(多重 IHC 或 IF)并自动量化细胞。然而,它们仍然昂贵且难以实现实验室标准化,并且可用的抗体可能缺乏准确检测某些免疫细胞群的敏感性或特异性。
人们已经努力使用转录组来评估 TME 的组成。然而,直到最近,信号的可变性限制了它的适用性。
CIBERSORT或MCP-counter等新方法旨在提供非常精确的非均质样品中细胞含量的定量信息。使用 MCP-counter,我们评估了25种不同癌症(n = 19,000)的转录组数据中免疫细胞、成纤维细胞和内皮细胞浸润的丰度。结果显示了不同癌症中肿瘤微环境细胞组成的相对异质性,并证实 CD8+或细胞毒性 T 细胞的密度与大多数癌症类型的良好预后相关(Fig2.3)。
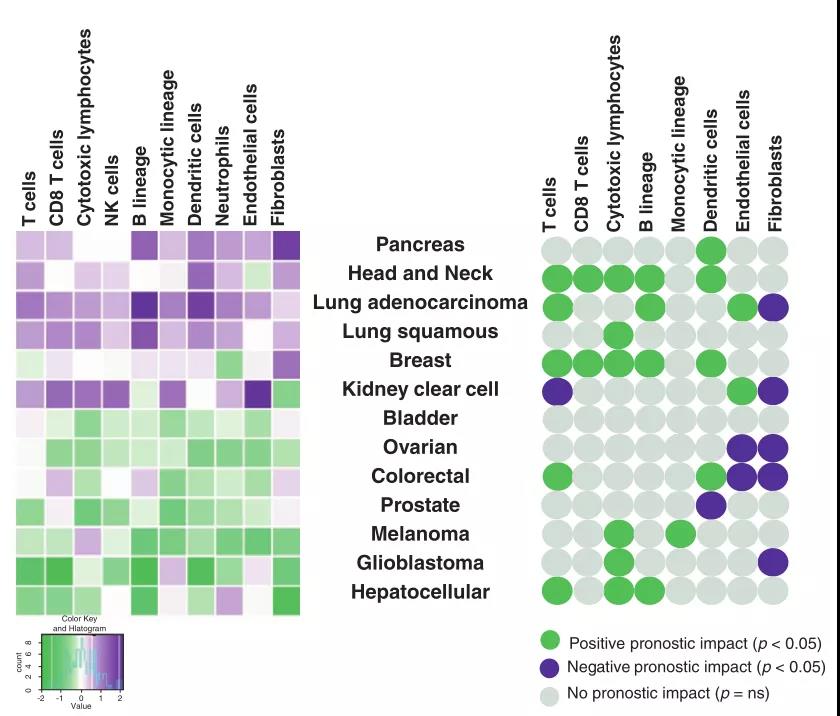
Fig 2.3 人类实体肿瘤中浸润性免疫细胞和基质细胞的丰度及其预后意义的评估。左:在三个转录组平台上,恶性组织(超过19,000个肿瘤)的MCP-counter评估。右:与人实体肿瘤MCP-counter评分相关的单变量预后值(总生存期)。绿色代表显著的预后良好影响,紫色代表显著的预后不良影响。灰色表示没有显著的预后影响。
2.5 TME作为治疗应答反应的预测因子
在靶向肿瘤细胞及其分子改变几十年后,新的肿瘤免疫(IO)药物如 CBT 揭示了 TME 的关键作用。目前批准的 CBT 靶点是 CTLA-4 (伊匹木单抗) 或 PD-1 / PD-L1 (纳武利尤单、帕博利珠单抗、阿替利珠单抗、avelumab)。这些 mAb可 阻断 T 细胞与 APC 或肿瘤细胞相互作用后接收到的负信号,从而逆转 T 细胞的衰竭。
由于这些试剂的主要目标是肿瘤浸润性T细胞,因此预测CBT疗效的研究一直集中在治疗前和/或治疗期间的T细胞密度、定位、表型和功能等方面的特征。
其他众所周知的和有争议的候选药物仍被作为“疗效的生物标志物”进行研究,如免疫球蛋白表达PD-L1或新抗原/突变负荷,但不在本章的介绍范围内。
2.5.1 来自检查点阻断治疗患者的新数据
2.5.1.1 肿瘤浸润性淋巴细胞
随着接受抗 PD-1/PD-L1 治疗的患者数量不断增加,有关这些疗法对 TME 的药效学影响的转化数据正在不断出现。Tumeh等人报道,在黑色素瘤患者中,帕博利珠单抗应答患者的CD8 TILs(肿瘤浸润性CD8+T淋巴细胞)基线密度水平更高。与伊匹木单抗一样,治疗中的连续活检显示应答组中 CD8+ TIL的密度增加。
在另一项探索性研究中,53 例黑色素瘤患者在治疗前和治疗时进行了连续活检,这些患者首先接受伊匹木单抗(抗CTLA-4)治疗,然后接受抗 PD-1(帕博利珠单抗)治疗。TME 的 IHC 分析显示,治疗早期 CD8+ TIL 密度的增加与对 伊匹木单抗 的反应有关,而 TIL基线密度则与之无关。在46例伊匹木单抗治疗进展后接受抗 PD-1 治疗的患者中,有应答者与无应答者预处理样本中CD8+、CD3+、CD45RO+ T细胞密度差异有统计学意义。
此外,在早期治疗肿瘤样本中观察到 T 细胞亚群标志物CD8、CD4 和 CD3,以及免疫调节分子 PD-1 和 LAG3 表达具有非常显著的统计学差异。总之,这些结果表明了 CBT 对 T 细胞反应的影响。此外,作者报道了在治疗早期活检样本中,有应答者与无应答者相比,肿瘤中心(TC)的CD8+ TIL相对于侵袭边缘(invasive margin,IM)的比例增加,表明治疗后从IM到TC的TIL浸润。最后,通过基因表达分析证实了 IHC 的结果。
另一组研究对 40例接受抗 PD-1 治疗的转移性黑色素瘤患者(发现队列和验证各 20 例患者)的 TIL(流式细胞术)进行了表型分析。在多变量分析中,TIL 的 CTLA4 表达是唯一与临床反应显著相关的参数。有效率 (RR) 和 PFS期与 CTLA-4hiPD-1hi CD8+ TIL 的相对丰度显著相关。
在一项针对接受阿替利珠单抗(抗 PD-L1)治疗的患者的多队列 I 期研究中,IHC 结果显示 CD8 的密度和高 Teff 特征(受干扰素γ(IFNg)调节的基因,包括 IFNg、CD8A、颗粒酶 A、颗粒酶 B、EOMES 和穿孔素)与黑色素瘤的反应相关,但在 RCC 中未观察到与好的临床疗效相关。然而,基因表达所揭示的较高的 Teff 与 Treg 比率与 RCC 中的阿替利珠单抗反应相关。
最近报道了一项转化研究,该研究旨在研究在mRCC中VEGF阻断剂贝伐珠单抗如何增强阿替利珠单抗 PD-L1 检查点抑制疗法。作者表明,单独使用贝伐珠单抗倾向于增加与 T-helper 1 (Th1) 趋化因子和 CD8 T 效应子相关的基因特征,而与 阿替利珠单抗的组合进一步增加了这些特征的表达。
IHC 显示出类似的结果,贝伐珠单抗治疗后 CD8+ 密度增加,这在组合中更为明显。有趣的是,CD8+ TIL 密度的增加似乎反映了向肿瘤转移概率的增加,而不是原位增殖概率的增加(CD8+ TIL 中 Ki67+/Ki67- 的比率不变)。
2.5.2 从分子到免疫特征
免疫逃逸是对许多全身疗法(包括抗血管生成药物等靶向疗法)产生耐药性的重要机制。事实上,免疫逃逸是 ccRCC 中 VEGFR-TKI 耐药的主要机制之一 。最近有报道称,使用转录组学分析,舒尼替尼(VEGFR-TKI) 治疗的转移性 ccRCC 可分为四个不同的分子分型(ccrcc1 至 4)。四组患者预后明显不同,ccrrcc1 和 ccrrcc 4 的存活率最低,对舒尼替尼的反应最差。有趣的是,我们发现免疫细胞浸润在四组分型的患者中有明显差异。
例如,ccrcc4 肿瘤的 T 细胞浸润程度最高,免疫抑制标志物如 PD-L1、PD-1、LAG-3、TIM-3 的表达最高,表明这些肿瘤中的 T 细胞已耗竭。相反,同样与不良预后相关的 ccrcc1 肿瘤具有最差的 T 细胞浸润和低表达的 T 细胞受体标志物。
由于 CD8+ 浸润肿瘤的密度与 CBT 疗效相关,我们提出了 ccrcc4 可以对 PD-1/PD-L1 阻断产生反应的假设。相比之下,由于肿瘤中缺乏 CD8 T 细胞,单独使用抗 PD-1/PD-L1 可能无法完全有效地治疗 ccrcc1。另一种能够吸引肿瘤中 T 细胞的疗法,例如血管生成抑制剂(VEGFR-TKI 或抗 VEGF mAb)或 CTLA4 阻断剂,可以使肿瘤对抗 PD-1/PD-L1 疗法敏感。
因此,我们提出分子和免疫信号特征的组合可能比单独的信号能够更好地预测 CBT 疗效。Fig2.4显示了如何在 ccRCC 中结合多种生物标志物来帮助患者做出更好地选择。
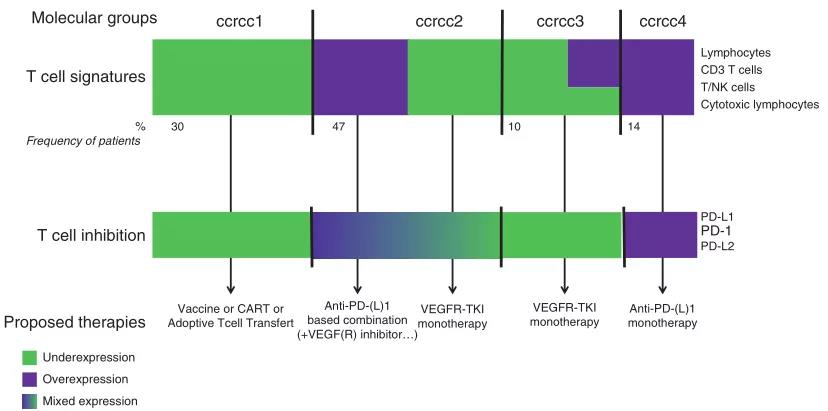
Fig 2.4 生物标志物驱动治疗的整合视图:ccRCC的示例。根据Beuselinck等人的分子组分类器,确定了四组(ccrcc1至4)对Sunitinib有明显反应的患者,其中ccrcc3的反应最好。ccrcc分子型具有不同的基因表达免疫谱:免疫荒漠型(ccrcc1),免疫活性型(ccrcc3),免疫高型 (ccrcc4)和混合型(ccrcc2)肿瘤。免疫组化检测CD8+ T细胞浸润证实了这四种表型。基于免疫调节检查点及其配体的基因表达的T细胞抑制信号细化了四种免疫表型,并提供了额外的信息来帮助患者进行治疗选择。ccrcc1肿瘤是免疫荒漠,患者可能受益于基于T细胞吸引剂的治疗,如疫苗或CAR-T细胞或过继T细胞转移;ccrcc4肿瘤免疫功能高,T细胞密度高,免疫调节检查点高表达; 单纯抗pd -(L)1可使ccrcc4患者获益。ccrcc3肿瘤具有免疫活性,T细胞大量浸润,但免疫调节检查点低表达; 仅VEGFR-TKI在这一ccrcc3组患者中显示出良好的结果。在T细胞浸润和免疫调节检查点表达方面,ccrcc2肿瘤是混合的; ccrcc2患者可根据T细胞浸润和免疫调节检查点的表达情况进行治疗
为了证实这些假设,我们于2017年3月启动了迄今为止第一个生物标志物驱动的ccRCC试验,称为BIONIKK(生物标志物驱动的试验,在naïve转移性肾癌中使用Nivolumab和Ipilimumab或Vegfr TKI,NCT02960906进行治疗)。该试验中mRCC患者随机接受nivolumab(抗PD -1)、ipilimumab(抗CTLA-4)、联合或TKI(根据其分子亚组)的一线全身治疗。主要终点是根据治疗和分子组的客观反应率。使用IHC和基因表达分析(MCP-COUNTION)评估免疫浸润及其与结果和分子分型的相关性。
结论
肿瘤细胞与宿主之间的复杂相互作用确定了免疫环境的概念,其中包括 TME 中免疫细胞的组织、位置、密度和功能。这种免疫环境有助于了解支持各种免疫反应细胞的临床影响的病理生理机制。
在多种肿瘤类型中靶向PD-1/PD-L1 的CBT的批准率不断上升,使得世界各地的研究团队深入探索免疫环境,从而更好地优化这些制剂的功效。此外,目前在临床试验评估中的体内注射药物数量庞大,使得相关公司之间竞争非常激烈,这反过来迫使他们理解筛选患者的重要性,并作出财政努力来支持转化研究。
目前已经做了很多努力来寻找一种方法来筛选可从 CBT 中持久获益的患者。肿瘤浸润免疫细胞的表征可能是最有希望的有效生物标志物之一。技术方面的挑战是这些有前途的生物标志物不可重复或难以评估的原因,这些挑战之一是 IHC 或 IF 技术所固有的。即使在该领域取得了重大进展,我们也必须处理肿瘤内异质性和缺乏特定标记物的问题,并解决动态过程的评估问题。前两点可以通过转录组分析方面的进展部分解决,特别是在最近开发的免疫表征方法例如在 MCP-counter 中。
MCP-counter 在定义免疫细胞的比例方面具有很高的准确性,可重复性好,对肿瘤异质性的依赖性较小,并最终允许在肿瘤类型之间进行比较。使用 NGS测序、RNA 测序,多重 IF 对免疫 TME 的表征以及恶性细胞的深度表征,使得将最合适的精准药物用来治疗患者并密切监测 CBT 期间的动态变化成为可能。
OncoLab 平台发布
查看更多