查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





当地时间9月27日,2019欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那拉开帷幕。今年大会的主题为“将科学研究转化为对癌症患者更好的治疗(translating science into better cancer patient care)”,强调肿瘤领域研究的核心价值在于其转化为治疗手段的潜力。本报特邀中山大学肿瘤防治中心陈功教授,解读本届ESMO年会结直肠癌领域新进展。

陈功教授
2019年ESMO年会结直肠癌口头报告解读
2019年ESMO年会正在于2019年9月27至9月30日在西班牙巴塞罗那召开,本次大会展示的结直肠癌领域研究成果乏善可陈,算是近5年来最少的“小小年”,尽管收到了1300余份摘要投稿,但最终被遴选为最重要环节-口头报告的仅有4篇摘要,在ESMO大会持续大放异彩的免疫治疗,今年在肠癌领域颗粒无收,毫无进展。管中窥豹,也足以洞悉目前结直肠癌整体研究面临的尴尬局面与困境。
9月28日下午刚刚结束的口头报告专场,详细信息如下,我将这四个研究的主要信息及个人见解给大家做一个汇报。
结直肠癌口头报道专场(Proffered Paper )
- 时间:2019-9-28,14:45-16:15
- 地点:Barcelona Auditorium (Hall 2)
- 内容
研究一:LBA30_PR-法国IDEA研究中ctDNA对结肠癌辅助化疗时程的预后和预测价值(Analysis of circulating tumour DNA (ctDNA) from patients enrolled in the IDEA-FRANCE phase III trial: Prognostic and predictive value for adjuvant treatment duration)
Ø 研究背景及基本信息:


作为2017年公布结果的旨在对比III期结肠癌含奥沙利铂辅助辅助化疗时长(3个月对比6个月)的全球IDEA子研究之一,法国IDEA研究由于90%使用了FOLFOX,整体显示了6个月辅助化疗优效于3个月,3年DFS差异3.6%,p=0.011。尤其在高危组(T4或N2),差异更是达到8%,HR 1.44(95%CI 1.14-1.82),但在低危组(T3N1),不同化疗时长的疗效差异(2%)却没有显著性,提示该亚组患者3个月化疗可能是可行的。
而ctDNA已经有越来越多的证据表明有助于监测微小残留病灶(MRD),早期发现复发转移,本次研究者旨在法国IDEA研究人群中来探索ctDNA技术的预后价值及对于不同化疗时长的疗效预测价值。
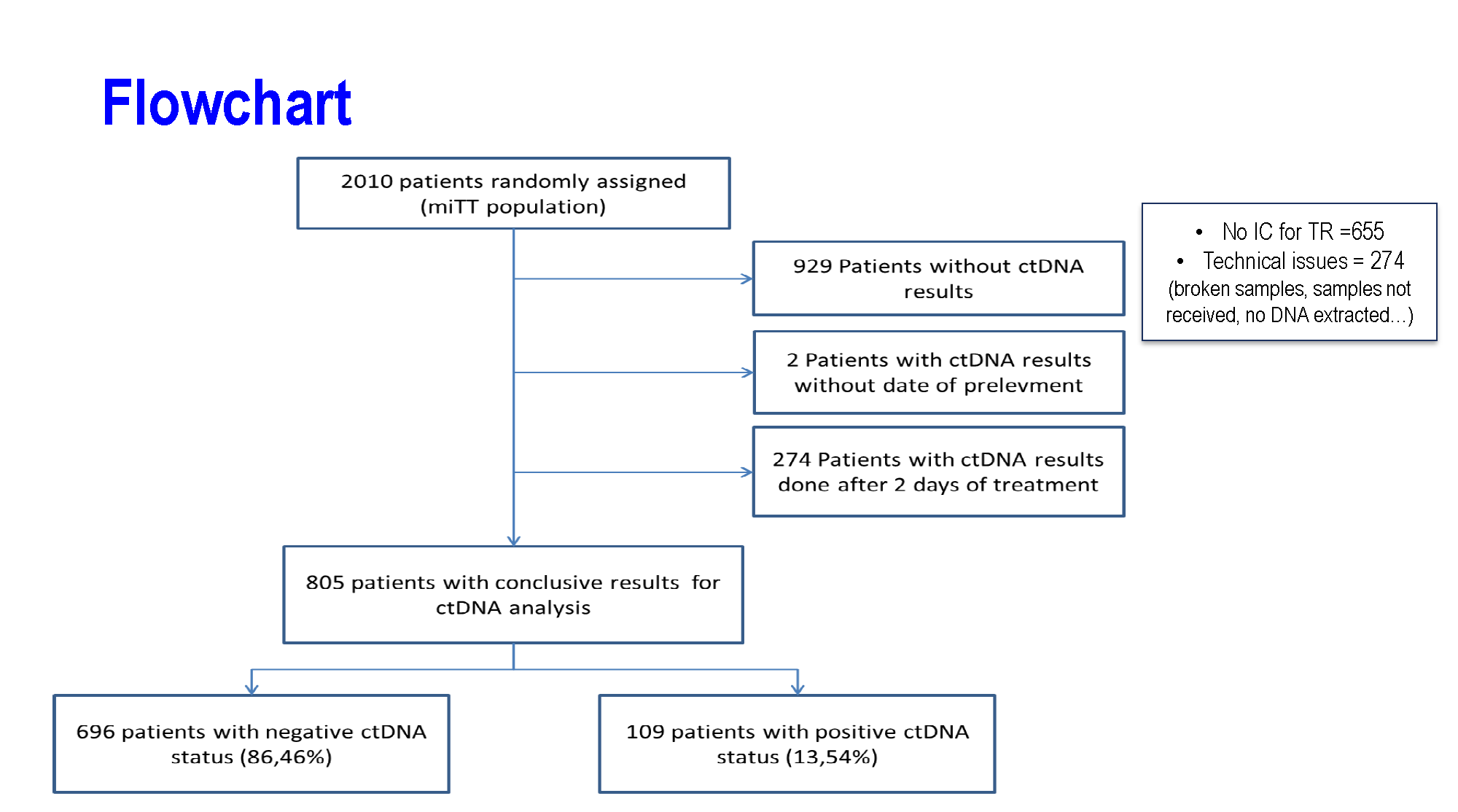
2010例法国IDEA研究人群中,共有1346例患者采集到了术后但辅助化疗开始前的血标本而进入本次研究,最终有805例ctDNA结果可用于分析。ctDNA的检测采用ddPCR技术,仅检测2个甲基化的标志物(WIF1和NPY)。
Ø 主要研究结果:
a) 基线ctDNA(术后、化疗前)阳性率为13.54%,阳性与T4、低分化、肿瘤穿孔有关。ctDNA检测人群与未检测人群的总体预后一样,提示该群体的结果可以基本代表整个法国IDEA研究人群。
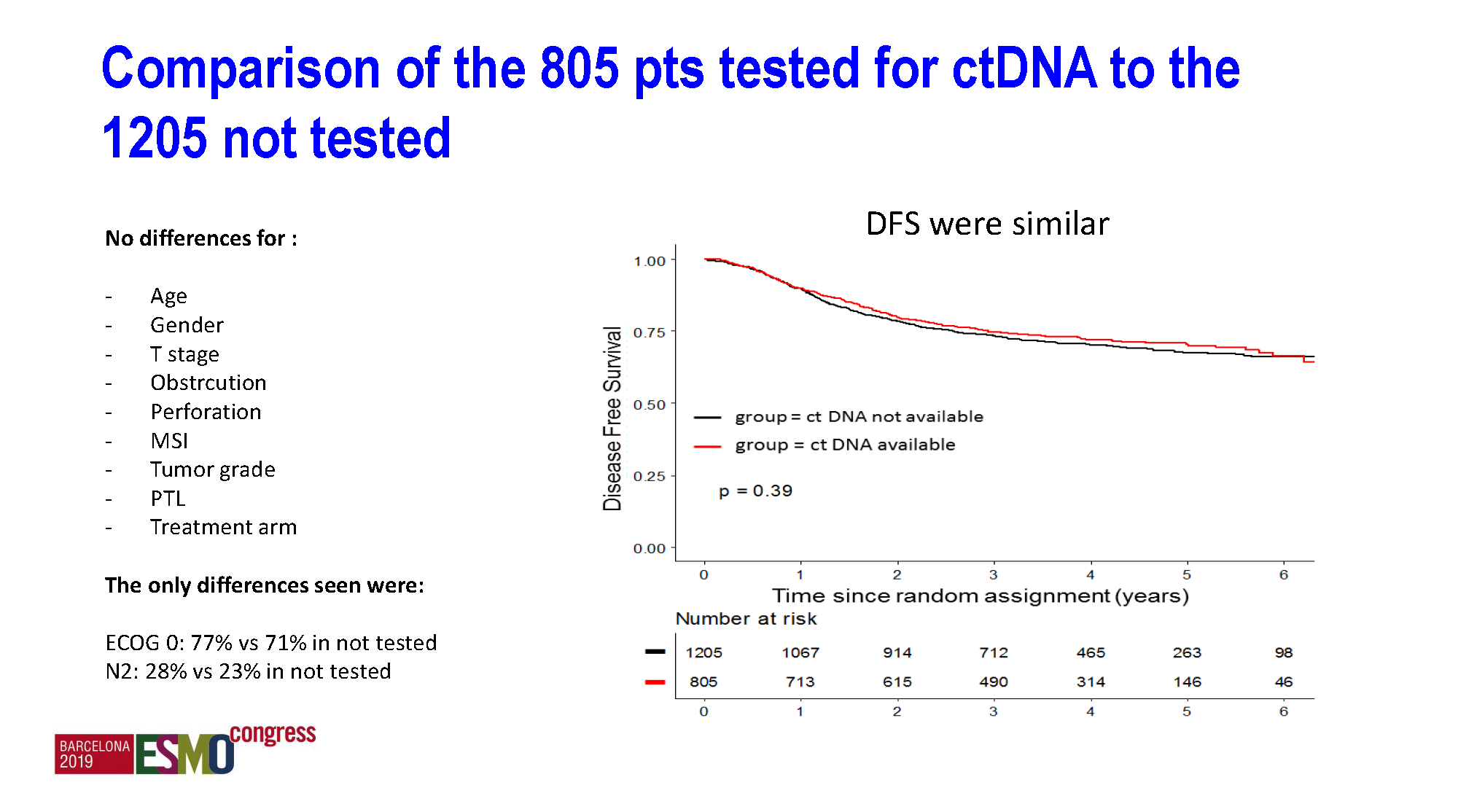
b) ctDNA具有强烈的预后价值:
阳性组与阴性组的2年DFS分别为64.12%和82.39%,HR=1.85(95%CI 1.31-2.61), p<0.001。而ctDNA阴性和阳性两组间人群特征均衡,在年龄、性别、PS评分、T/N分期、肠梗阻、淋巴结送检数目、化疗方案、化疗时长和MSI状态等各个因素间都没有显著差异。

c) ctDNA的疗效预测价值
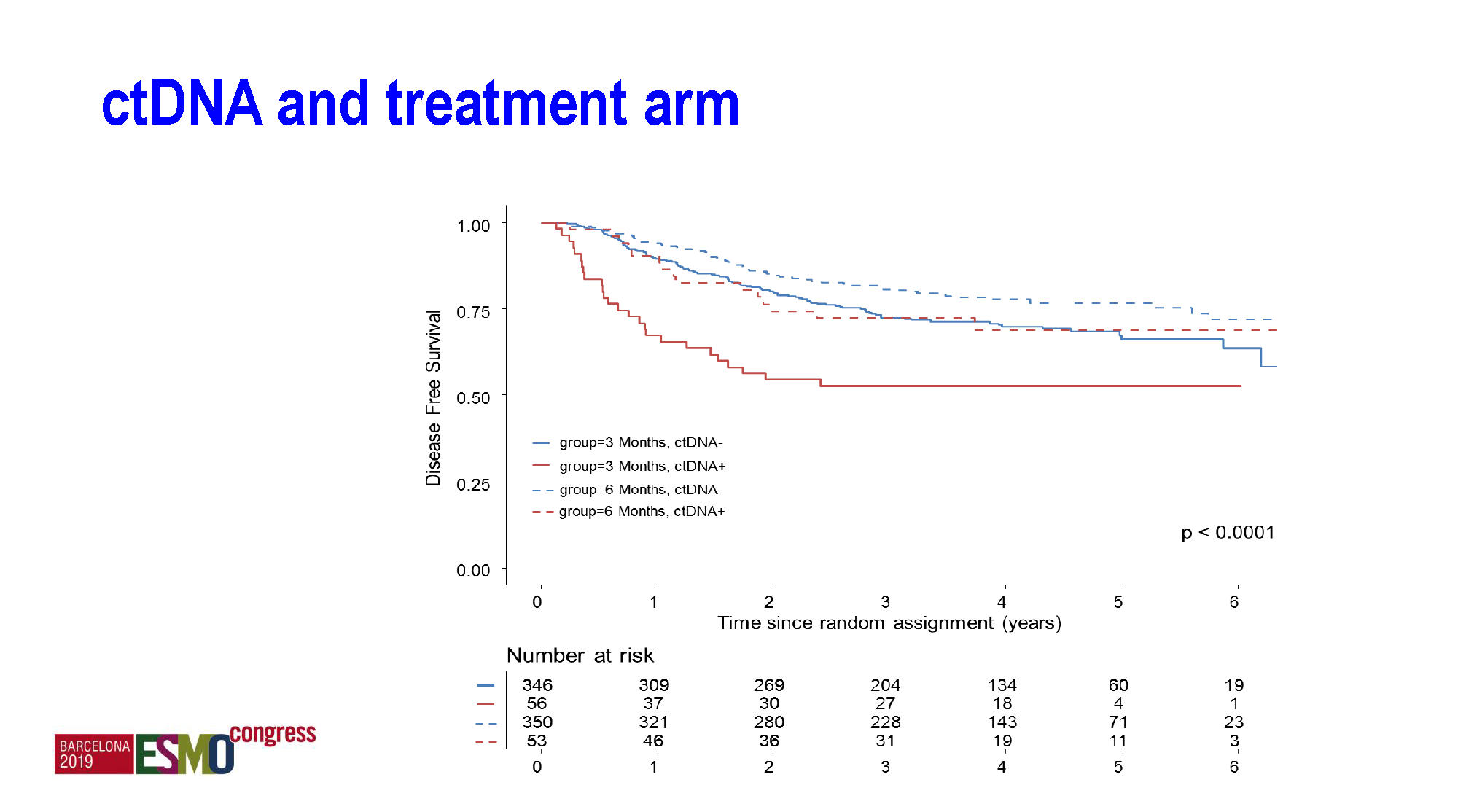
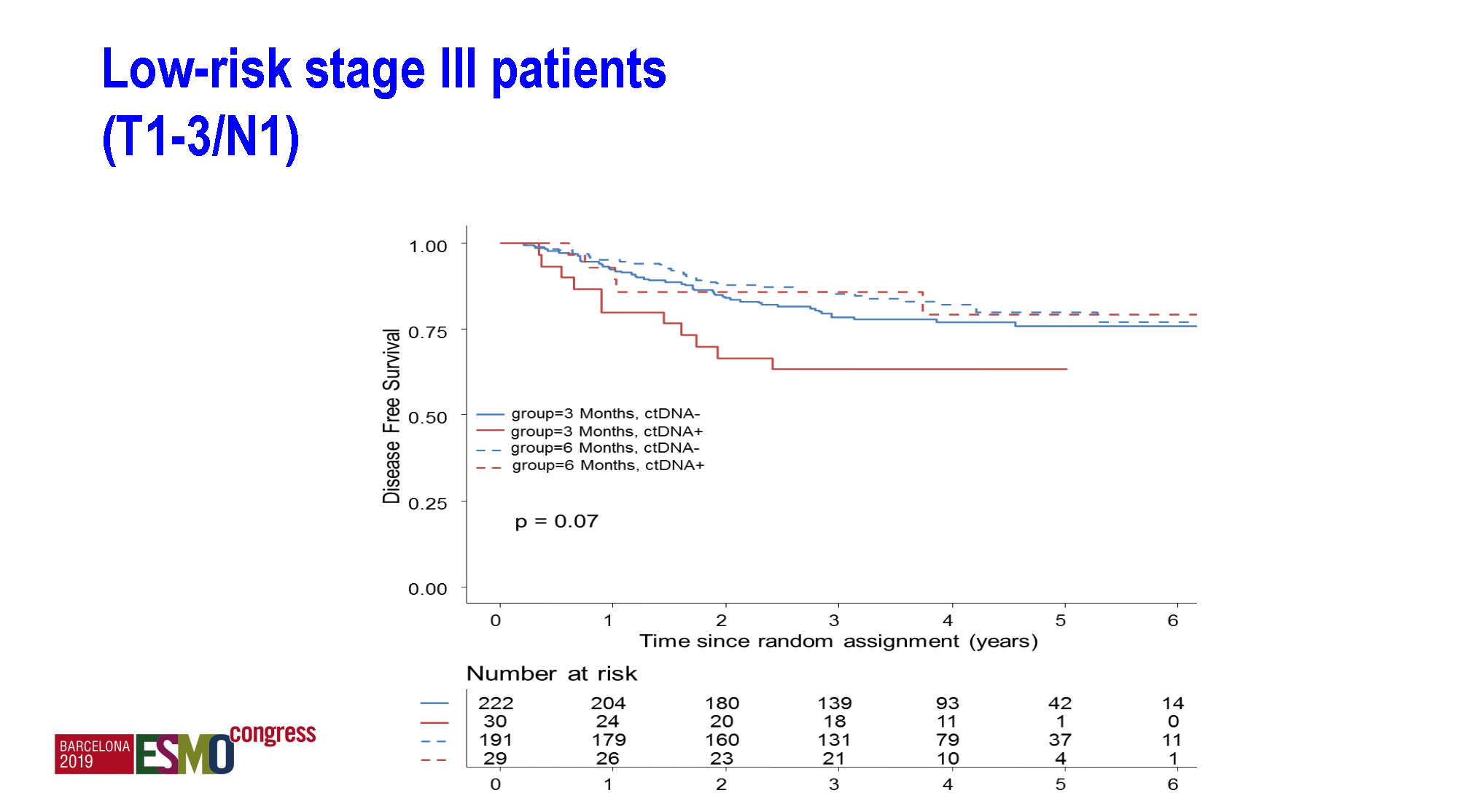
不管是3个月还是6个月化疗时长,ctDNA阴性的预后均明显优于阳性,p<0.0001,高危组尤甚。而那些ctDNA阳性但接受了6个月化疗的患者,其预后接近ctDNA阴性且化疗3个月者。即便在低危组,ctDNA阳性而又仅接受3个月辅助化疗组的患者预后最差。

Ø 结论:
ctDNA具有强烈的预后价值和预测价值,仅接受3个月治疗的ctDNA阳性者预后最差。

研究二:522O-通过ctDNA的突变追踪来检测局限性结直肠癌患者的微小残余病灶(MRD)并甄别那些高危复发风险患者,不管分期、CDX2表达缺失和CMS分型(Mutation tracking in circulating tumour DNA (ctDNA) detects minimal residual disease (MRD) in patients with localized colorectal cancer (CRC) and identifies those at high risk of recurrence regardless of stage, lack of CDX2 expression and CMS subtype)
Ø 研究背景及基本信息:

来自西班牙的该研究旨在通过对150例局限性结直肠癌(临床分期I-III期)进行从术前基线到术后不同时点的ctDNA监测,来监测早期复发转移。一共有11个采血点,持续到术后3年。使用的NGS基因检测套餐包括29个基因。配对检测肿瘤组织的基因突变情况,并在后续的ctDNA中追逐原发灶出现的肿瘤性突变。该研究还同时探索了CDX2表达和CMS分型等标志物的价值。

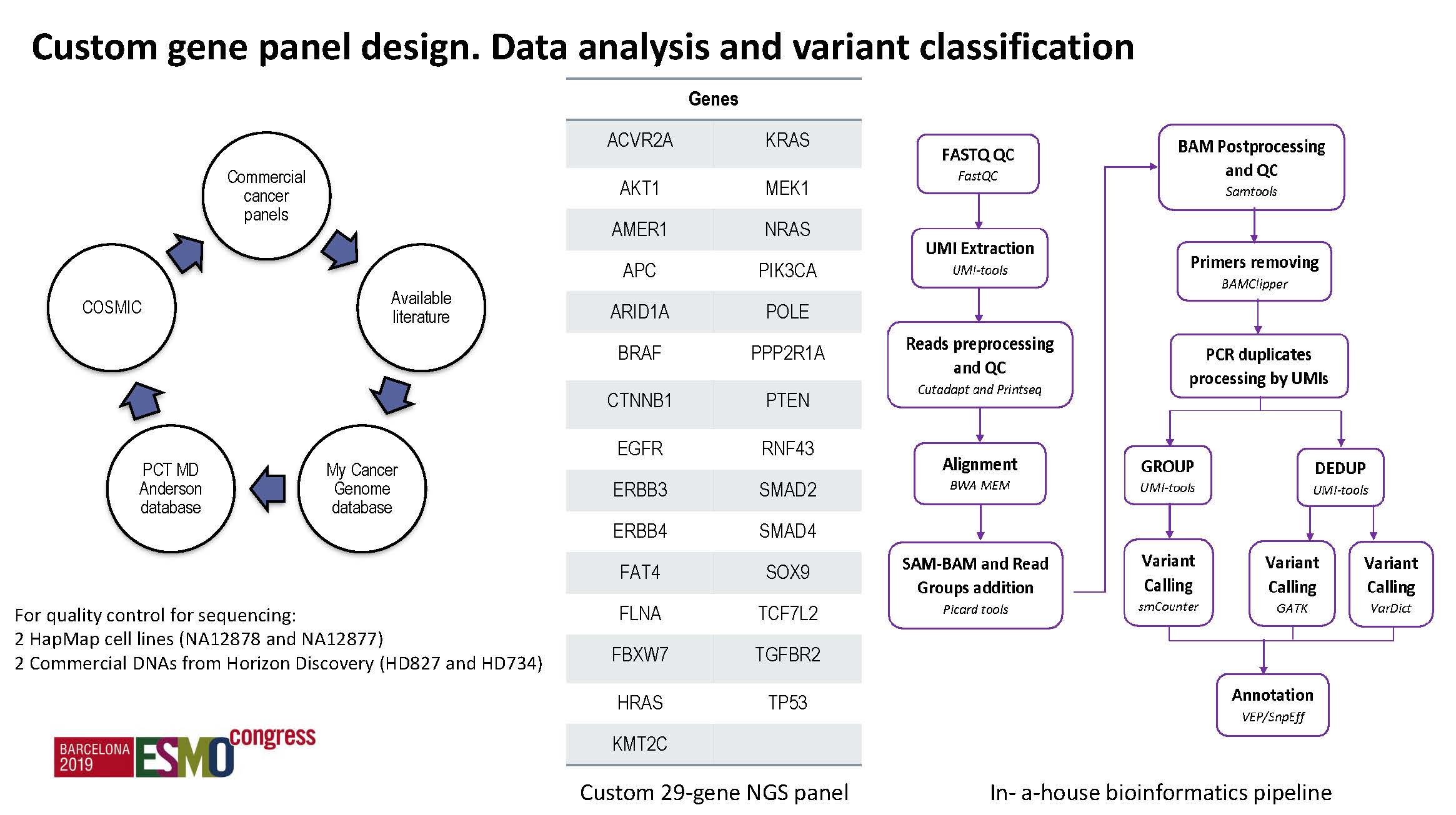
Ø 主要结果
a) 术前ctDNA:术前阳性率63.8%,与分期有关,II/III期患者显著高于I期,但无预后预测价值。
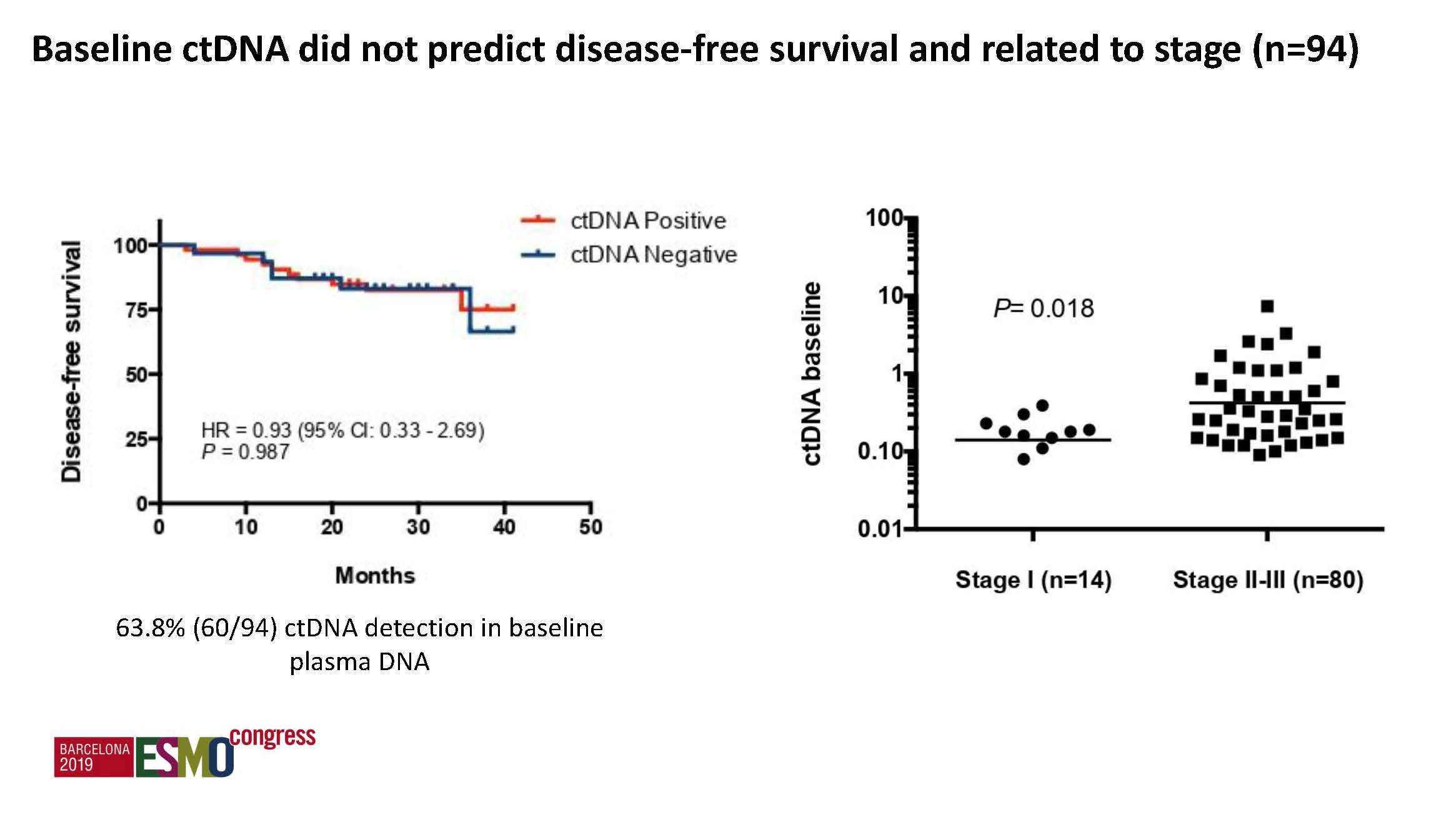
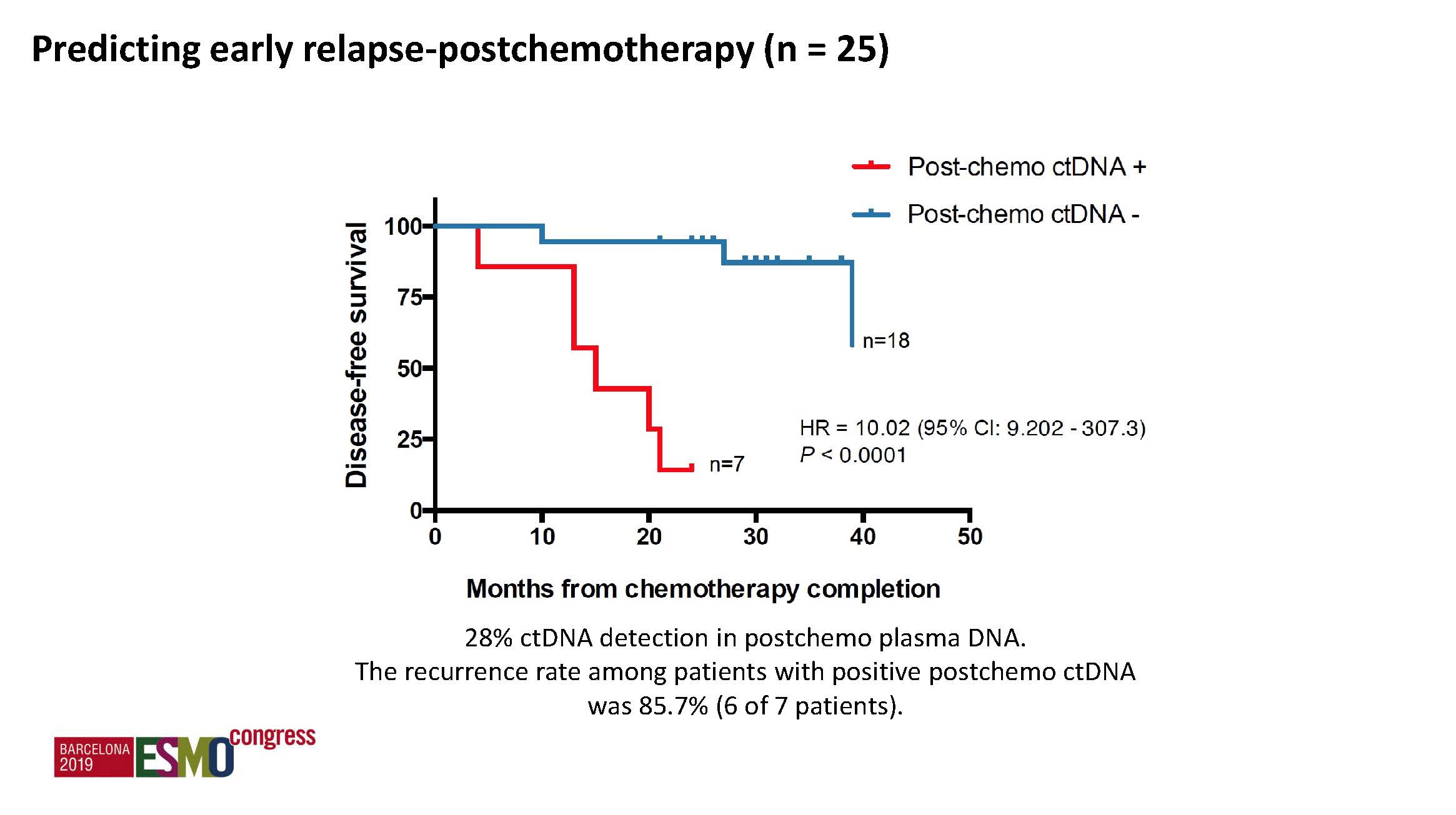
b) 术后ctDNA: 阳性率20.3%,具有强烈预后预测价值,ctDNA阳性者DFS明显缩短(HR 6.96,p=0.0001),复发率57.1%,而阴性组仅为10.1%。
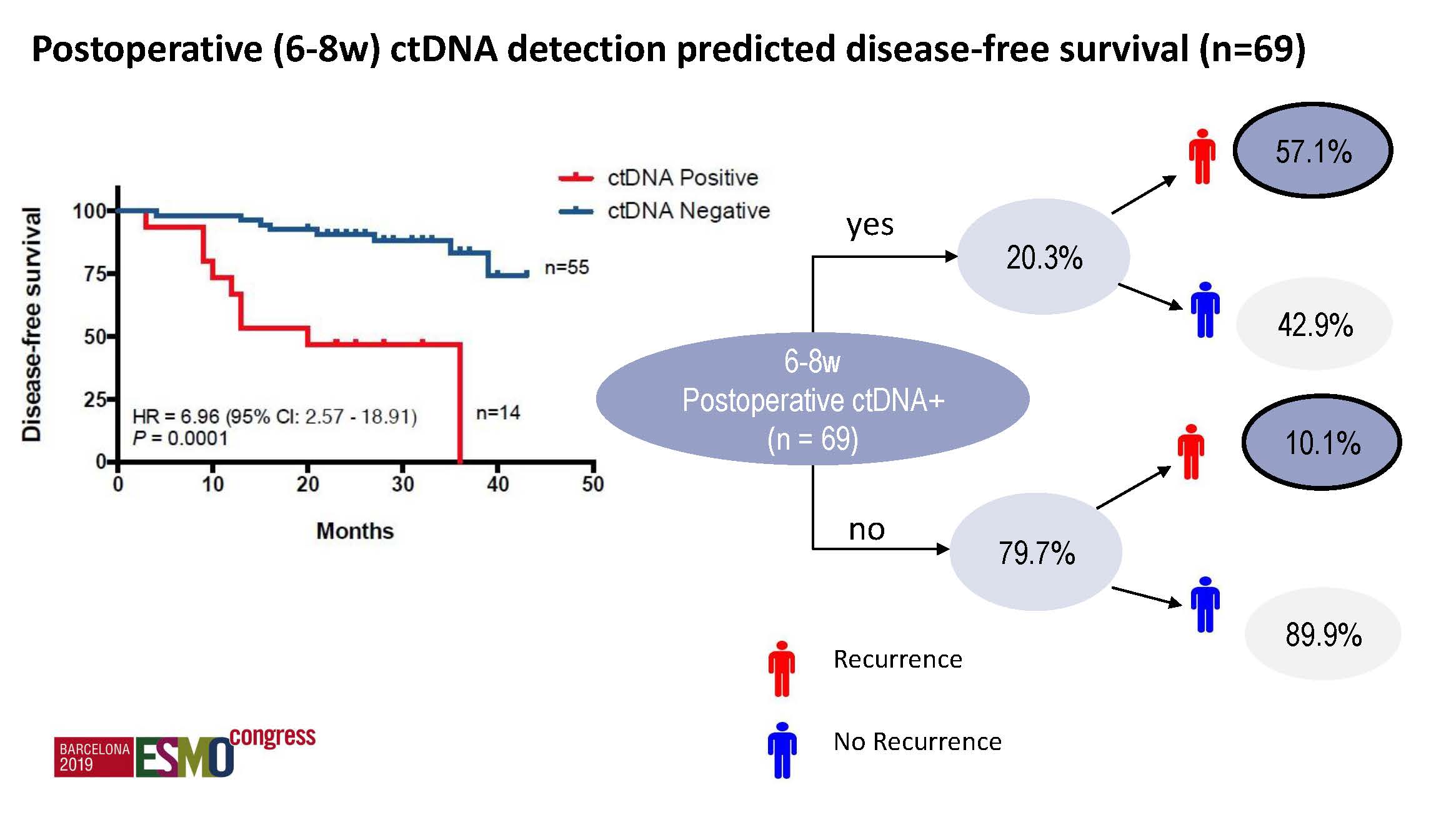
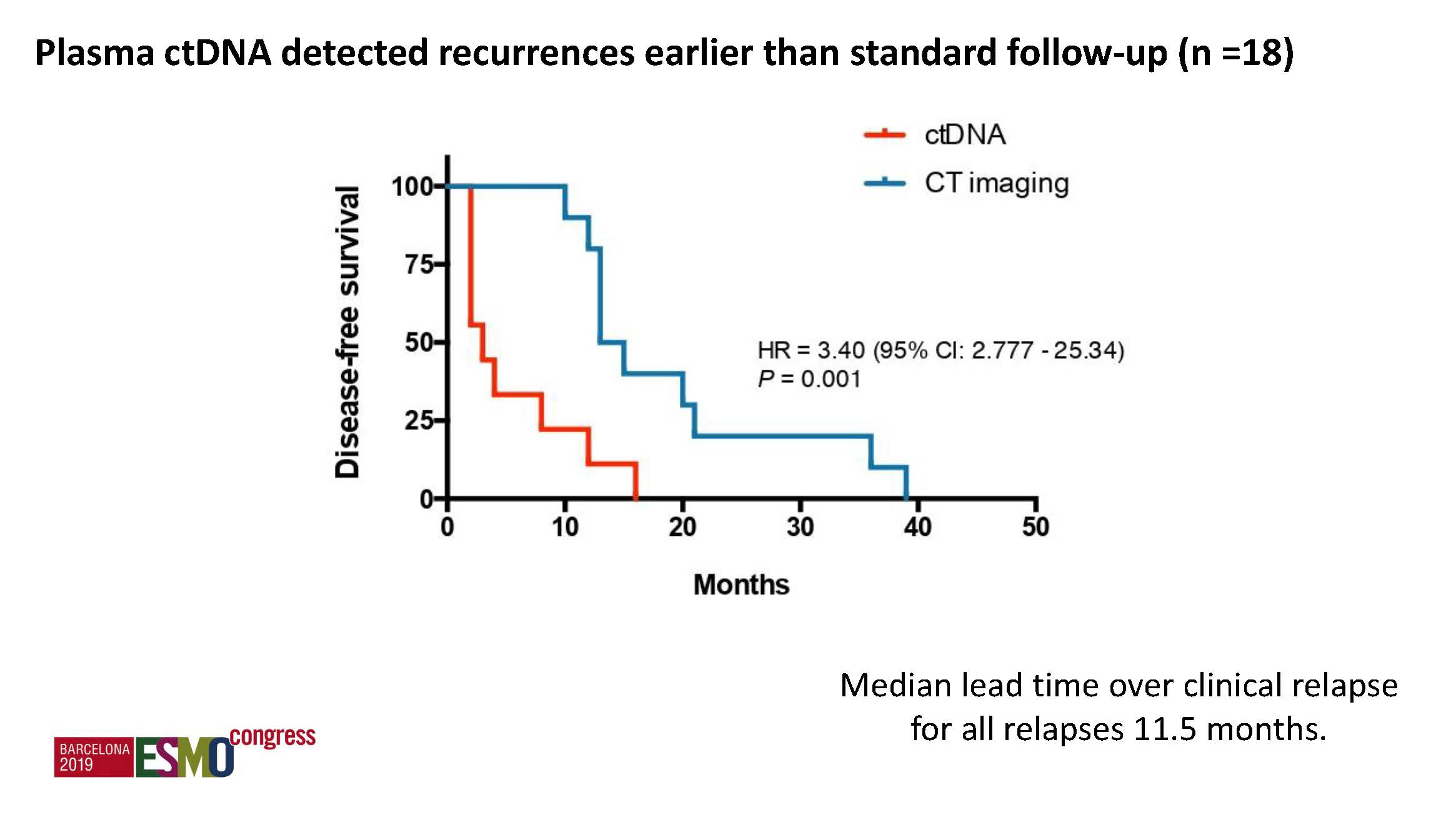
通过连续采血检测ctDNA进行突变追逐,显著提高了复发风险的预测,并能预测辅助化疗后的早期复发,较常规的影像学检查提前了11.8个月。
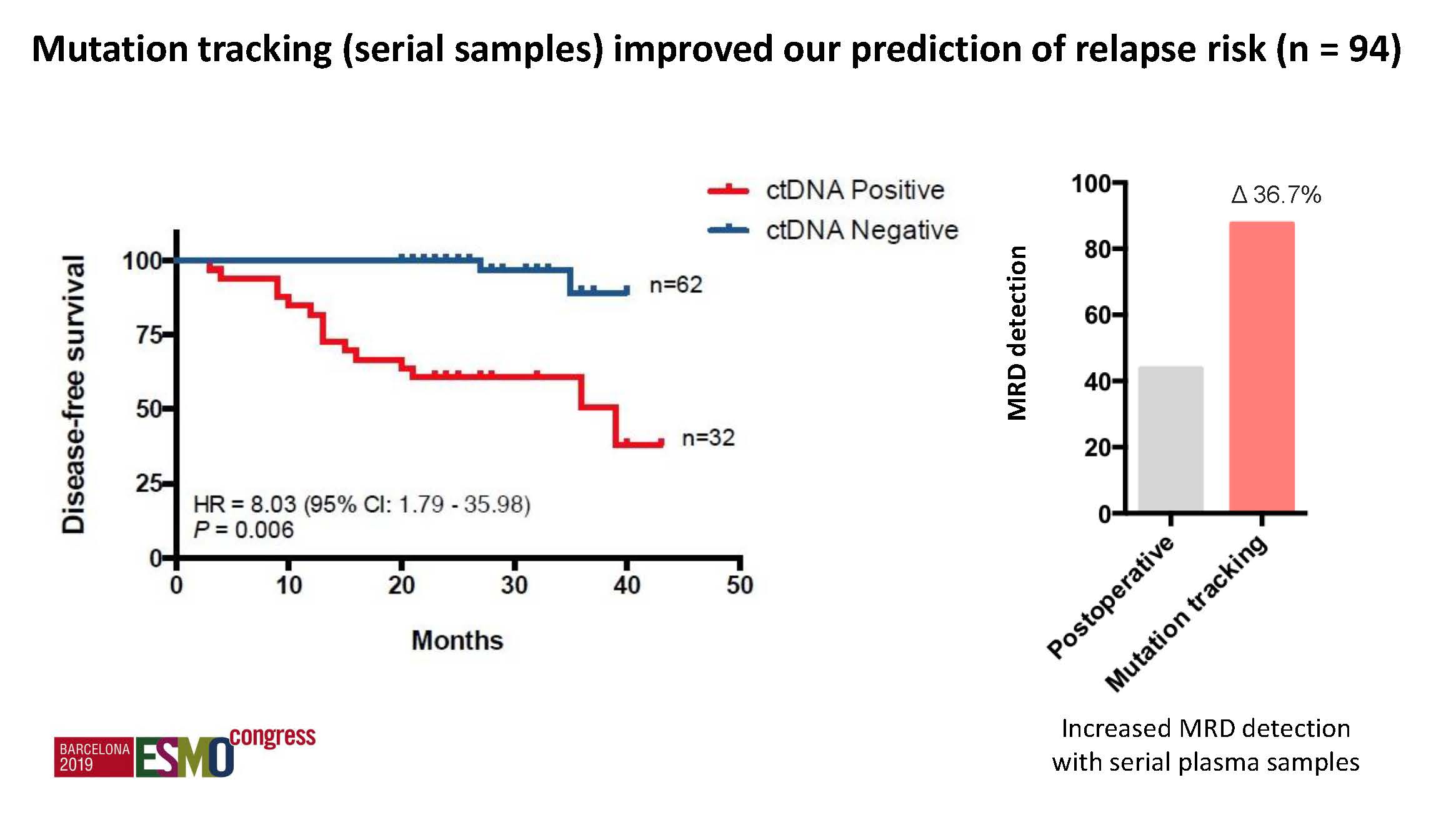
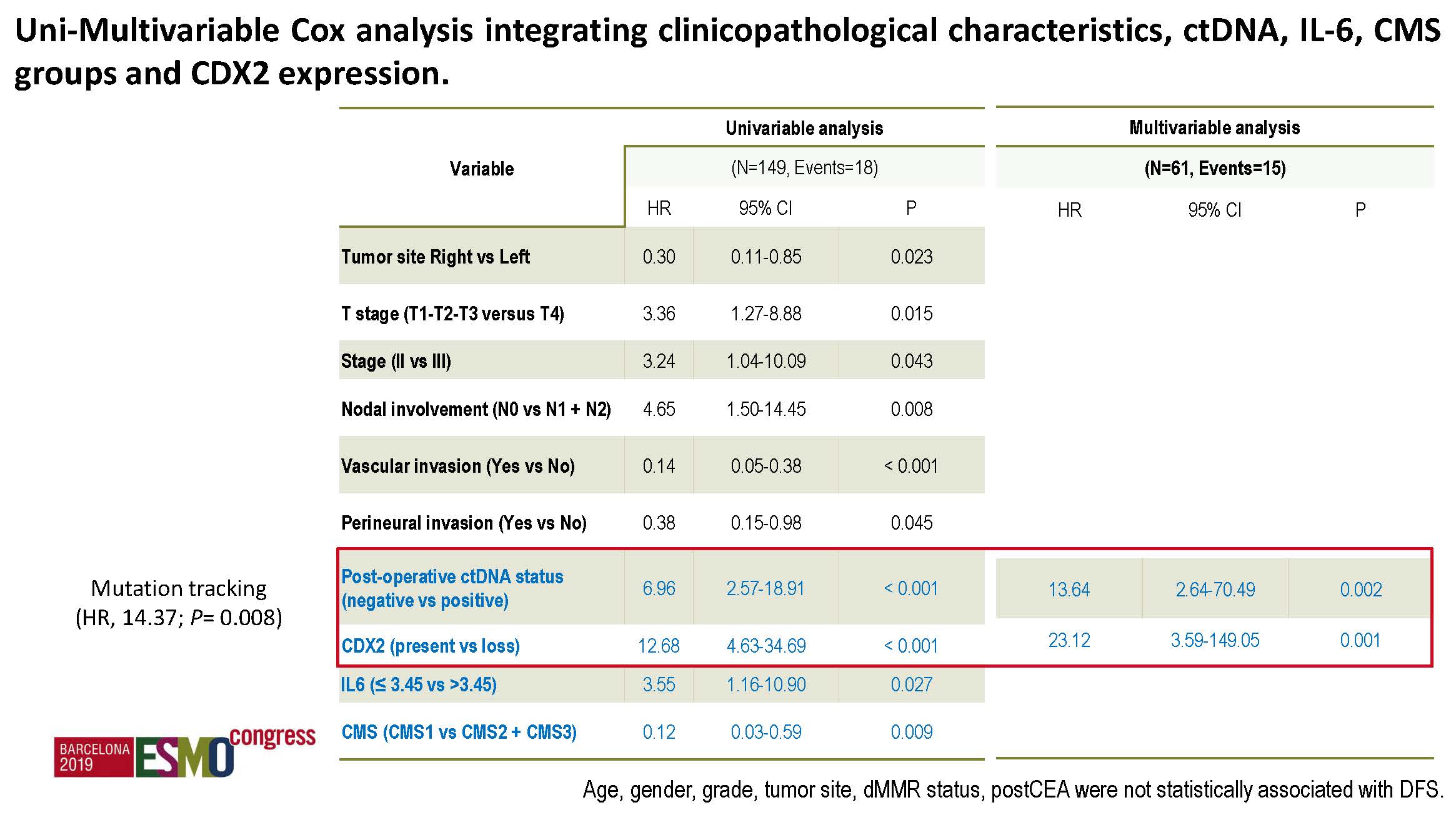
c) 多因素分析:仅术后ctDNA和CDX2表达是独立的预后预测因素
Ø 研究结论:
通过ctDNA连续追踪原发瘤组织出现的突变,能预测早期复发风险,并早期发现复发转移,较常规影像学检查明显提前。辅助化疗结束时ctDNA仍阳性提示可能对治疗耐药。

我的解读与临床启示:
上述两个研究属于精准医学应用于早期结直肠癌临床实践的典范:如何甄别术后高复发风险患者,更早、更有效检测肿瘤复发与转移,并能开始治疗。
目前看来,随着技术日臻完善,ctDNA检测是最有前途的,术后ctDNA持续阳性的患者,肯定是高复发风险。
中山大学肿瘤徐瑞华院长联合复旦大学肿瘤医院、浙江大学第二附属医院开展的一项前瞻性多中心研究,使用世和基因的425基因套餐,初步结果也和本次大会的很类似(见下图),术后ctDNA持续阳性的患者,复发风险非常高。
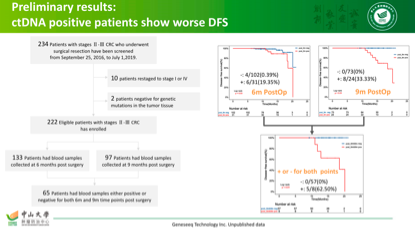
现在的问题是,我们应该检测什么样的ctDNA?使用多大的panel是适合的?这些都没有定论及答案,首先当然要考虑敏感性、特异性,基于肿瘤原发灶突变基因的ctDNA突变追踪无疑是很有前途的一个方向。其次,当然就是要考虑花费及代价。
第二个问题是ctDNA甄别出来的高复发风险患者,应该强化治疗吗?尽管目前已经开始了相关临床研究,但尚未有数据。本次法国IDEA研究的这个分析,能给我们的临床实践带来很多有益的思考。基于越来越多的证据,临床实践中可以考虑在传统的标准里没有化疗适应证或证据很弱的群体,比如部分I期患者、无高危因素的大部分II期患者,如果术后ctDNA阳性,患者治疗意愿强烈,身体允许,可以考虑进行辅助化疗以期改善预后。而对于III期患者,法国IDEA的结果能很好的指导个体化辅助化疗方案时长的量体裁衣。对于那些即便是低危(T3N1),如果术后ctDNA阳性,尤其是在化疗3个月后还持续阳性的患者,应该延长治疗至6个月;这些结果非常期待在IDEA子研究SCOT、日本ACHIEVE研究中去验证,因为这些研究中更多患者比例使用了CAPOX方案辅助化疗,而IDEA研究总体结果发现CAPOX方案基本能达到非劣效,尤其是低危患者,因此,如果ctDNA仍然具有类似的功效,那就应该在ctDNA阳性患者中使用6个月化疗,即便是CAPOX方案。
结合这些信息,我将来的临床实践应该会做出一些改变了,来帮助我开展更加个体化的辅助化疗临床决策,因为要等到随机对照研究结果出来,那时间太久了,对于部分特殊患者,可以先开始实践。
第三个面临的问题是,治疗结束后在随访当中,当ctDNA提示可能复发但常规影像学又没有证据时,如何处理?在西班牙研究中显示提前了将近1年时间,我们的研究显示大约在6-8个月时间,仅凭ctDNA能治疗吗?如何选择治疗方案以及治疗时长?这些都是存在的问题,而且没有答案,目前实践中,只能提醒我们加强临床检查来发现这些ctDNA阳性患者到底可能的复发转移在哪里?还不能对此进行治疗。
研究三:523O-FOxTROT研究:1053例结肠癌新辅助化疗的国际随机对照研究(An international randomised controlled trial in 1053 patients evaluating neoadjuvant chemotherapy (NAC) for colon cancer.)
已经在2019年ASCO年会进行过口头报告的FOxTROT研究本次几乎没有任何数据更新还作为口头报告,实在不应该,为了尊重研究者,还是将主要结果再次跟大家分享。
Ø 研究背景及信息:
欧洲FOxTROT研究入组可手术、非梗阻性结肠癌, CT 评估为T3~4N0~2M0,2:1随机接受6周的FOLFOX(3疗程)/CAPOX(2疗程)新辅助治疗或直接手术,RAS-wt NAC组患者可进一步亚随机1∶1 分至±帕尼单抗(p’mab)组。术后均接受辅助化疗,两组的围手术期化疗总疗程为24周。


Ø 主要结果
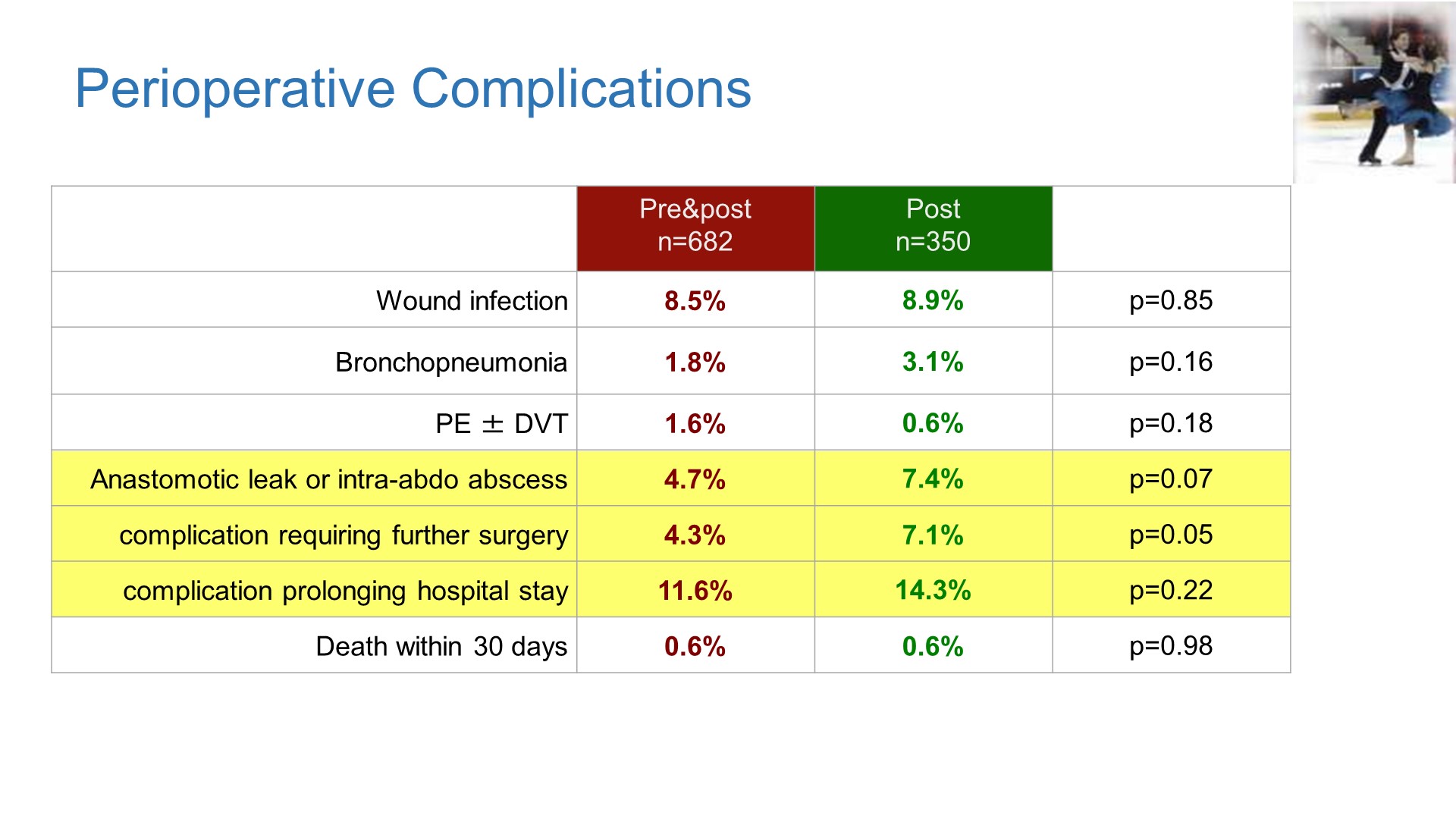
a) 安全性:安全性方面的结果显示新辅助治疗耐受性好,安全性良好,不增加围手术期并发症,术后严重并发症呈减少倾向。尤其是显著减少吻合口漏。
b) 主要终点:2年复发率有降低趋势,虽然达到了HR0.75,但统计学没差异
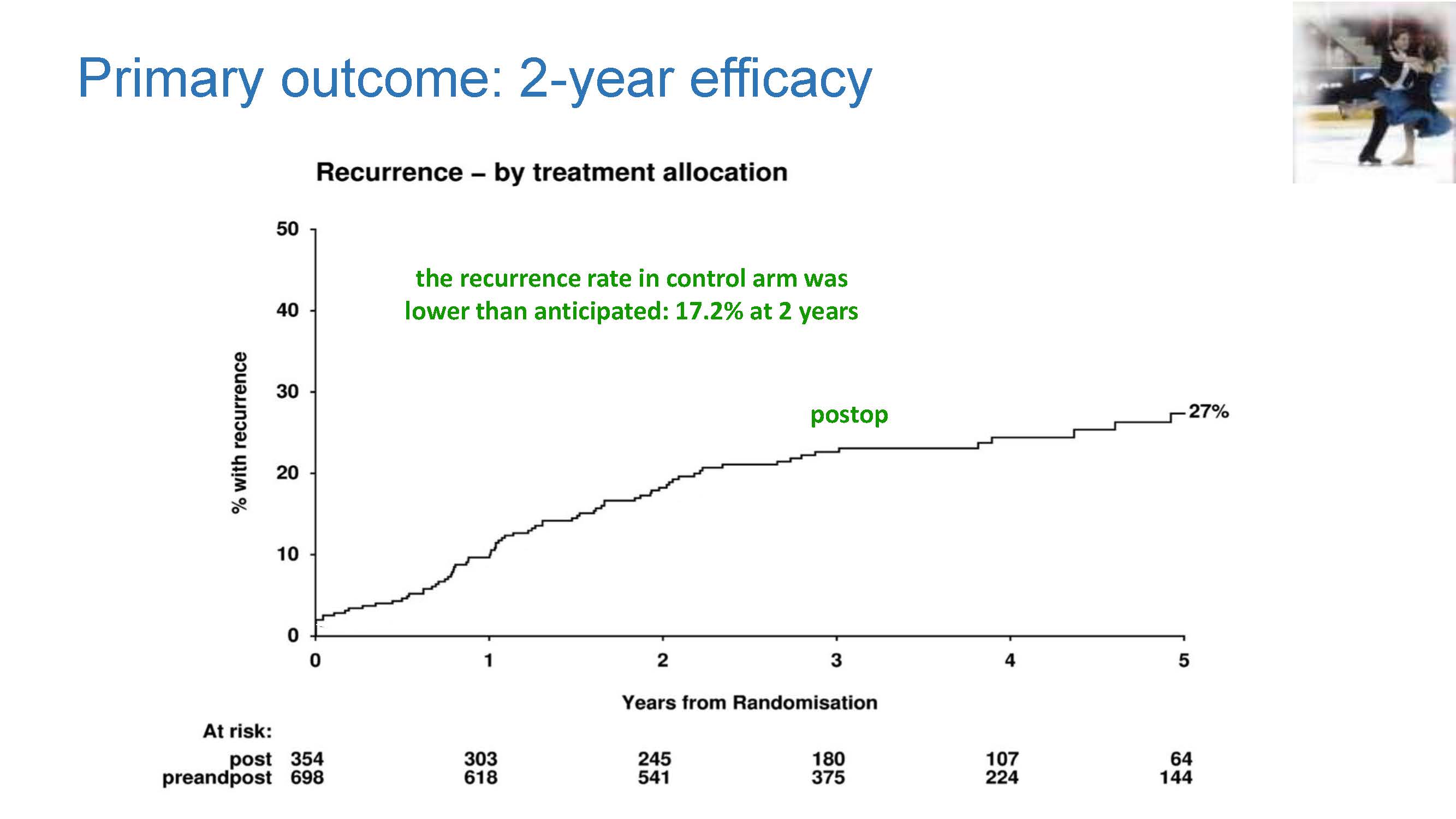
c) 生存终点:全因死亡率和结肠癌特异性死亡率均有下降趋势,但均未达统计学显著性差异。

其他终点:新辅助治疗组显著降低了非R0切除率(包括R1、R2切除或未切除),4.8% vs 11.1%,p=0.001。
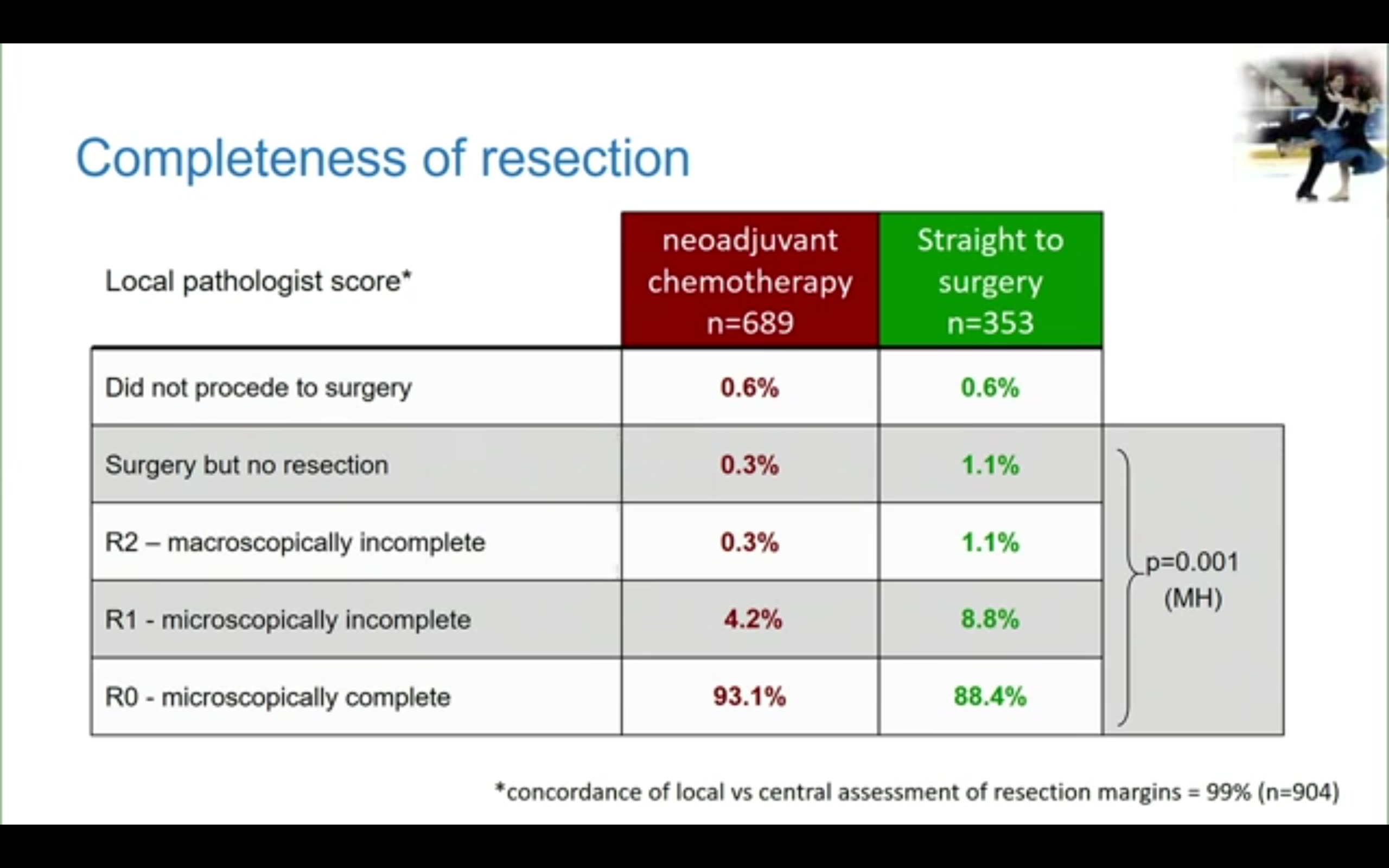
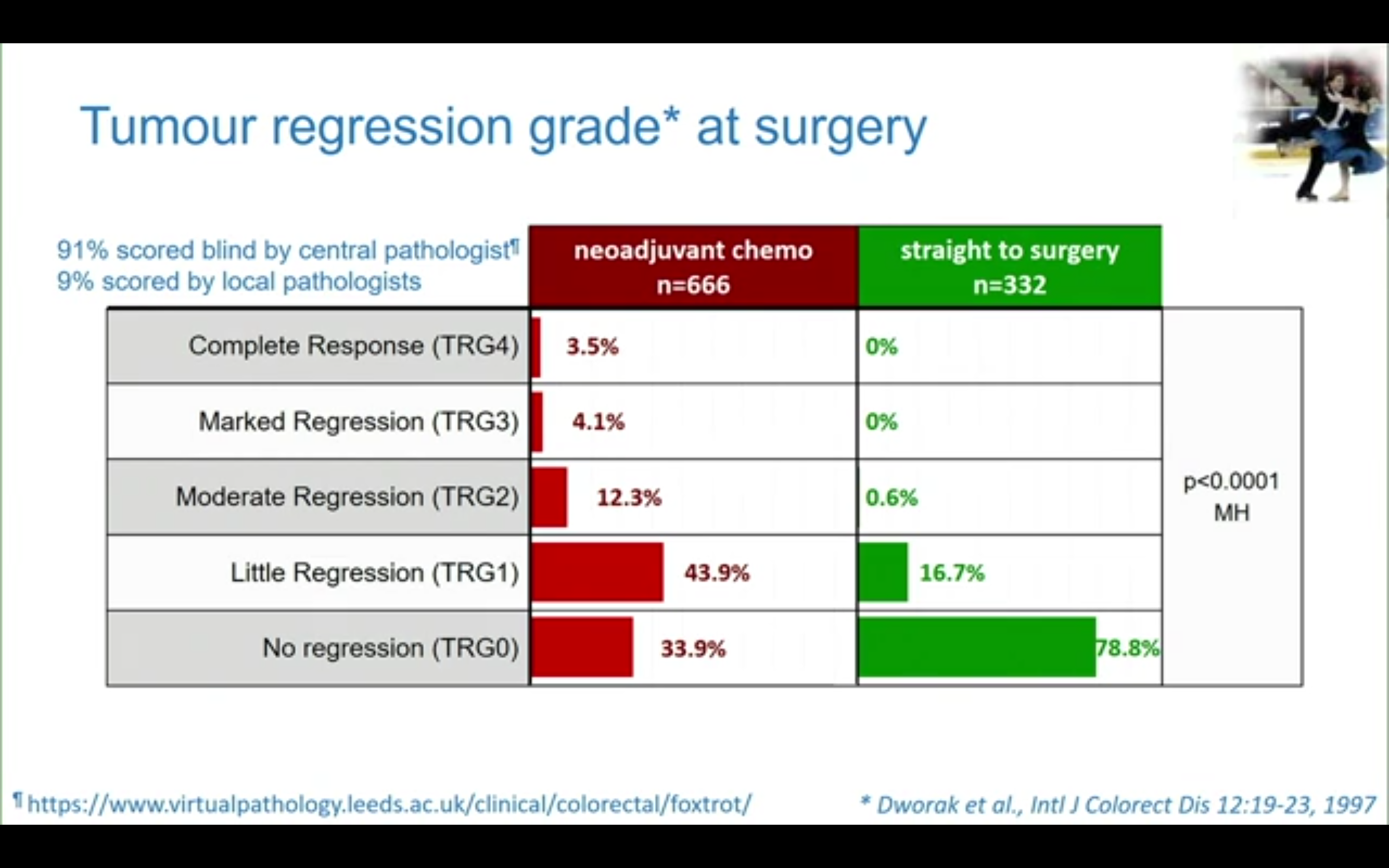
近期疗效-病理结果显示新辅助治疗后肿瘤T分期出现明显降期,59%的患者出现肿瘤组织学退缩,其中包括3.5%的病理学完全缓解(pCR),组织学分期明显降低。而且TRG分级明显与生存相关。


d) 重要的亚组:
帕尼单抗未带来获益。术前新辅助治疗组中共有274例病例参加帕尼单抗的二次随机,探索后者能否在术前治疗进一步带来获益,结果显示帕尼单抗未能进一步带来肿瘤的病理退缩。2年疗效分析也显示帕尼单抗未带来生存获益。总之,在本研究主要分析里观察到的新辅助治疗带来的近期病理学疗效及2年肿瘤学疗效改善现象,并未在帕尼单抗组得到体现。
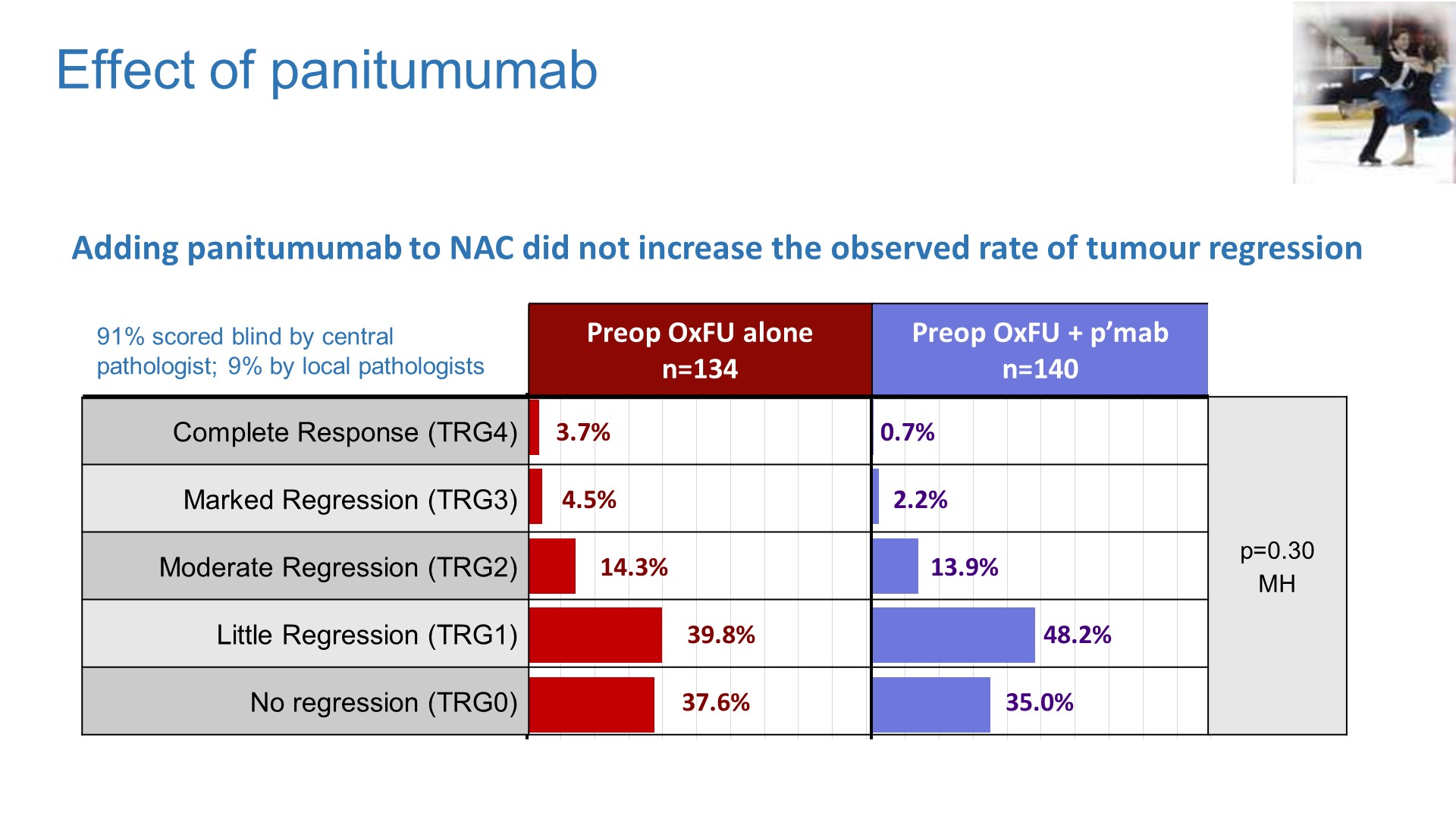
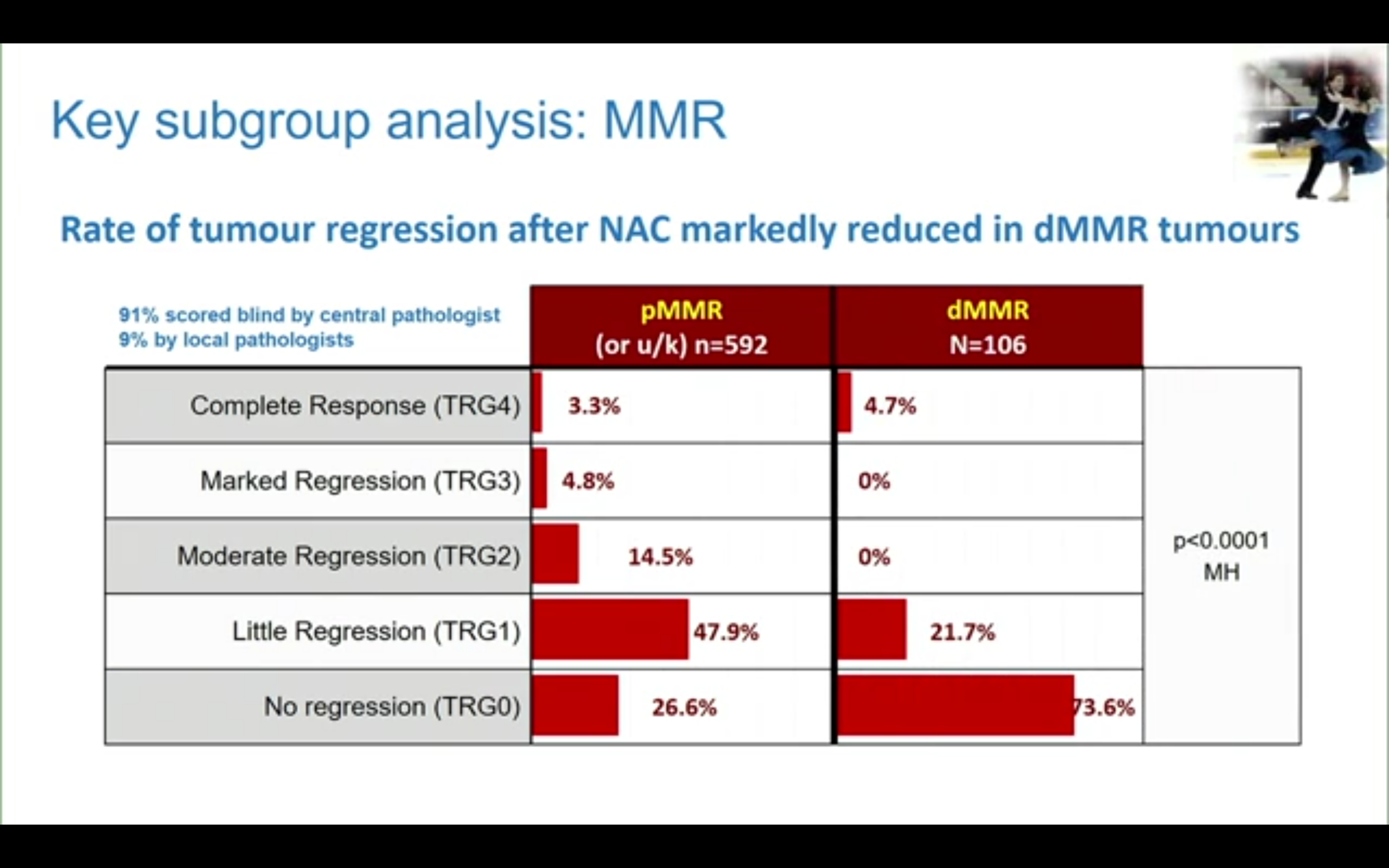
研究还做了MMR状态的亚组分析(非预设),结果显示接受新辅助治疗后dMMR组大多数肿瘤(73.6%)均无病理退缩,但却和pMMR组获得了类似的pCR率。2年肿瘤学疗效分析显示pMMR组新辅助治疗获益的HR为0.69(95%CI 0.47-1.00),但pMMR与dMMR的组间交互作用检验无差异,p=0.35。
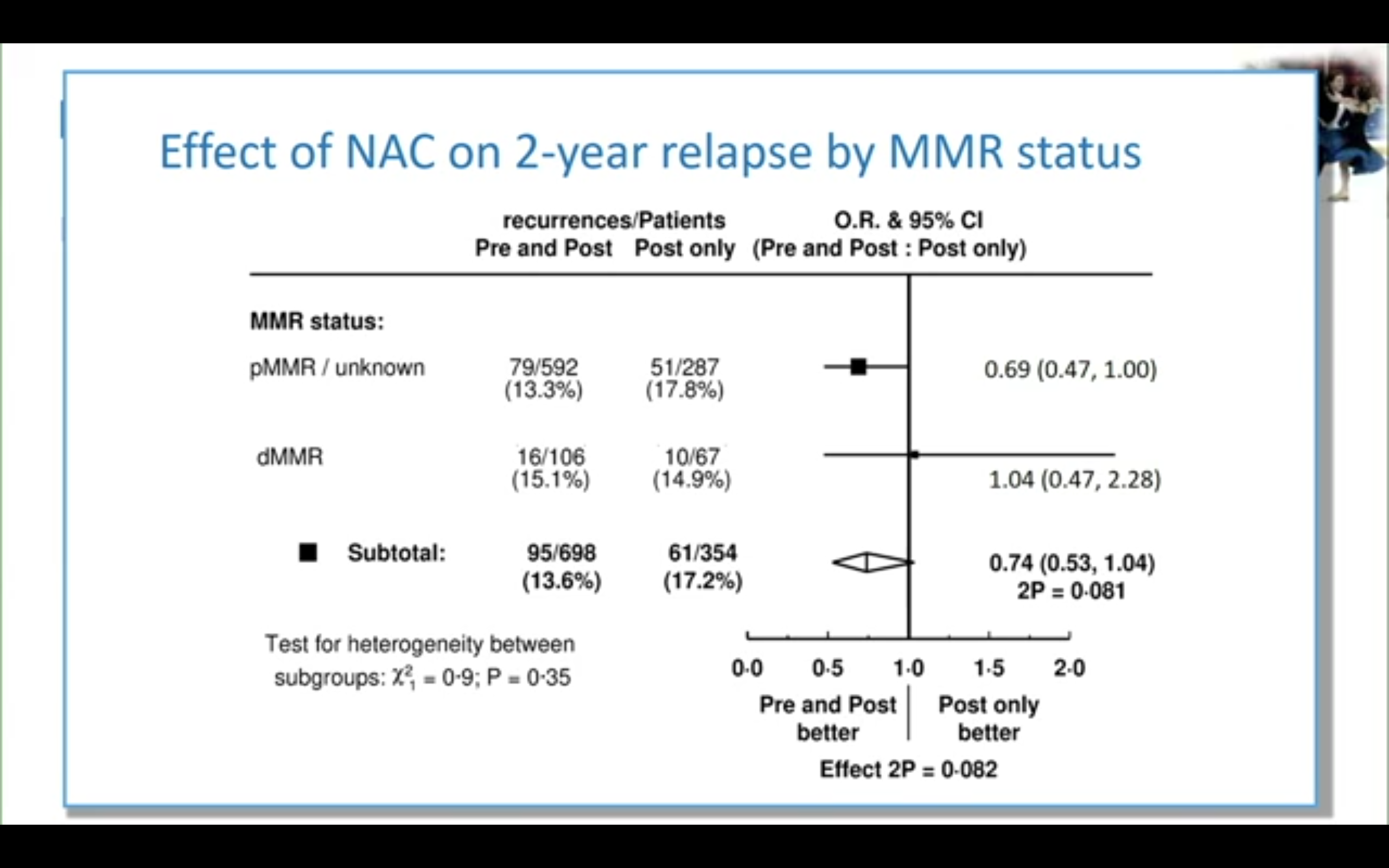
e) 研究结论:
总之,FOxTROT研究未能达到其主要研究终点。亚组分析发现绝大多数dMMR肿瘤对新辅助治疗无效,KRAS野生型肿瘤未能从帕尼单抗里获益。

我的解读及临床启示:
既然研究没有更新,那我还是重复我在ASCO后对该研究的点评吧:
FoxTROT是迄今为止颁布结果的最大型针对局部进展期结肠癌新辅助化疗的国际多中心随机对照研究。局部进展期直肠癌的术前治疗是近30年来全球研究的一个热点,主要是因为盆腔解剖的特殊性导致术后局部复发率高以及患者对器官功能的要求更高,新辅助治疗,尤其是放化疗,通过肿瘤退缩降期可提高手术疗效,显著减少局部复发。反观结肠癌,即便是局部进展期,只要属于可切除,大多数结肠癌手术的时候外科医生可以根据肿瘤的实际边缘有有所扩大具体手术边界而获得安全的R0切缘,因此均可获得不错的肿瘤学效果,本身局部复发率就不高。因此,从手术切除的角度看,该领域对新辅助治疗的需求本来就不高。那么,对于新辅助治疗的期待就剩下能否进一步改善远期生存了,鉴于迄今为止在局部晚期直肠癌领域尚未有坚实的数据显示术前新辅助治疗能改善远期生存(尽管显著降低了局部复发),局部进展期结肠癌的新辅助治疗研究开展较少。
总体而言,FOxTROT的本次结果公布还是给了我们很多有用的、令人鼓舞的信息,让我们看到了该领域的希望。
首先,新辅助治疗带来的优势问题。作为一个外科医生,该研究结果很清晰的显示新辅助治疗不但没有增加反而减少了手术并发症,尤其是吻合口漏和二次手术率,个中原因解释可能是肿瘤缩小后让手术变得更加简单和安全。一般来说,都是担心术前化疗增加手术并发症,在直肠癌、结直肠癌肝转移瘤的相关研究都有证实,而本研究却是减少了术后并发症,是有些意外。但本来结肠癌的手术并发症就不多,尤其是吻合口漏,笔者自己的结肠癌手术吻合口漏发生率肯定小于1%,相信国内绝大多数同行都有同感,因此本研究7.4%(直接手术组)和4.7%的吻合口漏似乎有点难以接受。这可能和欧洲患者体型肥胖、BMI指数高有关。不管怎样,这些安全性数据告诉我们术前新辅助化疗对于绝大多数患者是安全可行的。
其次,新辅助存在的过度分期与过度治疗问题。FOxTROT结果再次显示术前化疗的耐受性与依从性均好过术后辅助化疗,本研究中直接手术组有27%的患者并未接受术后辅助化疗,而新辅助治疗组仅有4%;其中11%的患者是因为手术后身体恢复原因而拒绝术后辅助化疗(医生认为有化疗必要),提醒我们假如这些患者是可以潜在从化疗获益的,那么由于手术并发症、创伤等原因,患者却失去了这个机会。增加化疗依从性和完成度,一直是新辅助治疗被公认的优点。
但事物皆有两面性,这些数据让我们看到的另外一面那就是过度诊断和过度治疗的问题。本研究入组的标准是术前影像(主要是CT)T3/T4,N0-2的局部进展期结肠癌,在直接手术组,6.8%的患者病理分期是T1/T2,说明术前的CT分期是过高的,但在笔者眼里,这个术前分期的准确度已经很高了,在我国的临床实践中,我想绝大多数中心都很难达到如此精确的术前分期。由于本研究并未要求术前淋巴结状态,因此,没有数据对比直接手术组淋巴结状态的术前分期与术后病理分期的拟合度如何,根据笔者的临床经验及文献报道,淋巴结影像学术前分期的准确度更不可靠,尤其在右半、MSI-H患者,由于炎症反应普遍伴有多个系膜区域的肿大淋巴结而容易被误判为阳性淋巴结,目前我国国内尚在在进行的OPTICAL研究,入组标准里就有N+这一条,更加值得关注这个过度诊断问题。
总之,在术前新辅助治疗研究中永远绕不开的一个话题就是分期准确度以及因此而导致的过度治疗问题。本研究中直接手术组中术后没有接受化疗的患者,16%是因为术后病理分期显示疾病分期过低而不需要化疗(也即按照术前分期这些患者是被认为潜在的应该化疗者),按照随机化对等原则,对照的新辅助治疗组里也会有类似比例的患者是不需要化疗的(不管术前还是术后),而这些患者均接受了术前化疗,仅有4%的患者未接受术后辅助化疗,提示有12%的患者可能是被过度治疗了,而且,我们无法知道这12%的患者具体是谁,因为接受了术前新辅助治疗后,术后的低分期可能会被误认为是肿瘤退缩而导致,这也可能是该部分患者术后化疗依从性提高的原因(患者误认为术后低分期是术前治疗起效,而没有认识到也许本身自己就不需要化疗,因而更容易接受医生的术后化疗建议)。
第三,术前新辅助治疗的疗程问题。本研究仅进行6周的新辅助治疗,即FOLFOX3周期或CAPOX2周期,仅占6个月标准围手术期治疗的25%,对于那些潜在的新辅助治疗获益群体来说,该剂量强度会不会偏低?这也是我们应该注意的问题,比如,我国的OPTICAL就是采用术前12周的化疗强度(总化疗强度的50%)。当然,从过度分期/过度治疗,以及那些不能从新辅助治疗获益群体的角度看,延长的新辅助治疗反而增加了损害。
第四,新辅助治疗后的病理退缩程度应不应该作为术后辅助化疗药物、方案选择的一个参考指标?对于那些无退缩或很小退缩的患者(在本研究新辅助治疗组中分别为33.9%和43.9%),是否应该改变术后治疗策略?FOxTROT研究并未针对此专门进行分析或设计,值得以后的研究进行关注。
最后,这个研究对目前临床实践的影响。可以明确的是,对于绝大多数的可切除局部进展期结肠癌,目前新辅助治疗仍然属于研究范畴,我们期待目前我国中山大学第6附属医院汪建平教授和邓艳红教授牵头的OPTICAL研究最终结果来提供更多的数据。在没有更多的数据出来以前,直接手术仍然是标准临床实践的治疗,但FOxTROT研究已经有了不少令人鼓舞的数据,对于部分确实影像学检查显示很可靠的局部晚期尤其是肿瘤外侵严重的病例,我也会个体化的考虑实施新辅助化疗来争取肿瘤退缩以便达到更加彻底的手术效果。
研究四:LBA31-初始不可切除RAS突变型仅有肝转移的mCRC一线治疗单纯化疗对比化疗联合贝伐单抗的单中心随机对照研究(Bevacizumab plus chemotherapy versus chemotherapy alone as first-line treatment for patients with RAS mutant unresectable colorectal liver-limited metastases: A single center randomized control trial)此研究为来自我国上海复旦大学中山医院的许剑民教授团队。
Ø 研究背景及信息
来自复旦大学附属中山医院的许剑民教授团队的BECOME针对了仅有肝转移、初始不可切除且RAS突变的mCRC患者的转化治疗,单纯化疗mFOLFOX6对比mFOLFOX6+贝伐单抗,单中心随机对照,入组241例,主要终点是肝转移切除的转化率。


Ø 主要结果
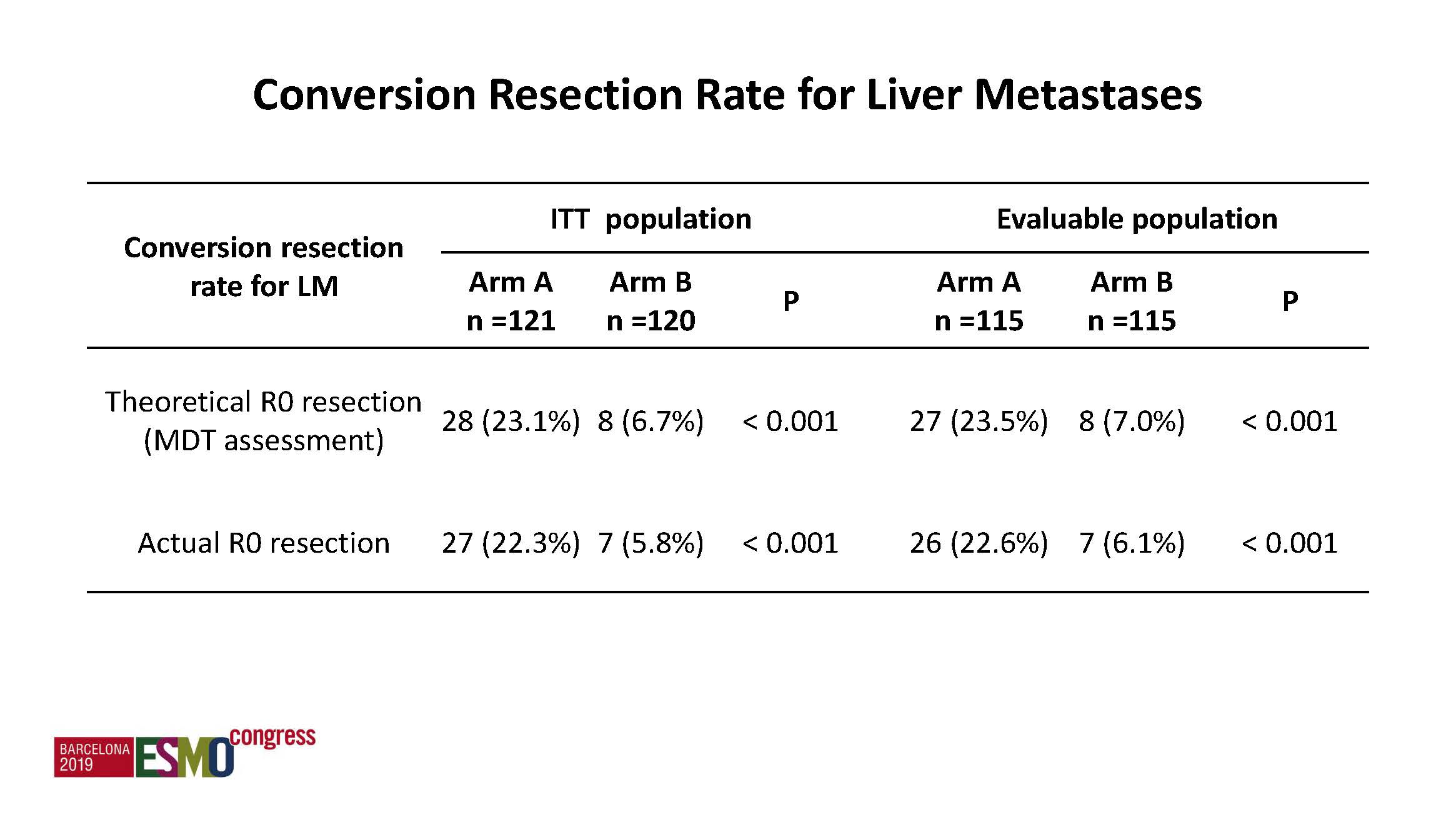
a) 主要终点:加入靶向药物贝伐单抗后转化率显著提高,5.8%提高到22.3%,p<0.001。
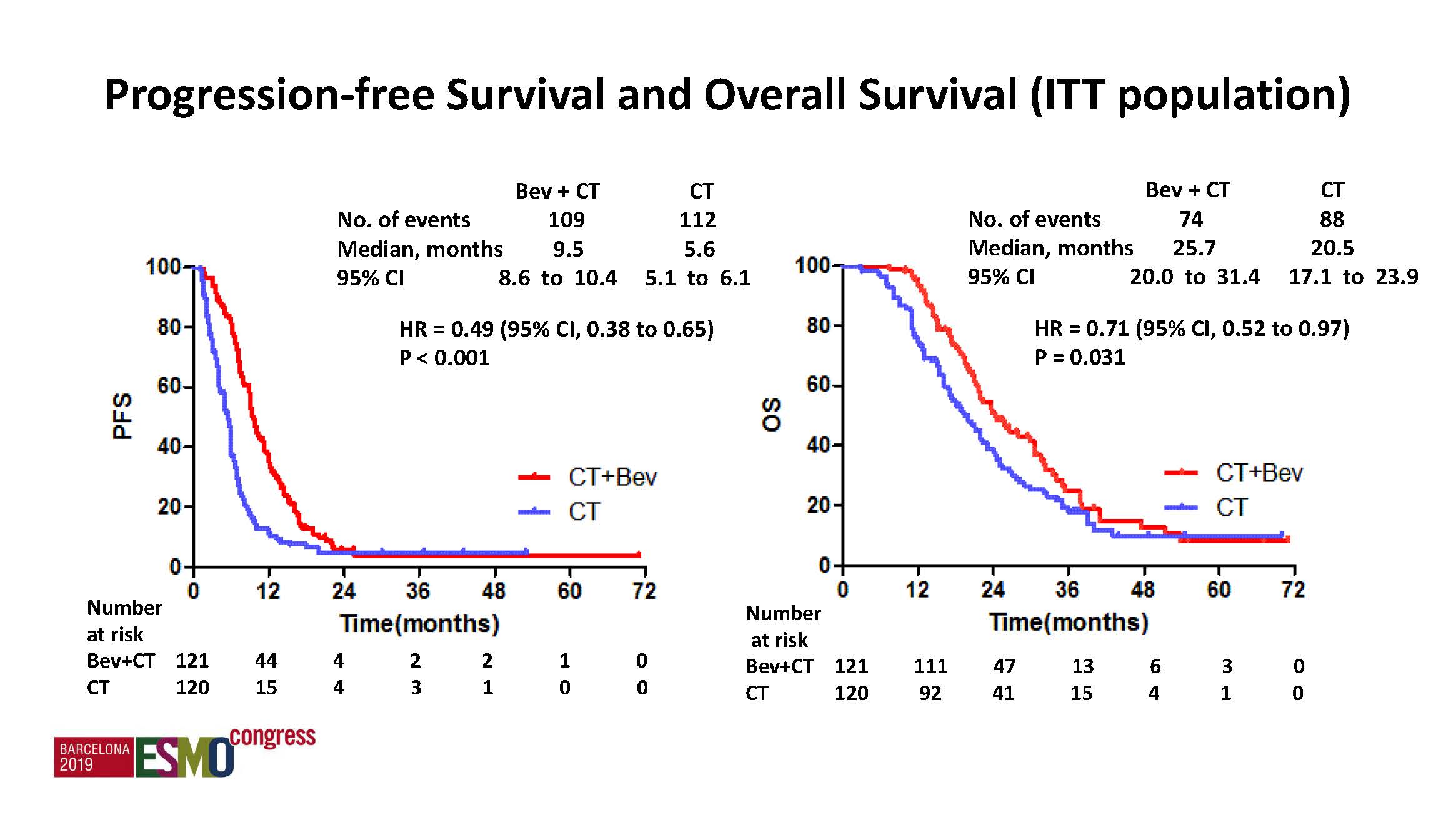
b) 其他结果: ORR、PFS、OS均显示增加靶向药物以后显著改善,后续治疗两组间还是很均衡。
ORR从36.7%提高到54.5%,p<0.001。

PFS从5.6月延长到9.5月,OS从20.5月延长到25.7月,均有显著统计学差异。
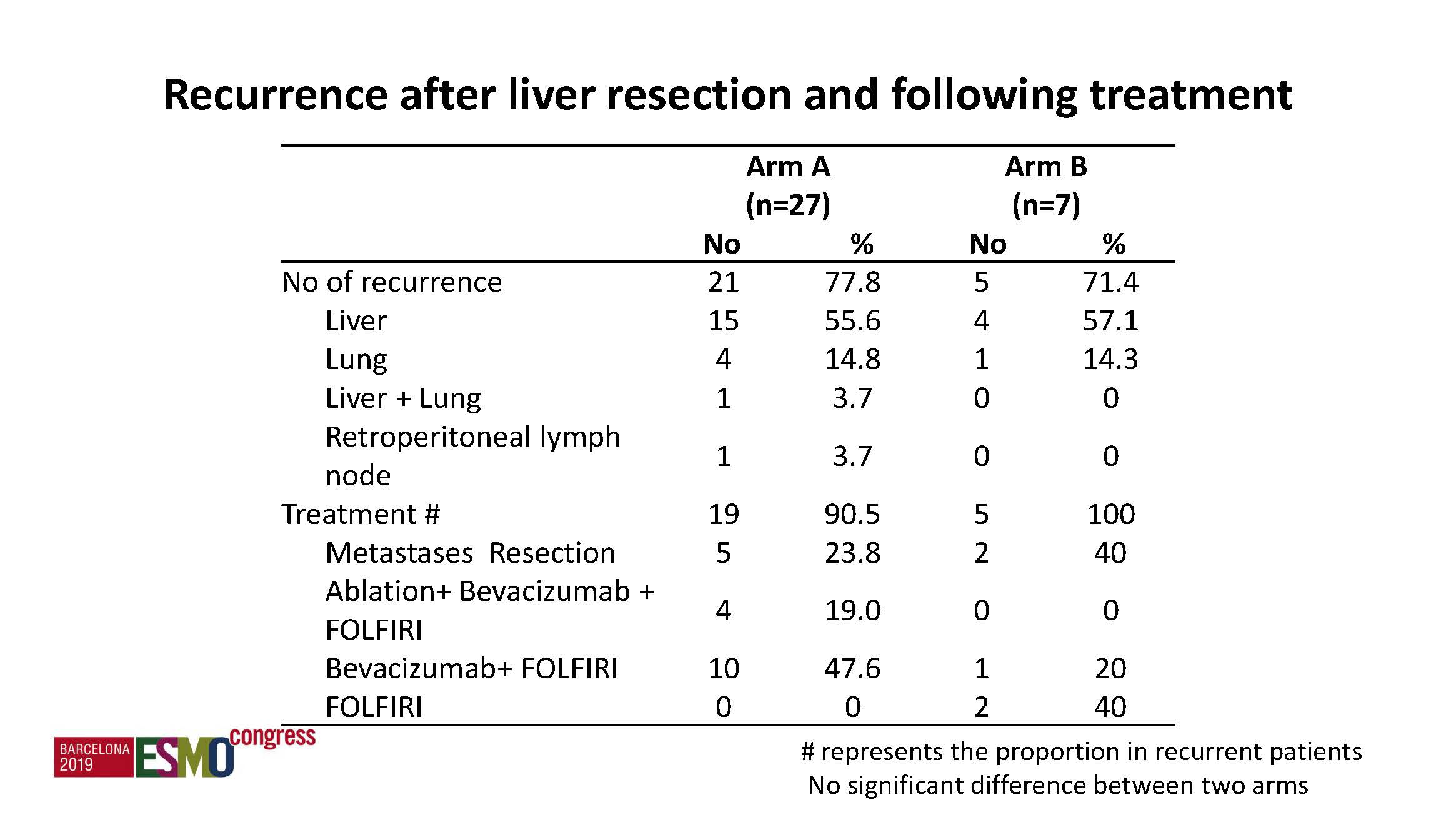
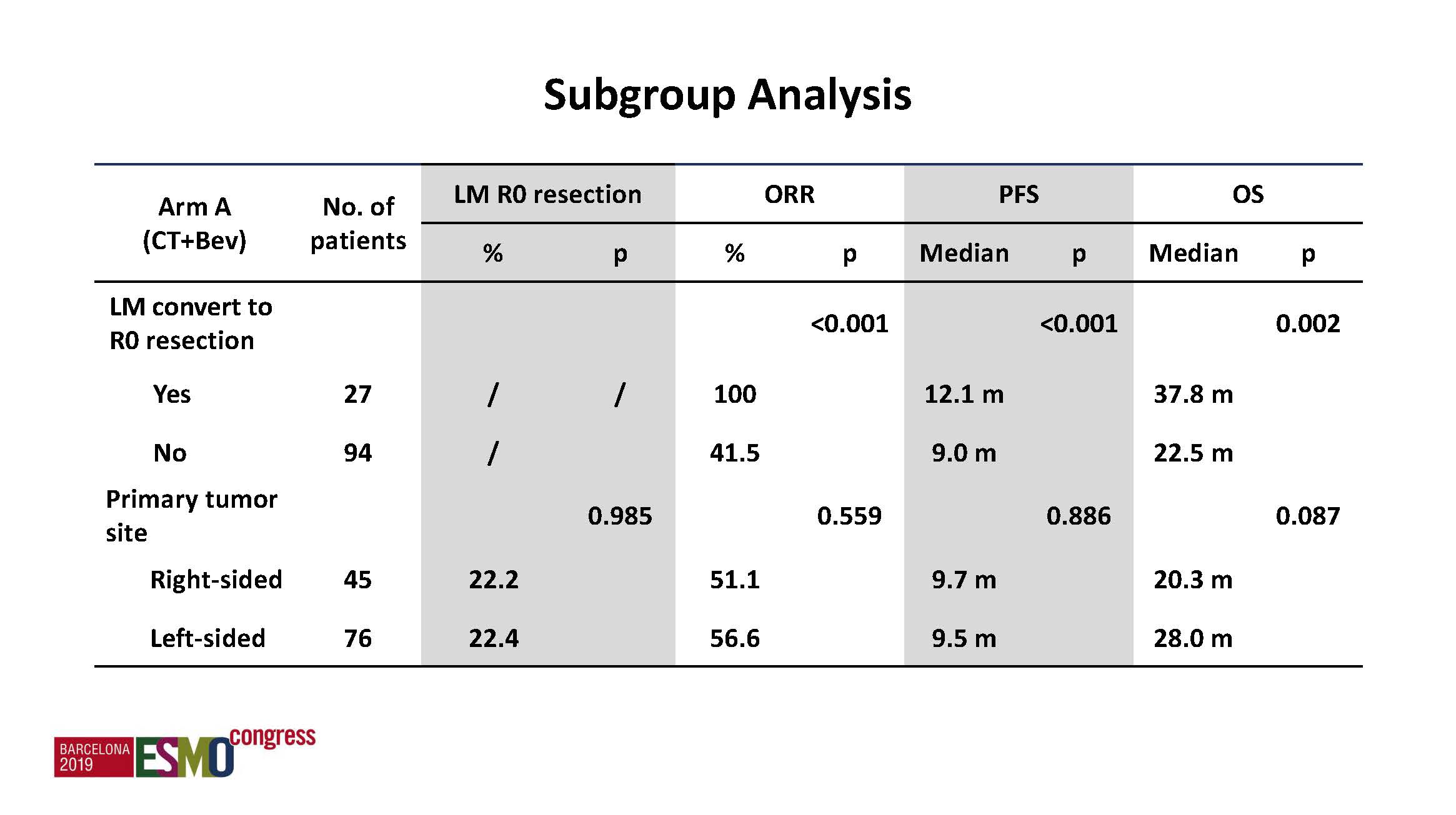
c)亚组分析:获得切除组患者的整体结局优于未切除组,不论单纯化疗还是化疗联合靶向组均一致,左半患者优于右半患者。
Ø 研究结论:靶向药物贝伐单抗加入化疗,能明显增加RAS突变型初始不可切除仅有肝转移mCRC的肝切除转化率,能显著改善患者生存。

我的解读和临床启示:
首先要热烈祝贺并恭喜许剑民教授团队,并感谢所有研究者及患者,完成了这么一个重要的研究。
BECOME研究不会改变我的临床实践,因为研究所证实的策略与方案已经是今天的标准临床实践,也已经写入全球及国内指南。但是,BECOME还是很重要的,这也是为何ESMO官方给了口头报告的机会而且还是LBA的主要原因。为何这样说呢?BECOME是目前第一个,也是唯一的一个专门针对RAS突变、仅有肝转移,而且治疗目标是转化治疗的随机对照研究,而且从转化率、ORR、PFS及OS全线指标均为阳性,完全证实了指南推荐是正确的。和这个研究最类似的就是NO 16966,CAPOX/FOLFOX对比CAPOX/FOLFOX+贝伐单抗,这个研究中没有RAS分型,结果ORR、PFS均未显著改善,但主要终点OS显著延长,因此使得此方案成为了标准推荐。上述我们说的这种治疗策略与方案已经是标准,正是来源于此,也是将这些人群作为RAS突变mCRC大群体中的一个亚组来说的,正如点评嘉宾、来自德国的Kohne教授提出来的一样,对于这个群体,终于有了第一个RCT。未来的方向是对于这样一群整体预后不好、治疗目标又是转化的群体,也许需要更强烈的方案,许剑民教授表示将会对此开展FOLFOXIRI+Bev对比FOLFOX+Bev的研究。事实上,近年来很多FOLFOXIRI+贝伐单抗的研究已经提示了这种趋势,当然专门针对仅有肝转移需要另一个大型3期RCT。

有幸和许剑民教授团队在现场见证。
供稿 | 陈功(中山大学肿瘤防治中心)发自西班牙巴塞罗那
编辑 | 刘婷(中国医学论坛报)
查看更多