查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,美国杜克大学医学院 Chuan-Yuan Li 课题组在 Nature 杂志上发表了题为:Inhibition of PCSK9 potentiates immune checkpoint therapy for cancer 的研究论文。
研究团队独辟蹊径,聚焦胆固醇代谢的重要调节分子PCSK9,发现抑制PCSK9可以显著增强小鼠肿瘤免疫应答,并且可以与免疫检查点疗法PD-1抗体协同,发挥“1+1>2”的效果。

自2011年伊匹单抗(ipilimumab),2014年纳武单抗(nivolumab)以及帕博利珠单抗单抗(pembrolizumab),2016年阿替利珠单抗(Atezolizumab)相继被批准用于临床肿瘤治疗开始,以免疫检查点疗法(Immune checkpoint therapy,ICT)为代表的癌症免疫治疗已经给肿瘤治疗领域带来了颠覆性的变革。
很多对传统放化疗以及靶向治疗效果不佳的癌症患者,被免疫检查点抑制剂PD-1/PD-L1抗体或CTLA-4抗体带来了生存希望。
然而,免疫检查点疗法仅对于10%~30%的癌症患者有效,比如黑色素瘤、非小细胞肺癌以及肾癌等,而对于绝大多数其他的癌症患者疗效甚微甚至完全无效。因此,近年来,生物医药学界都在积极探索和开发新的治疗策略来增强肿瘤免疫治疗效果。
在该研究中,研究人员首先利用CRISPR-Cas9基因编辑技术在小鼠乳腺癌细胞(4T1)、黑色素瘤细胞(B16F10)以及结肠癌细胞(CT26和MC38)中敲除了Pcsk9并发现敲除了Pcsk9的肿瘤细胞在免疫正常的小鼠中生长受到显著抑制,并且荷瘤小鼠的总生存明显延长(图1),而在免疫缺陷的荷瘤小鼠中却无法观察到该现象。这强烈提示了抑制PCSK9可能显著提高了小鼠对于肿瘤细胞的免疫应答。
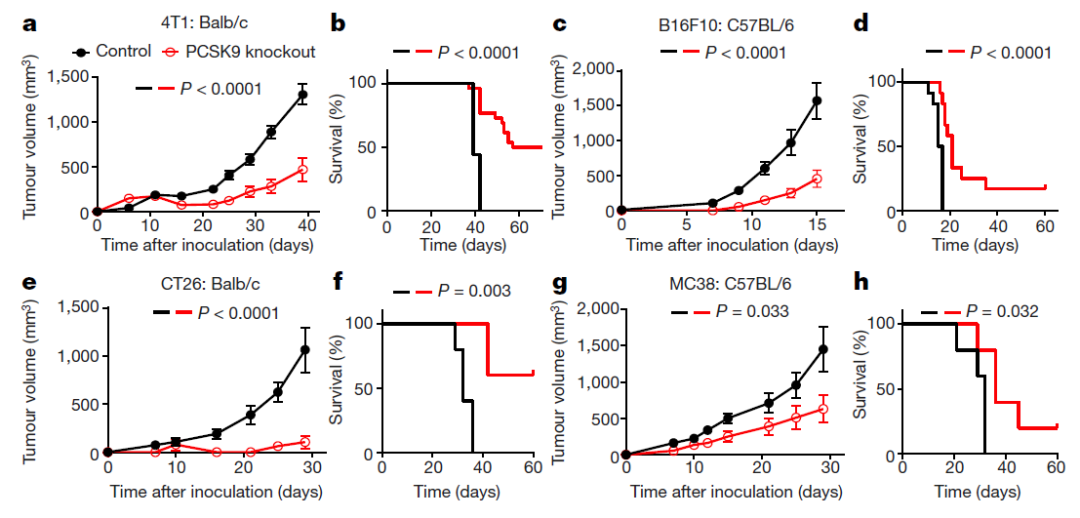
图1:PCSK9敲除的肿瘤细胞在免疫正常小鼠中生长受到显著抑制
在进一步的研究中,研究人员发现,加用PD-1抗体治疗敲除PCSK9的B16F10和MC38荷瘤小鼠可以进一步抑制肿瘤生长,并且显著提高了肿瘤缓解率,延长了无瘤总生存。这些研究结果表明,抑制PCSK9增强的小鼠抗肿瘤免疫应答可以进一步与免疫检查点疗法相协同,从而形成持久的抗肿瘤免疫疗效。
在此基础上,团队尝试了利用PCSK9抗体来替代CRISPR-Cas9基因编辑技术抑制PCSK9,并且在MC38小鼠结肠癌模型中观察PCSK9抗体和PD-1抗体联合疗法是否有协同效果。在该动物模型中,研究人员分别将目前临床上使用的两种PCSK9抗体(Evolocumab和Alirocumab)与PD-1抗体协同治疗MC38荷瘤小鼠,结果发现在PCSK9抗体与PD-1抗体联合治疗组中,有40-50%的小鼠可以达到长期无瘤生存。
这个发现也从另一个角度论证了,无论是通过基因编辑技术还是中和抗体,抑制PCSK9可以显著增强小鼠的抗肿瘤免疫应答,并且都能与免疫检查点疗法相互协同,增强疗效(图2)。
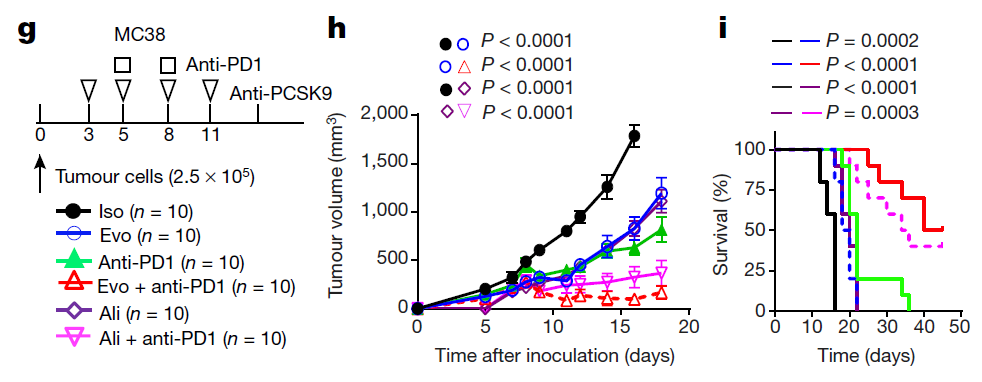
图2:PCSK9中和抗体可以与PD-1抗体相互协同,增强抗肿瘤免疫疗效。(Evo:Evolocumab;Ali:Alirocumab)
为了深入阐明抑制PCSK9是如何增强抗肿瘤免疫应答的,研究人员发现PCSK9敲除的肿瘤内部的免疫细胞浸润显著增强,尤其是在抗肿瘤免疫中起到重要作用的细胞毒T细胞显著增多,而且T细胞受体测序分析也发现PCSK9敲除的肿瘤内部的T细胞受体克隆多样性显著增高。而一旦用中和抗体预先清除小鼠体内的CD8+ T细胞,则会消除抑制PCSK9所引起的抗肿瘤免疫应答,提示抑制肿瘤细胞的PCSK9可以招募大量多样性的细胞毒T细胞可能是其发挥抗肿瘤免疫的重要作用之一。
接着,研究人员根据前期文献报道细胞毒T细胞可以调控许多细胞表面受体蛋白,如LDLR,VLDLR,CD36等在溶酶体内的降解,而递呈抗原给CTL的主要组织相容性复合体I(MHC I)的合成和代谢也与溶酶体相关。于是团队提出假设,PCSK9可能参与了调控MHC I在肿瘤细胞中的表达从而影响肿瘤细胞对于自身肿瘤抗原递呈给浸润的细胞毒T细胞。
随后,团队通过一系列实验揭示了PCSK9可以与MHC I直接相互作用,并且可以参与调控MHC I分子在溶酶体内的降解,而抑制PCSK9则可以有效减少MHC I在溶酶体中的降解,显著提高肿瘤细胞表面MHC I的表达和抗原递呈,从而增强机体抗肿瘤免疫应答(图3)。

图3:Pcsk9介导的MHC I在溶酶体中降解的可能机制
总体来看,这项重要研究着眼于胆固醇代谢的调节因子PCSK9作为非传统意义上的抗肿瘤免疫应答的靶点,阐明了抑制PCSK9可以通过提高肿瘤细胞MHC I表达的作用机制,招募更多的浸润细胞毒T细胞对肿瘤细胞进行有效杀伤,从而增强了机体对肿瘤的免疫应答,并且可以和免疫检查点疗法相协同而使荷瘤小鼠达成长期的肿瘤缓解。
鉴于PCSK9的中和抗体已经被批准用于临床治疗,这将十分有利于未来将PCSK9抑制疗法联合免疫检查点疗法推向临床应用,给予癌症患者新的潜在有效的免疫治疗选择。
特别值得称道的是,此项研究由美国杜克大学Chuan-Yuan Li课题组与中山大学医学院,复旦大学肿瘤医院,及上海交通大学附属第一人民医院科研人员共同完成。文章的共同第一作者为刘新建博士和鲍旭辉博士。其中,刘新建博士于2019年作为中山大学百人计划入选者从美国杜克大学加盟中山大学医学院并建立肿瘤治疗应答调控机制实验室。
论文链接:
来源:Bio生物世界
查看更多