查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





这里介绍北京协和医院肾内科艾三喜医师、秦岩教授2024年10月于《Frontiers in Immunology》(IF=5.9)杂志发表的病例报道:Case report: Nephrotic syndrome and portal hypertensive ascites after allogeneic hematopoietic stem cell transplantation: a rare manifestation of chronic graft-versus-host disease
╱ 病例介绍 ╱
患者男性,45岁,因“造血干细胞移植术后2年,蛋白尿、腹水21月”于2022年入院评估。患者于2020年7月因EB病毒相关噬血细胞综合征,行异基因造血干细胞移植(allo-HSCT)。移植后患者应用环孢素、霉酚酸酯和甲氨蝶呤预防移植物抗宿主病(GVHD)。移植后一个月,患者出现急性皮肤和胃肠道GVHD,甲泼尼龙、环孢素及芦可替尼治疗后缓解。移植后四个月患者减停免疫抑制剂后出现水肿、蛋白尿、高血压、门静脉高压性腹水,诊断性抗结核治疗无效,两年内逐渐进展至肾病综合征伴肾功能不全。
Allo-HSCT 2年后,患者就诊我院。实验室检查提示正常细胞性贫血,血涂片未见破碎红细胞。腹水符合门静脉高压性腹水(SAAG 22g/L),病原学检查阴性。肝功能检查提示胆管酶升高,增强CT提示门静脉高压,但无肝硬化或肝静脉闭塞病的典型表现。Coombs'试验和多种自身抗体阳性(ANA、抗dsDNA、c-ANCA),伴C反应蛋白和细胞因子(IL-6、TNF-α)升高,但不能诊断结缔组织病。抗磷脂酶A2受体抗体、单克隆免疫球蛋白、肿瘤及感染筛查均未见异常。
该患者行肾穿刺活检,光镜提示血栓性微血管病(TMA)和钉突形成(图1)。免疫荧光显示IgG、C1q、C4d沿毛细血管襻颗粒状沉积,磷脂酶A2受体和EBER染色均阴性。电镜下可见内皮细胞肿胀、内皮下间隙增宽,上皮下及系膜区电子致密物沉积(图2)。肾脏病理提示膜性肾病和TMA并存。在排除药物、感染、结缔组织病、肿瘤、TTP、HUS等病因后,考虑慢性GVHD相关膜性肾病和肾脏TMA可能性大。
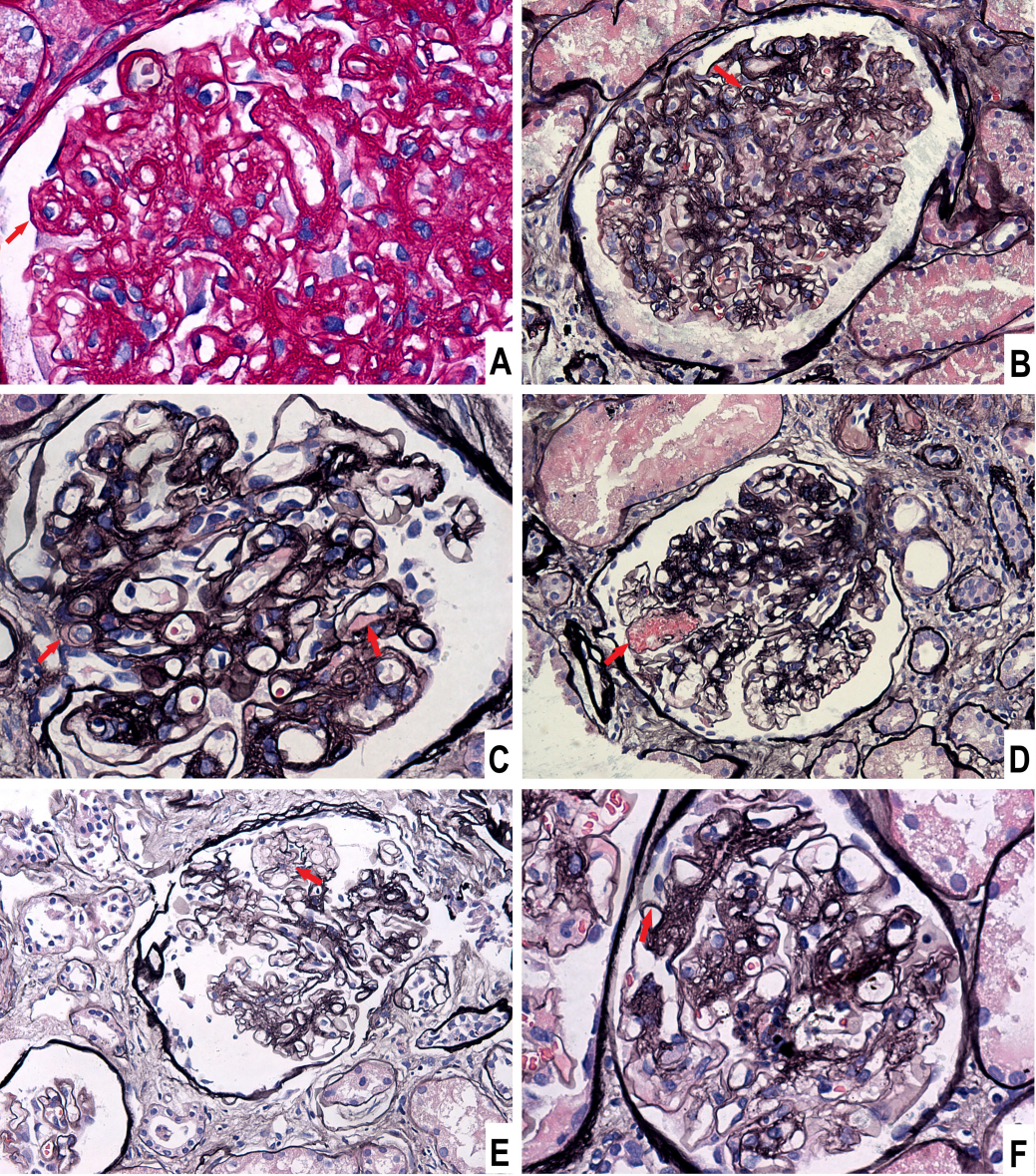
图1 肾小球的光镜表现
(A) 内皮细胞肿胀及内皮下间隙增宽,PAS染色,放大倍数×400;(B) 肾小球基底膜双轨征,PASM染色,×200;(C) 内皮下渗出,PASM染色,×400;(D) 毛细血管瘤,PASM染色,×200;(E) 系膜溶解,PASM染色,×200;(F) 节段性“钉突”,PASM染色,×400。
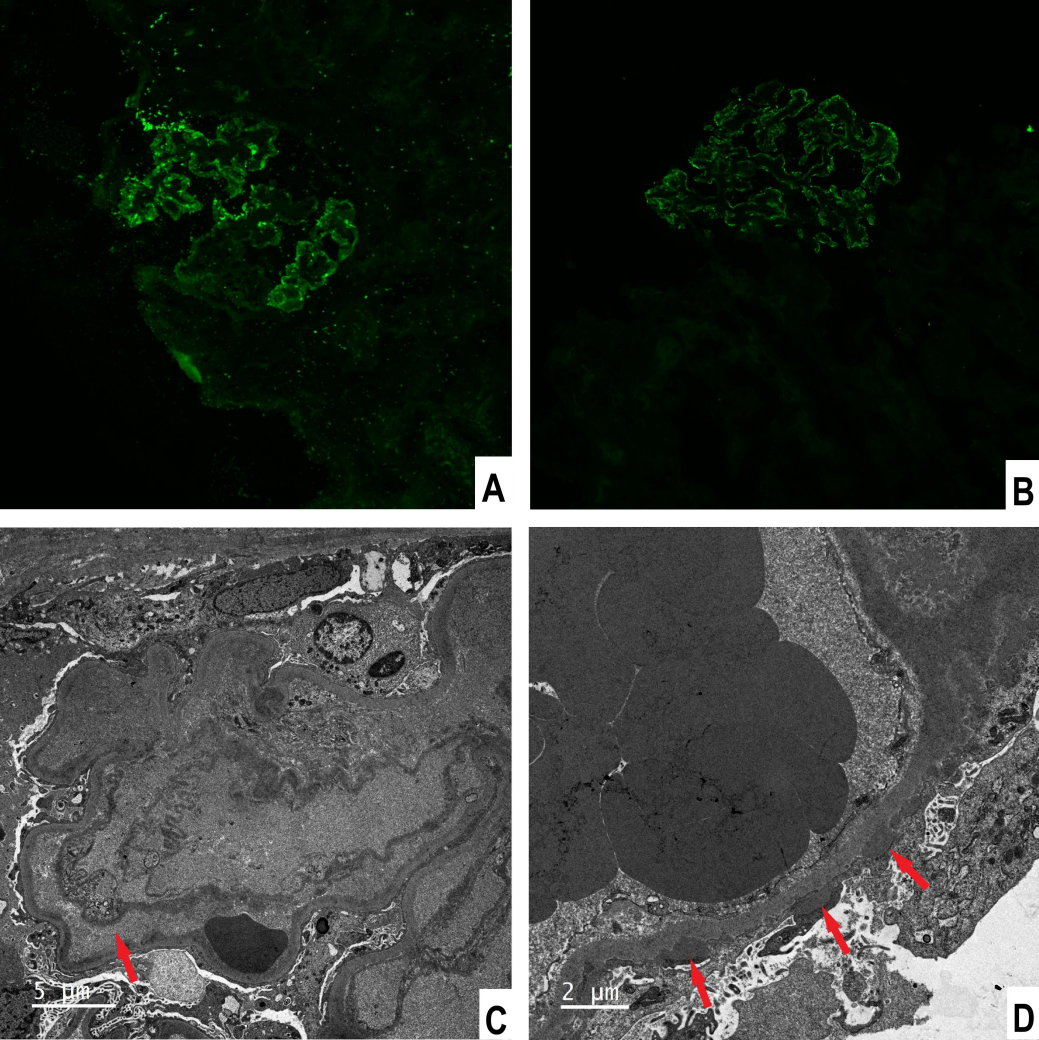
图2 免疫荧光染色及电镜表现
(A) IgG沿肾小球毛细血管襻细颗粒状沉积,放大倍数×200;(B) C4d沿肾小球毛细血管襻沉积,×200;(C) 内皮细胞肿胀伴内皮下间隙增宽,电镜×4000;(D) 上皮下电子致密物沉积,电镜×4000。
治疗方面,起初予泼尼松龙55mg qd口服,患者贫血短期内改善,但因药物性肝损伤和股骨头坏死,2周后减停激素。2022年10月起予JAK1/2抑制剂芦可替尼5mg bid口服,5个月后肾病综合征部分缓解,腹水和门静脉高压亦缓解。芦可替尼减量至5mg qd后再发大量蛋白尿,恢复5mg bid治疗后再次部分缓解,治疗18个月后减至5mg qd维持,患者病情稳定。
╱ 讨论 ╱
慢性GVHD非典型表现的识别与干预
1. 慢性GVHD的肾脏表现
慢性GVHD是异基因造血干细胞移植后最常见的远期并发症,主要累及上皮系统(如皮肤、眼、口腔等),但亦可表现为非典型器官受累,如肾脏、血管内皮、浆膜等。
HSCT后肾病综合征的发病率为0.4%-6.0%,通常发生在免疫抑制剂减量或停药后,是慢性GVHD的肾脏表现。HSCT后肾病综合征最常见的病理类型为膜性肾病,特点为上皮下免疫复合物沉积,提示抗体介导的肾损伤。研究提示,原钙黏蛋白1是与HSCT后膜性肾病相关的自身抗原。多种因素可能导致HSCT后TMA,部分病例与急性或慢性GVHD相关,这些病例通常无系统性TMA表现。 HSCT后膜性肾病合并肾脏TMA罕见报道 ,既往文献仅报道过1例。
2. 慢性GVHD的肝脏表现
慢性肝脏GVHD可表现为急性肝炎或缓慢进展的胆汁淤积型肝病,本患者肝脏表现更符合后者。HSCT后非肝硬化性门静脉高压性腹水在文献中罕见报道,主要见于静脉闭塞病,少数与慢性肝GVHD相关,其余为特发性门静脉高压。慢性肝脏GVHD的组织学特征是进行性胆管缺失和纤维化。由于患者肾活检显示内皮损伤,且血管内皮是GVHD的靶器官之一,我们推测GVHD继发的门静脉或肝窦内皮损伤可能导致患者的门静脉高压。
3. 慢性GVHD相关自身免疫性溶血性贫血
本患者在移植后出现正常细胞性贫血,伴Coombs‘试验以及多种自身抗体阳性,激素治疗后贫血明显改善,提示自身免疫性溶血性贫血。自身免疫性溶血也是慢性GVHD的一种非典型表现。
4. 治疗策略的选择与前景
慢性GVHD相关膜性肾病的治疗主要包括糖皮质激素联合免疫抑制剂或B细胞靶向治疗(如利妥昔单抗)。HSCT后TMA则缺乏统一治疗方案,有研究报道补体抑制剂和利妥昔单抗的有效性。由于钙调蛋白抑制剂可能引起TMA,HSCT相关TMA时通常会停用此类药物,但仍存在争议。GVHD相关门静脉高压性腹水的治疗数据稀少,仅有个案报道伊布替尼的成功经验。
本例患者由于存在股骨头坏死、肾脏TMA,未选择激素、钙调磷酸酶抑制剂。因担心B细胞清除后感染风险,未选择利妥昔单抗。芦可替尼是一种选择性JAK1/2抑制剂,是激素难治性慢性GVHD的一线治疗药物,但此前尚无用于治疗肾病综合征或门脉高压的报道。考虑患者存在细胞因子升高,细胞因子在慢性GVHD中的作用以及芦可替尼通过抑制细胞因子信号通路治疗慢性GVHD的疗效,我们尝试使用芦可替尼,治疗反应提示芦可替尼对这两种慢性GVHD的非典型表现的有效性。
╱ 结论 ╱
本病例提示,移植后患者出现肾病综合征和门静脉高压,应警惕其为慢性GVHD的非典型表现。JAK抑制剂在治疗此类非典型GVHD表现中显示出潜在疗效,值得进一步临床探索与研究。
来源 大内和协
作者 艾三喜 秦岩
策划&审核 孙雪峰
执行主编 徐燕
主编 李雪梅 康红
查看更多