查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





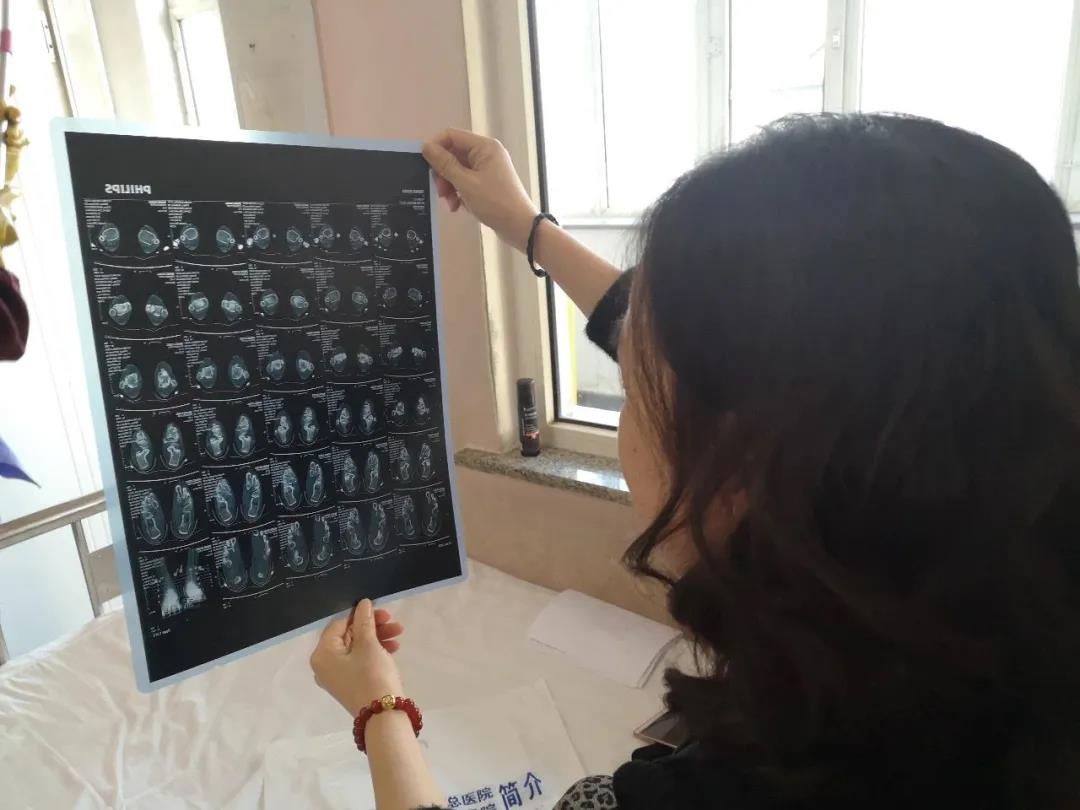
▲2019年1月21日,“布病”患者杨荣展示她拍下的磁共振,脚踝周围有黑影。新京报记者 吴靖 摄
兰州“布病”事件持续引发舆论关注。11月5日晚,兰州市召开兽研所布鲁氏菌抗体阳性事件属地善后处置工作新闻发布会。会上披露,截至4日,对55725人进行了检测,省级复核确认阳性人员6620人。官方称将对这些人免费治疗“终身负责”,目前涉事的中牧兰州生物药厂已与337名布鲁氏菌抗体阳性人员签订补偿赔偿协议,并支付补偿赔偿款235.46万元。8名责任人因此受到处理。

▲兰州通报布鲁氏菌抗体阳性善后处置:原疫苗车间已拆 377人已签补赔协议。
官方的调查结论是,这是一次意外偶发事件,是短时间内出现的一次暴露。2019年12月7日,兰州生物药厂关停了布鲁氏菌病疫苗生产车间,2020年10月8日,拆除了该生产车间,并完成了环境消杀和抽样检测,同时处理了8名责任人。
━━━━━
该汲取的教训要汲取
复盘此事,看似起于偶然:2019年7月24日至8月20日,兰州生物药厂在兽用布鲁氏菌疫苗生产过程中使用过期消毒剂,致使生产发酵罐废气排放灭菌不彻底,携带含菌发酵液的废气形成含菌气溶胶排放,生产时段该区域主风向为东南风,兰州兽研所位于兰州生物药厂的下风向,造成兰州兽研所发生布鲁氏菌抗体阳性事件,此后周边居民区也有大量民众感染布鲁氏菌。
一次意外事件,造成6620人布鲁氏菌抗体阳性,算得上是一次小规模的传染病传播,也是一次生物安全事故。尽管事发后,官方对感染者采取了善后动作,也处理了相关责任人,但如何亡羊补牢,提升生物安全能力,值得认真总结。
首先要看到的是,此次事故起于对生物安全原则的漠视。从生物安全角度看,凡是从事生物技术研究、生物产品生产的机构和人员,都必须遵守安全原则,其中,严防研究机构和生产厂家自身的污染和对周边环境的污染是重中之重。而选择研究和生产的地址,必须要远离城市和人口密集区。
事实上,涉事生物药厂是把厂区建造在居民区,离该药厂最近的居民小区与药厂直线距离在50米以内。而且,兰州生物药厂和兰州兽研所周边都是居民小区,一旦发生病原体从空气、水源等污染,就会造成广泛的疾病传播,酿成严重后果。最终结果也显示,毗邻的居民小区是兰州“布病”事件中人数感染最多也最为严重的小区。
如今当地官方对此也有了清醒认识,表示要督促兰州生物药厂进一步加快整厂搬迁和出城入园工作进度,从源头上消除隐患。鉴于此,对于当初建厂选址时是否实施了环境和生物安全评估,评估是否妥当,有必要展开调查。
需要反思的,还有事故发生后的处置环节:事发后,当时负责调查的专家组称,气溶胶飘散距离有限,大规模感染不会发生;人体暴露的剂量很低,弱毒性疫苗菌株进入人体后3-6个月就会衰减;即使出现症状,只要规范治疗,预后也是良好的。这两天,央广网还曝出多名确诊“布病”患者被当地卫健委提供“健康证明”。
“布病”要早发现早治疗,初期是最佳治疗窗口期。这些结论很可能贻误治疗。虽然现在去评判当时结论有“事后诸葛亮”之嫌,但结合当下大量人群感染的情况,梳理当时的过失仍很有必要。这也不乏警示意义:对传染病传播,要秉持“最坏预设”,做好安全冗余设计。

━━━━━
生物产业须严格遵守规范
此事对今后兴建所有类似药厂及生物实验室等也不无启示意义:为了杜绝生物安全事故发生,当避免在城市和人口密集区、小区建厂,以防万一。
由农业农村部于2020年4月2日审议通过并于2020年6月1日实施的《兽药生产质量管理规范》要求,“厂房的选址、设计、布局、建设、改造和维护必须符合兽药生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。”下一步可以考虑把避免在城市和居民区附近建造兽药厂或其他高生物活性、高毒性、强污染性、高致敏性研究机构和生产厂家写进“规范”中。
亡羊补牢,还需从科学规范上找原因。《兽药生产质量管理规范》提出,对生产、原料、设备、生产人员、工序等均应按生产和空气洁净度级别的要求进行清洁操作,包括清洁方法、程序、间隔时间,使用的清洁剂或消毒剂,清洁工具的清洁方法和存放地点等,对工厂环境和生产排放的废物废气进行清洁处理时,“清洁方法应当经过验证,证实其清洁效果,以有效防止污染和交叉污染”。
但涉事生物药厂在兽用布鲁氏菌疫苗生产过程中使用过期的消毒剂,且没有验证消毒方法的有效,致使生产发酵罐废气排放灭菌不彻底,携带含菌发酵液的废气形成含菌气溶胶,排放到周边环境,致使这么多人染病。
这也表明,不按照科学规范和程序进行生物研究和生物产品的生产,风险与后果不容小觑。鉴于此,相关生物产业与研究机构必须将这方面法规、制度、章程落到实处——那样也是对民众健康和生命安全负责。
无论如何,针对此事,要“吃一堑长百智”。
来源:新京报
查看更多