查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





类风湿关节炎(RA)是一种以破坏性关节炎为特征的慢性自身免疫性疾病[1],影响全球0.5–1%的人口[2],常伴有多种关节外并发症。间质性肺疾病(ILD)是RA患者最严重的关节外并发症之一[3], 是RA发病和死亡的主要原因[4],ILD在RA患者中的患病率高达60%,约10%的患者存在有症状或临床意义的ILD[5]。有研究表明,RA-ILD患者的10年死亡率高达60%[6],确诊后中位生存期仅有3-7年[7]。目前对于RA-ILD的识别、诊断、监测和治疗尚无指南推荐,本文将基于最新的研究进展和综述系统阐述RA-ILD的诊疗管理。
专家简历

刘升云 教授
郑州大学第一附属医院
郑州大学第一附属医院风湿免疫科主任
中华医学会风湿病学分会常务委员
中国医师协会风湿免疫科医师分会常务委员
河南省风湿病学会主任委员
RA-ILD的临床特征和危险因素
ILD可发生在 RA 病程的任何阶段[8]。RA-ILD的主要临床症状包括劳力性呼吸困难和慢性干咳,其他临床主诉是疲劳和全身无力[4]。在高分辨率计算机断层扫描(HRCT)或组织学检查中最常见的模式是普通型间质性肺炎(UIP)和非特异性间质性肺炎(NSIP)[9, 10]。RA-ILD的临床病程多变,无法预测,有些患者病情稳定,而有些患者可发生疾病进展,称为进展性肺纤维化(PPF),表现为影像学上纤维化增加、肺功能下降、症状恶化和早期死亡[8]。PPF定义为:在确诊为非特发性肺纤维化(IPF)的纤维化性ILD的患者中,排除任何其他原因后,一年内发生临床和/或生理功能和/或影像学中至少两个领域的进展(见表1)[11]。大约有三分之一的RA-ILD患者会发生PPF,尤其是HRCT表现为UIP模式时。PPF与死亡率增加和不良预后有关[12]。
表1. PPF的定义
预测RA-ILD发生的危险因素包括年龄较大、男性、吸烟、活动性滑膜炎、类风湿因子/抗环瓜氨酸肽抗体阳性以及MUC5B基因的多态性等[8]。由于 PPF是RA-ILD管理中的主要问题,因此需要早期识别有发展为PPF风险的患者[12], RA-ILD 患者发生疾病进展的预测因素包括:年龄较大、男性、28个关节疾病活动度评分(DAS28)较高、UIP 模式或 HRCT上ILD范围扩大,以及血液中涎液化糖链抗原-6(KL-6)、类风湿因子或抗环瓜氨酸肽抗体水平升高。风湿科专家应高度关注伴有危险因素RA患者的肺部受累情况[8]。
RA-ILD的筛查和诊断
由于ILD可发生在RA诊断之前,在确诊RA-ILD时,患者的肺功能可能已经严重受损,早期发现和评估RA-ILD对于把握治疗时机非常重要。RA-ILD理想的筛查工具应该是在临床环境中易于使用、适用于资源有限的地区,并能引导ILD风险最高的患者及时接受HRCT检查。然而,对于哪些RA患者应接受ILD筛查尚未达成共识,也未发布筛查指南[8]。风湿免疫科医生在对RA患者进行ILD筛查方面起着关键作用。应筛查所有RA患者的肺部受累症状(如用力呼吸困难、干咳),并在每次就诊时进行肺部听诊[8]。
虽然RA-ILD患者常见的临床症状包括呼吸困难和咳嗽[13],但有些患者仍然无症状表现[14-16]。关节疾病可能会限制患者的活动能力,并掩盖用力时出现的呼吸困难。这意味着,仅对有症状的患者进行筛查会导致很大一部分病例被漏诊[8]。此外,仅根据肺功能检查(PFTs)进行筛查也会导致漏诊RA-ILD病例,因为许多经HRCT检查患有RA-ILD患者的用力肺活量(FVC)占预计值%接近正常值[17, 18]。
HRCT是筛查ILD的金标准,但不可能让所有RA-ILD患者都接受HRCT检查,也不可能频繁重复HRCT检查[8]。目前越来越多的证据[19-21]表明,肺部超声可作为检测是否存在ILD的有用工具,并可优化进行HRCT的时机,避免患者长期暴露于高辐射剂量,但还需要在大量RA患者中验证肺部超声检测ILD的灵敏度,尚不能将其作为HRCT的替代检查项目[8]。
对疑似RA-ILD的诊断评估通常包括PFTs、影像学检查,有时还包括支气管肺泡灌洗。诊断ILD的金标准是HRCT检查。UIP是最常见的模式,具有纤维化特征,包括网状结构、牵拉性支气管扩张和蜂窝状改变。非特异性间质性肺炎(NSIP)较少见,具有网状结构和主要的炎症特征,如磨玻璃影[22, 23]。也可见其他模式,如组织性肺炎[9, 24, 25]。
RA-ILD的监测
对RA-ILD患者进行监测对于及时发现ILD进展至关重要,在实践中,监测主要是由风湿科专家在患者常规门诊就诊时进行。尽管对于如何监测RA-ILD患者尚未达成共识,但合理的方法是在每次门诊时询问患者是否出现新的或进展性呼吸道症状,每3到6个月测量一次FVC和DLco,每年进行一次HRCT(如果症状或生理状况恶化,则提前进行)[8]。
然而,RA-ILD中HRCT检查的许多问题仍有待解决,包括扫描判读时阅片者间差异以及确定随访HRCT的最佳时间间隔。因此,研究者对使用自动量化计算机断层扫描(CT)评估ILD的严重程度和进展越来越感兴趣[8]。
PFTs虽然是最常用于评估RA-ILD患者肺功能纵向变化的指标,但也存在局限性:患有胸肌无力或肋软骨炎的患者可能无法准确完成测量[8]。肺气肿的存在(会增加肺容积的测量值)可能会影响 PFTs测量ILD严重程度或进展情况的能力[26]。不过,对于中度至重度肺部疾病患者,临床症状和PFTs可能比HRCT更能敏感地检测到细微的恶化。虽然在现有的监测流程中,关于HRCT和PFTs如何使用尚未达成一致,但这两种方法是互补的, 在RA-ILD患者的随访中都很重要[8]。
RA-ILD的治疗
近几十年,整体医疗水平不断进步,RA的治疗策略有了较大改善,改善病情抗风湿药物(DMARDs)和糖皮质激素已成为RA的标准治疗方法[27],但RA-ILD的治疗仍是一个挑战[5]。目前国际科学协会还没有专门针对RA-ILD患者开始或升级治疗的指南。仍不清楚何时应开始治疗RA-ILD以改变病程[8],RA-ILD的最佳治疗选择尚未确定,目前可用的证据有限。大多数RA患者使用免疫调节疗法,但目前尚缺乏随机对照试验证实免疫抑制剂在RA-ILD中的疗效。尽管缺乏证据,但糖皮质激素经常被使用,并且似乎是有效的[12]。
甲氨蝶呤(MTX)是治疗RA的锚定药物,但过去曾认为MTX可能引起RA-ILD加重或过敏性肺炎,从而限制了其在RA-ILD中的应用[28]。近些年来,越来越多的研究提示MTX实际上并未引起RA-ILD的加重,反而能延缓RA-ILD的发生和发展。一项多中心、前瞻性队列研究[29]纳入2701例RA患者,结果显示接受MTX治疗可以降低RA-ILD的发生风险[OR=0.48,(95%CI:0.30-0.79),p=0.004],并且延迟RA-ILD的发生(OR=0.41,[95%CI:0.23-0.75],p=0.004)。同样,一项纳入170例RA-ILD患者的回顾性研究显示,MTX能延缓RA-ILD患者的肺功能下降并降低死亡率[30]。因此,基于MTX在RA-ILD患者中越来越多的安全性证据[31],2021年美国风湿病学会(ACR)颁布的RA治疗指南建议,对于合并轻度和稳定的气道或实质性肺病的RA患者,有条件地推荐使用甲氨蝶呤[32]。
关于其他传统合成DAMRDs治疗RA-ILD的研究相对较少。一项荟萃分析显示,来氟米特对RA患者的ILD等呼吸系统疾病没有不良影响[33]。此外,一些观察性研究提示,吗替麦考酚酯、环磷酰胺、钙调磷酸酶抑制剂对RA-ILD可能有效[34-36],但尚需随机、双盲、安慰剂对照试验进一步证实。
近些年来,生物制剂和JAK抑制剂已广泛用于RA的治疗。目前,关于肿瘤坏死因子-α(TNF-α)抑制剂对RA-ILD的影响尚有争议。多项研究显示,TNF-α抑制剂的使用可能与RA-ILD的新发或恶化有关[37,38]。但也有研究提示TNF-α抑制剂并未增加RA患者ILD的发生率[39]。英国风湿病学会建议,对于合并ILD的RA患者需谨慎使用TNF-α抑制剂[40]。
利妥昔单抗是一种抗CD20单克隆抗体,已被批准用于RA的治疗。一项研究[41]评估了利妥昔单抗作为进展性RA-ILD患者挽救治疗的长期疗效,结果显示,利妥昔单抗能够改善肺功能,并有助于减少泼尼松的使用剂量,提示利妥昔单抗可作为进展性RA-ILD患者的挽救治疗。同样,一项纵向多中心研究(NEREA登记研究)显示,利妥昔单抗有助于延缓RA-ILD的进展[42]。
阿巴西普是一种T淋巴细胞共刺激拮抗剂,通过阻断共刺激信号,抑制T淋巴细胞的活化,以减轻RA的炎症反应[43]。一项大型多中心观察性研究纳入263例接受阿巴西普治疗的RA-ILD患者,随访12个月,结果显示,近90%的患者肺功能稳定或有所改善,77%的患者放射学表现稳定或改善[44]。另有一项荟萃分析显示,与TNF抑制剂和csDMARDs相比,接受阿巴西普治疗的RA患者出现ILD恶化的相对风险降低了90%[45]。最近的一项前瞻性多中心研究显示,接受阿巴西普治疗的RA-ILD患者中,71%的患者肺功能和关节症状稳定,且具有良好的安全性[46]。
IL-6具有促纤维化作用,而托珠单抗作为一种IL-6受体拮抗剂, 从理论上来说对RA-ILD的治疗具有潜在益处,但目前研究相对较少。一项多中心回顾性研究纳入28例接受托珠单抗治疗的RA-ILD患者,平均随访30个月,结果显示,56%的患者肺功能保持稳定,20%的患者肺功能得到改善,且安全性良好[47]。
关于JAK抑制剂治疗RA-ILD研究仍相对较少,最近的一项回顾性研究纳入28559例RA患者,结果显示,与生物制剂相比,托法替布显著降低RA患者ILD的发生风险[48]。尚需更多前瞻性研究来证实托法替布在RA-ILD中的作用。
对于RA-ILD抗纤维化药物的选择,基于INBUILD研究,尼达尼布已被批准用于治疗PPF[49],且被2022年5月发布的ATS/ERS/JRS/ALAT临床实践指南推荐用于PPF的治疗[11]。
INBUILD研究是一项在15个国家、663例PPF患者中进行的随机、双盲、安慰剂对照试验,旨在评估尼达尼布在PPF患者中的疗效和安全性。总体而言,在52周内,尼达尼布组的FVC年下降率为-80.8 mL/年,而安慰剂组为-187.8 mL/年,尼达尼布相比安慰剂将PPF患者的FVC年下降率降低了57%[50]。
最近来自INBUILD研究的亚组分析评估了尼达尼布对发生PPF的RA-ILD的影响, 在663例患者中,89例(13.4%)患有RA-ILD,在52周内,尼达尼布组的FVC年下降率为−82.6 mL/年,而安慰剂组为−199.3 mL/年(差异116.7 mL/年;[95% CI:7.4-226.1];p=0.037)(见图1)。在基线时服用DMARDs和/或糖皮质激素的RA-ILD患者中,尼达尼布组(n=39)的FVC年下降率为−90.4 mL/年,而安慰剂组(n=40)为−228.3 mL/年(差异137.9 mL/年,[95%CI:23.4-252.5])。在发生ILD急性加重或死亡方面,尼达尼布组发生率低于安慰剂组(19.0% vs. 31.9%)。该研究表明:与安慰剂相比,尼达尼布在52周内将发生PPF的RA-ILD患者的FVC年下降率降低了59%[51]。
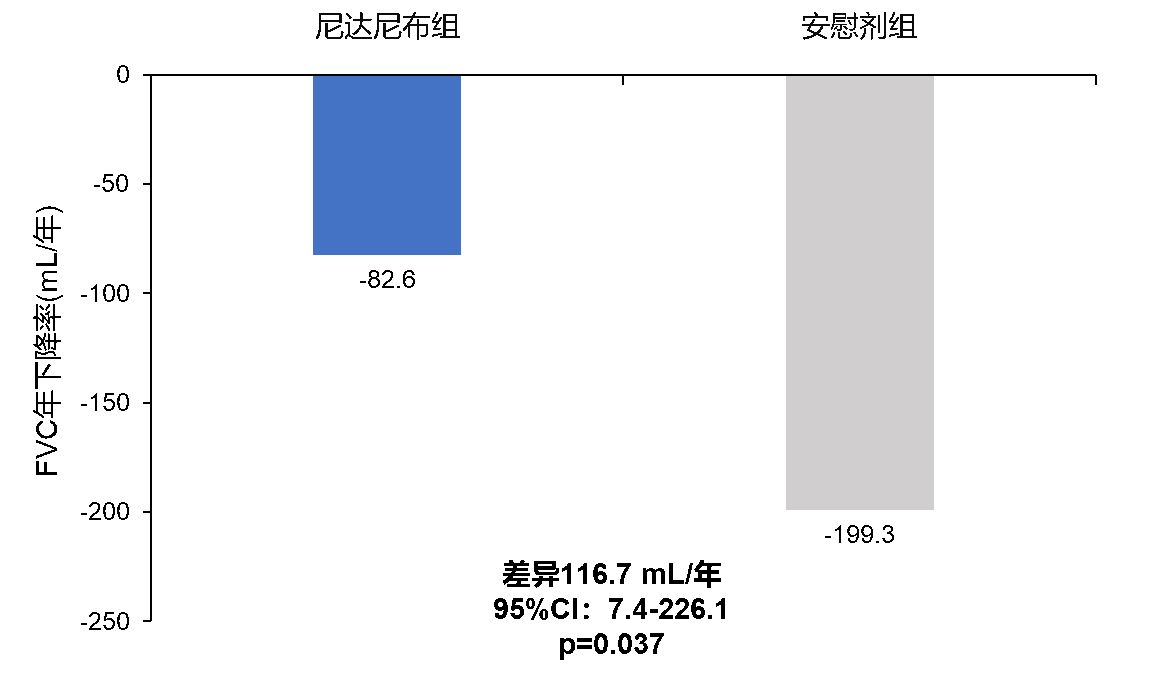
图1. RA-ILD患者在52周内的FVC年下降率
国际心肺移植学会更新的指南建议[52],对于经适当治疗无效且病情进展严重的RA-ILD患者,如果没有肺外禁忌症,应考虑进行肺移植。同时,RA-ILD患者可从非药物疗法中获益,包括肺康复,氧疗和临终关怀等。应提供流感、肺炎和 COVID-19 疫苗接种以及戒烟建议[8]。
RA-ILD的治疗应根据患者的需求进行个体化,基于多学科评估其ILD的严重程度和进展、关节症状和RA的其他表现以及合并症, 为此,提出了一个RA-ILD的管理办法(见表2)。风湿免疫科医生和肺科医生之间的密切合作至关重要。风湿免疫科医生在处理 ILD 时不应仅考虑关节症状不严重而掉以轻心,因为轻度RA患者也可能发生PPF[8]。
表2. RA-ILD管理办法

对于RA-ILD患者来说,早期发现和定期监测至关重要,治疗目标应该是缓解RA和阻止ILD进展,但在实践中,治疗决策往往是困难的。大多数RA患者使用免疫调节治疗,但其在延缓RA-ILD进展方面的疗效尚不清楚,抗纤维化药物尼达尼布已被批准用于治疗PPF患者,可延缓RA-ILD的疾病进展。RA-ILD患者的管理应多学科协作评估,并根据患者的ILD的严重性及进展情况、关节症状等进行个性化治疗,以期为每位患者选择最适合的治疗方案,改善患者的整体病程。
参考文献:
1.Chen N, Diao CY, Gao J, Zhao DB. Risk factors for the progression of rheumatoid arthritis-related interstitial lung disease: Clinical features, biomarkers, and treatment options. Semin Arthritis Rheum. 2022;55:152004.
2.Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016;388(10055):2023-38.
3.McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med. 2011;365(23):2205-19.
4.Dai Y, Wang W, Yu Y, Hu S. Rheumatoid arthritis-associated interstitial lung disease: an overview of epidemiology, pathogenesis and management. Clin Rheumatol. 2021;40(4):1211-20.
5.Liang M, Matteson EL, Abril A, Distler JHW. The role of antifibrotics in the treatment of rheumatoid arthritis-associated interstitial lung disease. Ther Adv Musculoskelet Dis. 2022;14:1759720X221074457.
6.Hyldgaard C, Hilberg O, Pedersen AB, Ulrichsen SP, Lokke A, Bendstrup E, et al. A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis. 2017;76(10):1700-6.
7.Hyldgaard C, Ellingsen T, Hilberg O, Bendstrup E. Rheumatoid Arthritis-Associated Interstitial Lung Disease: Clinical Characteristics and Predictors of Mortality. Respiration. 2019;98(5):455-60.
8.Koduri G, Solomon JJ. Identification, monitoring and management of rheumatoid arthritis-associated interstitial lung disease. Arthritis Rheumatol. 2023.
9.Zamora-Legoff JA, Krause ML, Crowson CS, Ryu JH, Matteson EL. Patterns of interstitial lung disease and mortality in rheumatoid arthritis. Rheumatology (Oxford). 2017;56(3):344-50.
10.Lee HK, Kim DS, Yoo B, Seo JB, Rho JY, Colby TV, et al. Histopathologic pattern and clinical features of rheumatoid arthritis-associated interstitial lung disease. Chest. 2005;127(6):2019-27.
11.Raghu G, Remy-Jardin M, Richeldi L, Thomson CC, Inoue Y, Johkoh T, et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2022;205(9):e18-e47.
12.Stainer A, Tonutti A, De Santis M, Amati F, Ceribelli A, Bongiovanni G, et al. Unmet needs and perspectives in rheumatoid arthritis-associated interstitial lung disease: A critical review. Front Med (Lausanne). 2023;10:1129939.
13.Gochuico BR, Avila NA, Chow CK, Novero LJ, Wu HP, Ren P, et al. Progressive preclinical interstitial lung disease in rheumatoid arthritis. Arch Intern Med. 2008;168(2):159-66.
14.Chen J, Shi Y, Wang X, Huang H, Ascherman D. Asymptomatic preclinical rheumatoid arthritis-associated interstitial lung disease. Clin Dev Immunol. 2013;2013:406927.
15.Kanat F, Levendoglu F, Teke T. Radiological and functional assessment of pulmonary involvement in the rheumatoid arthritis patients. Rheumatol Int. 2007;27(5):459-66.
16.Kawano-Dourado L, Doyle TJ, Bonfiglioli K, Sawamura MVY, Nakagawa RH, Arimura FE, et al. Baseline Characteristics and Progression of a Spectrum of Interstitial Lung Abnormalities and Disease in Rheumatoid Arthritis. Chest. 2020;158(4):1546-54.
17.Bilgici A, Ulusoy H, Kuru O, Celenk C, Unsal M, Danaci M. Pulmonary involvement in rheumatoid arthritis. Rheumatol Int. 2005;25(6):429-35.
18.Chang SH, Lee JS, Ha YJ, Kim MU, Park CH, Lee JS, et al. Lung function trajectory of rheumatoid arthritis-associated interstitial lung disease. Rheumatology (Oxford). 2023;62(9):3014-24.
19.Moazedi-Fuerst FC, Kielhauser SM, Scheidl S, Tripolt NJ, Lutfi A, Yazdani-Biuki B, et al. Ultrasound screening for interstitial lung disease in rheumatoid arthritis. Clin Exp Rheumatol. 2014;32(2):199-203.
20.Mena-Vazquez N, Jimenez-Nunez FG, Godoy-Navarrete FJ, Manrique-Arija S, Aguilar-Hurtado MC, Romero-Barco CM, et al. Utility of pulmonary ultrasound to identify interstitial lung disease in patients with rheumatoid arthritis. Clin Rheumatol. 2021;40(6):2377-85.
21.Gutierrez M, Ruta S, Clavijo-Cornejo D, Fuentes-Moreno G, Reyes-Long S, Bertolazzi C. The emerging role of ultrasound in detecting interstitial lung disease in patients with rheumatoid arthritis. Joint Bone Spine. 2022;89(6):105407.
22.Tanaka N, Kim JS, Newell JD, Brown KK, Cool CD, Meehan R, et al. Rheumatoid arthritis-related lung diseases: CT findings. Radiology. 2004;232(1):81-91.
23.Nurmi HM, Kettunen HP, Suoranta SK, Purokivi MK, Karkkainen MS, Selander TA, et al. Several high-resolution computed tomography findings associate with survival and clinical features in rheumatoid arthritis-associated interstitial lung disease. Respir Med. 2018;134:24-30.
24.Salaffi F, Carotti M, Di Carlo M, Tardella M, Giovagnoni A. High-resolution computed tomography of the lung in patients with rheumatoid arthritis: Prevalence of interstitial lung disease involvement and determinants of abnormalities. Medicine (Baltimore). 2019;98(38):e17088.
25.Kelly CA, Saravanan V, Nisar M, Arthanari S, Woodhead FA, Price-Forbes AN, et al. Rheumatoid arthritis-related interstitial lung disease: associations, prognostic factors and physiological and radiological characteristics--a large multicentre UK study. Rheumatology (Oxford). 2014;53(9):1676-82.
26.Cottin V, Hansell DM, Sverzellati N, Weycker D, Antoniou KM, Atwood M, et al. Effect of Emphysema Extent on Serial Lung Function in Patients with Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med. 2017;196(9):1162-71.
27.Smolen JS, Landewe RBM, Bijlsma JWJ, Burmester GR, Dougados M, Kerschbaumer A, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann Rheum Dis. 2020;79(6):685-99.
28.Roubille C, Haraoui B. Interstitial lung diseases induced or exacerbated by DMARDS and biologic agents in rheumatoid arthritis: a systematic literature review. Semin Arthritis Rheum. 2014;43(5):613-26.
29.Kiely P, Busby AD, Nikiphorou E, Sullivan K, Walsh DA, Creamer P, et al. Is incident rheumatoid arthritis interstitial lung disease associated with methotrexate treatment? Results from a multivariate analysis in the ERAS and ERAN inception cohorts. BMJ Open. 2019;9(5):e028466.
30.Kim K, Woo A, Park Y, Yong SH, Lee SH, Lee SH, et al. Protective effect of methotrexate on lung function and mortality in rheumatoid arthritis-related interstitial lung disease: a retrospective cohort study. Ther Adv Respir Dis. 2022;16:17534666221135314.
31.Juge PA, Lee JS, Lau J, Kawano-Dourado L, Rojas Serrano J, Sebastiani M, et al. Methotrexate and rheumatoid arthritis associated interstitial lung disease. Eur Respir J. 2021;57(2).
32.Fraenkel L, Bathon JM, England BR, St Clair EW, Arayssi T, Carandang K, et al. 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Rheumatol. 2021;73(7):1108-23.
33.Conway R, Low C, Coughlan RJ, O'Donnell MJ, Carey JJ. Leflunomide Use and Risk of Lung Disease in Rheumatoid Arthritis: A Systematic Literature Review and Metaanalysis of Randomized Controlled Trials. J Rheumatol. 2016;43(5):855-60.
34.Swigris JJ, Olson AL, Fischer A, Lynch DA, Cosgrove GP, Frankel SK, et al. Mycophenolate mofetil is safe, well tolerated, and preserves lung function in patients with connective tissue disease-related interstitial lung disease. Chest. 2006;130(1):30-6.
35.Fischer A, Brown KK, Du Bois RM, Frankel SK, Cosgrove GP, Fernandez-Perez ER, et al. Mycophenolate mofetil improves lung function in connective tissue disease-associated interstitial lung disease. J Rheumatol. 2013;40(5):640-6.
36.Barnes H, Holland AE, Westall GP, Goh NS, Glaspole IN. Cyclophosphamide for connective tissue disease-associated interstitial lung disease. Cochrane Database Syst Rev. 2018;1(1):CD010908.
37.Kadura S, Raghu G. Rheumatoid arthritis-interstitial lung disease: manifestations and current concepts in pathogenesis and management. Eur Respir Rev. 2021;30(160).
38.Perez-Alvarez R, Perez-de-Lis M, Diaz-Lagares C, Pego-Reigosa JM, Retamozo S, Bove A, et al. Interstitial lung disease induced or exacerbated by TNF-targeted therapies: analysis of 122 cases. Semin Arthritis Rheum. 2011;41(2):256-64.
39.Herrinton LJ, Harrold LR, Liu L, Raebel MA, Taharka A, Winthrop KL, et al. Association between anti-TNF-alpha therapy and interstitial lung disease. Pharmacoepidemiol Drug Saf. 2013;22(4):394-402.
40.Ding T, Ledingham J, Luqmani R, Westlake S, Hyrich K, Lunt M, et al.. Guidelines Working Group of, and Bhpr, BSR and BHPR rheumatoid arthritis guidelines on safety of anti-TNF therapies. Rheumatology. (2010) 49:2217–9.
41.Narvaez J, Robles-Perez A, Molina-Molina M, Vicens-Zygmunt V, Luburich P, Yanez MA, et al. Real-world clinical effectiveness of rituximab rescue therapy in patients with progressive rheumatoid arthritis-related interstitial lung disease. Semin Arthritis Rheum. 2020;50(5):902-10.
42.Vadillo C, Nieto MA, Romero-Bueno F, Leon L, Sanchez-Pernaute O, Rodriguez-Nieto MJ, et al. Efficacy of rituximab in slowing down progression of rheumatoid arthritis-related interstitial lung disease: data from the NEREA Registry. Rheumatology (Oxford). 2020;59(8):2099-108.
43.Fernandez-Diaz C, Loricera J, Castaneda S, Lopez-Mejias R, Ojeda-Garcia C, Olive A, et al. Abatacept in patients with rheumatoid arthritis and interstitial lung disease: A national multicenter study of 63 patients. Semin Arthritis Rheum. 2018;48(1):22-7.
44.Fernandez-Diaz C, Castaneda S, Melero-Gonzalez RB, Ortiz-Sanjuan F, Juan-Mas A, Carrasco-Cubero C, et al. Abatacept in interstitial lung disease associated with rheumatoid arthritis: national multicenter study of 263 patients. Rheumatology (Oxford). 2020;59(12):3906-16.
45.Vicente-Rabaneda EF, Atienza-Mateo B, Blanco R, Cavagna L, Ancochea J, Castaneda S, et al. Efficacy and safety of abatacept in interstitial lung disease of rheumatoid arthritis: A systematic literature review. Autoimmun Rev. 2021;20(6):102830.
46.Mena-Vazquez N, Rojas-Gimenez M, Fuego-Varela C, Garcia-Studer A, Perez-Gomez N, Romero-Barco CM, et al. Safety and Effectiveness of Abatacept in a Prospective Cohort of Patients with Rheumatoid Arthritis-Associated Interstitial Lung Disease. Biomedicines. 2022;10(7).
47.Manfredi A, Cassone G, Furini F, Gremese E, Venerito V, Atzeni F, et al. Tocilizumab therapy in rheumatoid arthritis with interstitial lung disease: a multicentre retrospective study. Intern Med J. 2020;50(9):1085-90.
48.Baker MC, Liu Y, Lu R, Lin J, Melehani J, Robinson WH. Incidence of Interstitial Lung Disease in Patients With Rheumatoid Arthritis Treated With Biologic and Targeted Synthetic Disease-Modifying Antirheumatic Drugs. JAMA Netw Open. 2023;6(3):e233640.
49.尼达尼布说明书.
50.Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019;381(18):1718-27.
51.Matteson EL, Aringer M, Burmester GR, Mueller H, Moros L, Kolb M. Effect of nintedanib in patients with progressive pulmonary fibrosis associated with rheumatoid arthritis: data from the INBUILD trial. Clin Rheumatol. 2023;42(9):2311-9.
52.Leard LE, Holm AM, Valapour M, Glanville AR, Attawar S, Aversa M, et al. Consensus document for the selection of lung transplant candidates: An update from the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2021;40(11):1349-79.
审批号:SC-CN-14415
有效期至:10/29/2025
仅供相关医药专业人士进行医学科学交流
↓↓↓
查看更多