查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





以免疫检查点抑制剂(ICI)为代表的免疫治疗开启了继靶向药物后非小细胞肺癌(NSCLC)的第二次治疗变革。免疫治疗单药或联合化疗已全面整合进入晚期转移性NSCLC标准治疗体系,并不断向局晚期疾病拓展,前景极为乐观。
然而,如何筛选ICI治疗最佳获益人群也成为NSCLC临床治疗的当务之急。基于多项国际多中心大型临床研究,如KEYNOTE-042、KEYNOTE-010、IMpower110、CheckMate-227等研究显示,PD-L1可以有效筛选ICI疗效更佳人群。纵观2015-2020年美国食品和药物管理局(FDA)所批准的ICI伴随性诊断生物标志物中,最为常用、关注度最高的当属PD-L1[1]。
2019年,一项全球、多中心真实世界研究(EXPRESS)发布,为局晚期或转移性NSCLC患者的PD-L1表达情况提供了全面的图景。该研究部分结果显示,亚太地区晚期NSCLC患者的PD-L1表达水平与美洲地区人群存在差异[2]。
除此之外,目前获批用于临床使用、伴随性诊断的PD-L1检测平台多样,如Agilent 22C3 PharmDx、Dako ASL48、Ventana等,该如何选择检测平台,以及不同平台的检测结果是否存在互认性等问题都为ICI的临床使用带来了一定挑战。
来自北京肿瘤医院、华西医院、复旦大学肿瘤医院、中山大学肿瘤防治中心、南京鼓楼医院、浙江肿瘤医院等多家全国顶级医疗机构的EXPRESS II联合研究,从真实世界层面考察了我国晚期NSCLC患者PD-L1表达水平以及与多类临床特征之间的相关性,并对比了多种PD-L1检测平台结果的一致性,为临床实践提供了一手宝贵资料。
【解读专家】
李媛 教授
复旦大学附属肿瘤医院病理科
博士,主任医师,博士生导师
复旦大学胸部肿瘤研究所副所长
中华医学会病理学分会胸部学组 委员
中国抗癌协会肿瘤病理专委会常委、青年委员会副主任委员
中国抗癌协会肿瘤病理专委会胸部学组委员
中国女医师协会病理专委会常委
中国研究型医院学会病理学专业委员会青年委员会副主任委员
中国研究型医院学会分子肿瘤与免疫治疗专业委员会常委
上海抗癌协会青年理事
上海市临床病理质控中心胸部病理工作专家
中国临床肿瘤学会(CSCO) 青年委员
中国合格评定国家认可委员会(CNAS)评审员
多本国内外杂志审稿人
【解读专家】
蒋莉莉 教授
四川大学华西医院病理科副主任医师
博士,副主任医师,硕士导师
中华医学会病理分会胸部疾病学组委员
中华医学会病理分会教工组副组长
中国医师协会病理科医师分会青年委员会委员
四川省医学会病理学专业委员会委员
四川省医学会呼吸病专委会间质性肺疾病学组副组长
四川省肿瘤学会(SCS)肺癌专业委员会常务委员
专业方向:肺肿瘤及间质性疾病的病理诊断和基础研究
主持国家自然科学基金和省科技厅重点项目各1项,参与多项
发表SCI收录论文40余篇(第一作者或通讯作者20余篇)
研究概述
该研究是一项全国多中心、回顾性、观察性研究,自2019年1月1日-2020年6月29日期间采集879例符合检测要求的IIIB/IV期NSCLC样本。71%为IV期肿瘤样本,71.7%为肺腺癌样本,66.4%来自于原发病灶。病灶组织样本行福尔马林固定石蜡包埋处理,制备4-5 μm切片,行PD-L1免疫组化检测,使用22C3 PharmDx实施PD-L1检测。
研究主要目的为利用PD-L1 IHC 22C3 PharmDx抗体检测IIIB/IV期NSCLC患者PD-L1表达水平及分布频率。次要目的为:①揭示PD-L1表达与基线人口学、临床病理学特征、遗传学特征(EGFR/ALK)相关性;②评估利用22C3抗体在其他平台实施PD-L1临床检测的合理性。
主要研究结果
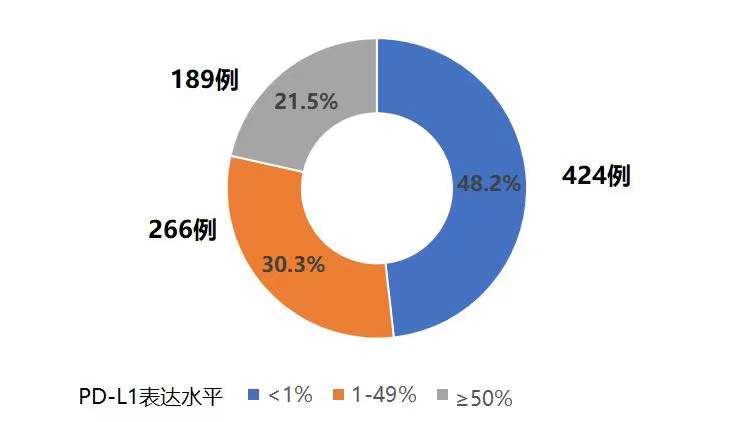
PD-L1不同表达水平的分布频率
879例NSCLC患者肿瘤组织中PD-L1不同表达水平分布频率如下:
PD-L1表达水平与临床病理特征之间的相关性
如下图所示,PD-L1高表达(TPS≥50%)富集于<75岁、男性、吸烟史以及ECOG PS 0-1人群:
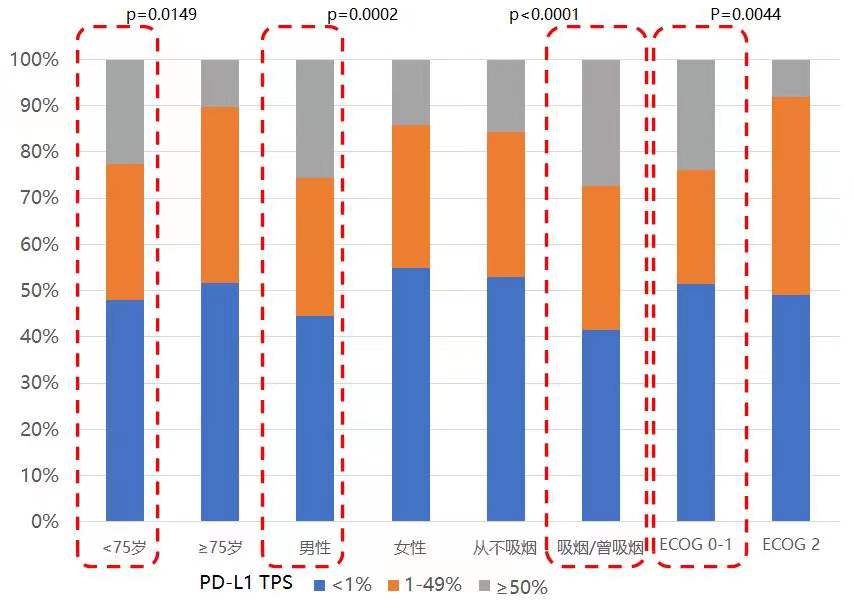
另外,鳞状NSCLC人群PD-L1表达水平略高于非鳞NSCLC,但无统计学差异。不同TNM分期、原发或转移灶、手术或活检样本、不同取样部位间的PD-L1表达水平未呈现出显著差异。
EGFR/ALK突变状态与PD-L1表达水平的相关性
综合考虑两类驱动基因突变状态,可预测PD-L1表达水平:
ALK或EGFR突变型相比ALK-野生型(WT)/EGFR-WT:PD-L1高表达水平比例显著更低 (13.2% vs 28.0%,p=0.0009);
EGFR突变人群PD-L1水平显著更低:
EGFR突变型与EGFR-WT人群相比PD-L1 TPS≥50%人群占比显著更低,分别为14.3% vs 27.4%(p=0.0017);
ALK突变状态对PD-L1表达水平无显著影响。
22C3抗体在PharmDx与其他平台实施PD-L1检测结果的一致性
研究中有248例患者样本使用22C3抗体在其他平台实施经验证的实验室自建方法进行检测,其中99例使用Dako ASL48平台检测,149例使用Ventana BenchMark平台检测,与22C3 PharmDx相比:
Dako ASL48平台检测 TPS<1%结果完全一致,TPS 1-49%比例略低(23.2% vs 24.2%),TPS≥50%比例略高(29.3% vs 28.3%);
Ventana BenchMark平台检测TPS<1%比例略高(40.9% vs 39.6%), TPS 1-49%比例略高(34.9% vs 30.9%),TPS≥50%比例略低(24.2% vs 29.5%)。
结论与讨论
该研究中我国晚期NSCLC患者PD-L1表达水平与全球EXPRESS研究中报道的结果一致。年龄、性别、吸烟史、PS评分及EGFR/ALK突变状态均可影响PD-L1表达。22C3抗体可作为评估PD-L1水平的可选方法。
相比于EXPRESS研究,本研究将考察对象聚焦于中国NSCLC患者群体,对我国临床实践具有更重要的参考价值。
部分早先研究认为,PD-L1表达水平与性别、年龄、吸烟史或PS评分无关。然而,本研究发现男性、现阶段/先前吸烟、PS评分较好的患者与更高的PD-L1表达水平显著相关。从生物学机制上加以解释,考虑烟草暴露诱发慢性炎症,并上调IFN-γ,后者引发PD-L1表达上调。且已有研究表明,更高的日吸烟量、更久的吸烟史、现阶段吸烟与更高的PD-L1表达水平显著相关。考虑到我国男性吸烟率高于女性,可以解释该研究中PD-L1表达的性别差异。
值得一提的是,本研究纳入58例脑转移患者,而此类患者往往在临床研究的入排阶段被排除。该研究发现,脑转移病灶PD-L1表达水平分布频次与其他组织样本一致。结合早前研究结果,脑转移病灶与原发病灶PD-L1表达水平一致,提示免疫治疗在脑转移NSCLC患者中具有一定治疗潜力。
另外,该研究发现PD-L1检测抗体22C3克隆在PharmDx平台的检测结果与Dako ASL48、Ventana BenchMark平台相一致。该结果具有重要的实践指导意义,提示22C3抗体可在更多的检测平台获得可靠的检测结果。
但该研究仍具有一定局限性。第一,该研究为回顾性研究。第二,该研究未分析EGFR/ALK不同亚型突变及其他类型驱动基因如KRAS与PD-L1表达水平的相关性。第三,22C3在其他平台的检测相关性需要在更大临床样本中得到验证。
参考文献
1.Twomey JD, et al. AAPS J. 2021 Mar; 23(2): 39.
2.Dietel M, et al. Lung Cancer. 2019 Aug;134:174-179
审批号:MI-PD1-2181-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多