查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





本文作者:东部战区总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所许书添 董建华 李世军刘志红
病例摘要
主诉及现病史
44岁男性,因“尿检异常3月,发热咳嗽伴胸闷3天”,于2017年12月5日入院。
患者2017年9月初劳累后出现肉眼血尿,查血压120/70mmHg,尿蛋白2+,尿隐血3+,血白蛋白33.5g/L,血肌酐(Scr)1.64mg/dl,尿蛋白3.08g/24h,9月27日我院肾活检病理:IgA肾病(中度增殖型,新月体30%,IgA牛津分型MOE1S0T0)。9月30日予甲泼尼龙250mg/日´6d冲击治疗,后续泼尼松30mg/日、吗替麦考酚酯胶囊(MMF)0.75g/日治疗。10月19日查MMFAUC0~12h 28.89mg·h/L,CD4+ 1129个/m,尿蛋白定量2.37g/24h,尿红细胞1440/ml(混合型),Scr2.02mg/dl,血白蛋白42.4g/L,调整MMF剂量为1.0g/日。11月29日复查尿蛋白2.17g/24h,尿红细胞505.6/ml,血肌酐1.7mg/dl,白细胞15.8×109/ml,淋巴细胞10.3%,CD4+ 533个/ml,同时因频发口腔溃疡、关节酸痛,激素减至25mg/日,MMF减至0.5g/日。12月2日患者体温最高39℃,伴有畏寒、干咳,活动后有胸闷,当地医院予“青霉素”抗感染治疗后症状加重,12月4日CT提示两肺多发散在片状毛玻璃影(GGO)。12月5日拟“肺部感染”收住入院。病程中患者精神差,乏力,尿量正常,夜尿4次/晚,大便正常。
既往史:有慢性咽炎10余年,有十二指肠球部溃疡和肺大泡病史。吸烟200支/年,少量饮酒,均已戒。
体格检查 体温38.2℃,脉搏123 次/分,呼吸33次/分,血压173/90mmHg,脉氧95%(面罩吸氧10L/min),体质指数(BMI)22kg/㎡,双肺呼吸运动对称,呼吸急促,双肺叩诊音清,听诊呼吸音粗,两肺可闻及散在细湿啰音。心律齐,心脏无杂音。双下肢无浮肿。
实验室检查
尿液 尿蛋白(+)、尿沉渣红细胞67.5/HPF(混合型)、尿蛋白0.52g/24h、尿NAG酶22.1U/g*cr、尿视黄醇结合蛋白(RBP)4.4mg/L。
血液
血气分析:PH 7.479,吸入氧浓度(FiO2)61%,动脉血氧分压(PaO2) 64.1mmHg,氧合指数105mmHg。
血常规 白细胞计数9.9×109/L、淋巴细胞百分数5.90%、血红蛋白91g/L、血小板计数262×109/L。
凝血功能 凝血酶原时间12.4秒、纤维蛋白原>7g/L、活化部分凝血活酶时间测定(APTT)30.9秒,血浆D-二聚体测定0.2mg/L。
血生化 白蛋白25.1g/L、球蛋白 21.6g/L、尿素氮(BUN)39.6 mg/dl、Scr 1.83mg/dl、钾 3.9mmol/L、钠 136.7mmol/L、二氧化碳结合力 25.6mmol/L、血糖8.3mmol/L、白介素-6 2339ng/L、乳酸脱氢酶(LDH)1024U/L、降钙素原(PCT)0.549μg/L(正常参考值<0.046μg/L)、C反应蛋白(CRP)178.4mg/L。
免疫学 淋巴细胞亚群计数CD4+107个/μl、CD8+97个/μl、CD19+74个/μl、CD20+ 75个/μl、调节性T细胞5个/μl、流式细胞仪HLA-DR 38.50%(参考值80.65±11.93%);免疫球蛋白IgG 3.29g/L、补体正常。
微生物检查 真菌G试验187.2pg/ml(正常值:<60pg/ml);GM试验0.09;结核感染T细胞检测<2.0pg/ml;病原体九项:抗EB病毒壳抗原IgG抗体(3+)、抗EB病毒壳抗原IgA抗体弱阳性(+/-)、抗肺炎支原体IgG抗体弱阳性(+/-)、余项均阴性;CMV、EBV、B19、HSV、VZV-DNA均阴性。血培养阴性;痰细菌培养阴性。乙肝、丙肝、梅毒、HIV均阴性。
辅助检查:12月5日胸部CT:1.两肺多发斑片、絮状及条索样密度影;2.两肺上叶多发肺大疱(如图1A、B)。
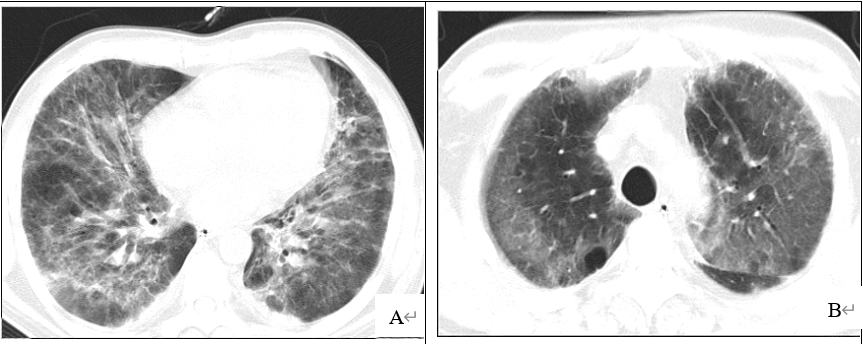
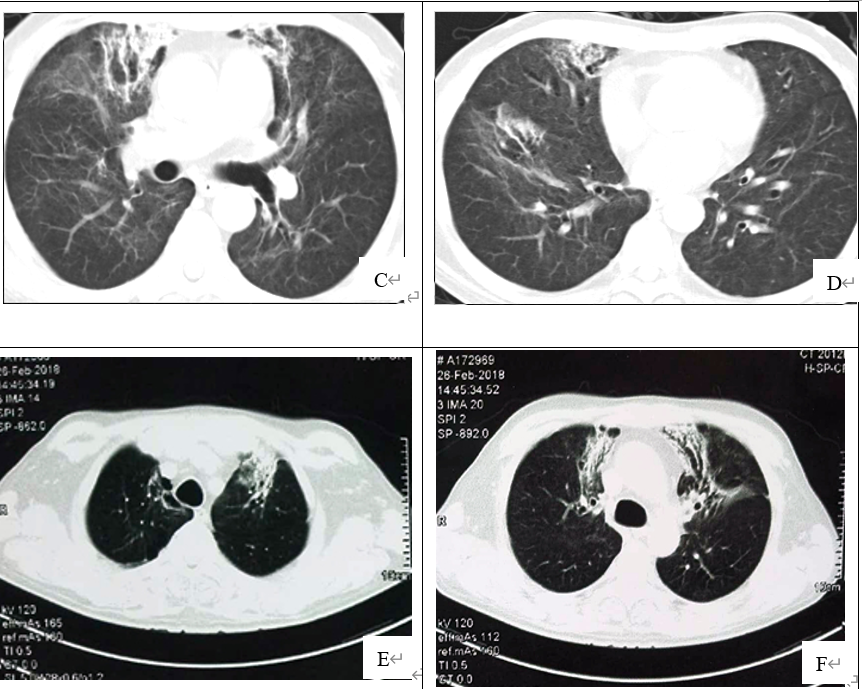
图1 胸部CT(A和B为2017年12月5日示1.两肺多发斑片、絮状及条索样密度影;2.两肺上叶多发肺大泡; C和D为2018年01月29日提示较前明显吸收,遗留条索状高密度影, E和F为2018年2月28日提示机化性肺炎;)
诊断
1. 重症肺部感染
1.1 耶氏肺孢子菌肺炎(PCP)
1.2急性呼吸窘迫综合征(ARDS)(重度)
2.IgA肾病2.1慢性肾功能不全急性加重。
诊断分析
患者中年男性,确诊IgA肾病,给予甲强龙冲击,续泼尼松联合MMF治疗2个月。此次发热干咳伴胸闷起病,体温最高39℃,青霉素治疗无效,CT示两肺多发GGO。入院后复查胸部CT较前明显加重,氧合指数105mmHg。查体两肺细湿啰音,免疫功能低下(CD4+低至107个/ml),PCT、CRP升高,病情进展迅速,需考虑以下病原体感染。
1. 细菌性肺炎 该患者临床表现为发热、胸闷,干咳,肺部无实变,双肺细湿啰音,微生物检查未见细菌生长,尽管CRP升高明显,但PCT仅轻度升高,不支持细菌性肺炎。入院后使用莫西沙星主要目的是预防细菌感染。
2.肺部真菌感染 患者有免疫缺陷,发热、干咳,CT示双肺弥漫GGO,真菌G试验阳性,但真菌GM试验阴性,多次痰涂片未见真菌孢子、菌丝,血和痰培养均阴性,亦不支持真菌性肺炎。
3.巨细胞病毒性肺炎(CMP) 典型临床表现为胸闷、高热、咳嗽,无痰或少痰,CT提示双肺多发、呈片状或弥漫分布的GGO,可表现为气腔样实变、胸腔积液、胸膜增厚等。患者入院后查CMV-IgM阴性和CMV-DNA阴性,不支持巨细胞病毒性肺炎。
4.PCP 临床表现为胸闷、高热、干咳,CT示GGO。该患者有服用激素和MMF病史,CD4+低至107个/ml,真菌G试验阳性,LDH升高,行肺泡灌洗液PCR检测肺孢子菌DNA(+),可确诊。
5.其他 血结核T细胞检测阴性以及其他病原学检查阴性。
治疗经过
入院后予复方磺胺甲噁唑片(Co-SMZ)、卡泊芬净和莫西沙星抗感染;甲泼尼龙80mg抗炎,利尿剂保持容量负平衡,辅以白蛋白、免疫球蛋白、胸腺肽提高免疫力、抑酸护胃、雾化祛痰、面罩氧疗以及肠内营养等治疗。12月7日胸闷气喘加重,脉氧89%,氧合指数96mmHg,颈部扪及少许皮下气肿,胸片未见气胸,予面罩接呼吸机无创通气(BIPAP)。12月9日氧合指数降至39.5mmHg,予气管插管接呼吸机辅助呼吸,采用保护性肺通气策略,SIMV+PS模式,氧合指数43.4mmHg,经加强镇静和调整呼吸机参数,脉氧升至90%。12月10日患者CRP、PCT升高,停莫西沙星,改用亚胺培南西司他丁抗感染。12月11日呼吸急促,脉氧下降至40%,氧合指数39.5mmHg,经俯卧位通气,脉氧升至80%,经过充分准备,于12月11日13:20行体外膜肺氧合(ECMO)治疗。
ECMO的实施:
(1)导管置入术与设备连接 ECMO在重症监护病房内进行,应用Maquet ECMO套包,采用Maquet导管(直径分别为17F和21F),超声引导下静脉穿刺,以左侧股静脉为静脉引流端;右侧颈内静脉为动脉灌注端。采用VV模式,空氧混合器氧浓度设置为80%,初始转速3000-3500rpm,气流量及血流量均为4L/min,转流成功后氧饱和度升至98%。
(2)抗凝方案 全身普通肝素钠抗凝,负荷剂量1250U,后以750U/h持续泵入,维持ACT在180-220s,APTT在60-80s。
(3)呼吸机参数 根据血气进行调整,ECMO成功后立即下调呼吸机参数(PEEP<10cmH2O,FiO2<60%),SIMV+PS模式。
(4)CRRT串联ECMO ECMO治疗前患者BUN和Scr有升高趋势(BUN 109.2mg/dl,Scr 3.22),血钾 5.6mmol/L,遂采用CRRT串联ECMO(模式图如图2),且CRRT运行期间动脉端和静脉端压力均在机器压力报警范围内(具体报警范围根据机器型号不同而定),根据出入量、血压、心率、电解质等参数调整CRRT治疗时间以及出超量,维持容量负平衡和内稳态。
(5)其他治疗 继续抗PCP治疗,其间监测磺胺甲噁唑浓度203.1mg/ml(治疗窗浓度50~150mg/ml)、甲氧苄啶浓度13.6mg/ml(治疗窗浓度2~8ug/ml)浓度过高,下调剂量后复查磺胺甲噁唑浓度182.3mg/ml,甲氧苄啶浓度8.9mg/ml均在治疗窗范围;
ECMO第2天出现血流量不足,经床边胸片以及超声定位重新调整引流管位置后得以改善;第7天发现口腔、皮肤、泌尿道、导管穿刺部位出血,经减少肝素剂量、局部使用止血药、输注血浆、冷沉淀、纤维蛋白原、留置声门下吸引、局部压迫等处理,出血控制。12月19日复查床边胸片炎症较前稍好转(图3 B),将血流量和气流量均试验性下调至2L/min,空氧混合器氧浓度下调至零,通过自主呼吸试验。12月21日(ECMO第10天)因氧合器血栓形成,予停用肝素后撤出ECMO,并按压导管穿刺点60min。
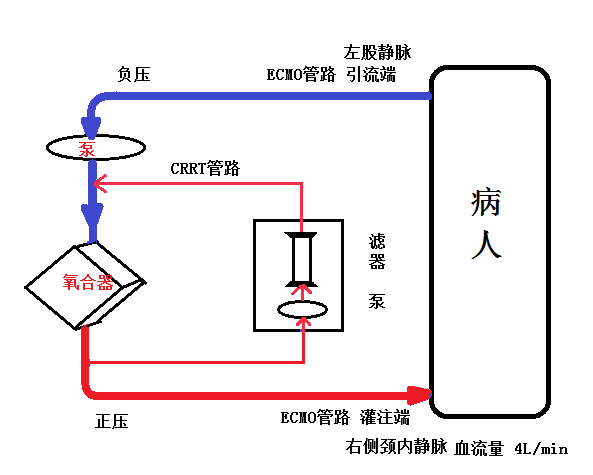
图2 CRRT串联在ECMO管路的模式图
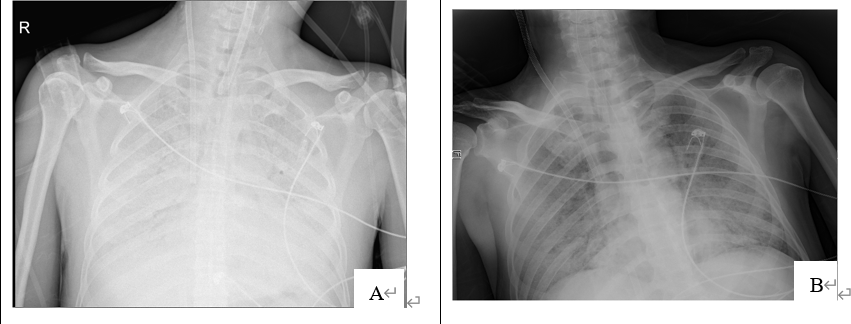
图3 ECMO治疗前后床边胸片对比(A为12月11日治疗前双肺弥漫性渗出性病变,B为12月19日治疗后炎症阴影改善)
撤机后患者气道自净能力差,且呼吸机依赖,遂行气管切开术。12月21日出现发热,PCT、CRP指标上升,考虑多重耐药菌感染,给予加用替加环素、泊沙康唑抗感染并将激素减量,加强痰液引流,氧合指数维持在200~350mmHg,体温控制、感染指标下降。2018年1月4日淋巴细胞比例 6.8%,CD4+ 324个/ml,1月11日复查淋巴细胞比例升至20%,CD4+升至901个/ml。2018年1月5日改气切处接高流量呼吸机氧疗。复查CT较前明显吸收,遗留条索状高密度影(图1C和D),予2月2日出院。
随访1月后随访情况:体力基本恢复,声音无嘶哑。复查尿蛋白0.5g/24hr,尿红细胞 106个/ml,肌酐 1.27mg/dl,淋巴细胞比例 36%。CT示机化性肺炎(图1E和F),继续泼尼松10mg/d维持治疗。
讨论
PCP诊断与治疗
PCP为机会性感染,好发于HIV感染、器官移植、使用激素和免疫抑制剂等患者。该患者以急进性肾炎综合征起病,确诊IgA肾病,经免疫抑制剂治疗2月后出现细胞免疫和体液免疫功能缺陷,表现为发热、胸闷、干咳、进行性呼吸困难以及自发性皮下气肿,CT示GGO样改变、G试验阳性、LDH升高以及PCR检测肺孢子菌DNA阳性,PCP诊断明确。免疫缺陷患者继发重症肺部感染时,往往病情发展迅速,短期内进展为ARDS,非HIV感染的免疫缺陷患者PCP患者ARDS发生率高达43%,起病更为急骤,预后差,死亡率34%。本例患者诊断为继发性免疫缺陷和PCP,经Co-SMZ联合棘白菌素,辅以激素等对症支持治疗,使得肺部感染得以控制,为ECMO治疗奠定成功的基石。
ECMO在重症肺部感染救治中的作用
ECMO是一项新的呼吸循环支持技术,借助于循环血流泵与体外氧合器为核心组成的人工体外循环装置,以体外替代性气体交换支持(VV-ECMO)和心脏替代支持(VA-ECMO)为目的的心肺支持。2009年CESAR研究显示,若病情可逆的早期重症ARDS患者通过ECMO治疗临床获益。随着ECMO设备的更新换代以及对此项技术的推广应用,ECMO救治H1N1重症肺炎患者的生存率已升至63~79%。但是对于全身应用抗凝药、严重出血或弥漫性血管内凝血、慢性疾病或恶性疾病的终末期、严重的免疫抑制、急性重度颅脑损伤等,一般不考虑ECMO。国外有VV-ECMO在AIDS合并严重ARDS患者中成功运用的报道,也有儿童恶性肿瘤合并严重PCP感染后应用ECMO救治成功的案例。本例患者入院后病情迅速进展,早期出现皮下气肿,氧合指数进行性下降,有ECMO治疗的指征。免疫缺陷虽然不是ECMO治疗的绝对禁忌,但是我们希望通过应用ECMO技术,避免呼吸机相关性肺损伤,在积极抗PCP治疗的同时,等待免疫重建,为肺功能恢复争取时间。
当然,VV-ECMO仅是一项辅助呼吸支持技术,并无病因治疗作用,且随着时间的推移,并发症会越来越高。因此必须权衡其与并发症之间的利弊,做好原发病和并发症之间的评估,切勿过度依赖ECMO。在本例VV-ECMO运行期间,呼吸机参数立即下调,让肺充分休息,动态评估各种临床参数,自主呼吸试验,并在合适时机终止ECMO治疗。治疗过程中尽管出现血小板下降、黏膜出血以及导管渗血等事件,经输注多种血制品、调控肝素用量等措施,出血得以控制,但仍出现氧合器局部血栓形成,极大影响氧合器使用寿命。
ECMO与CRRT联合应用
本例患者在ECMO治疗前,肌酐、尿素氮和血钾有升高趋势,在ECMO之后由于担心肾功能会继续恶化,故立即采用ECMO联合CRRT。这不足以证明ECMO本身会加重肾功能损害,但不能排除体外循环设备会会增加机体炎症、凝血因子消耗、血液成分的破坏和补体的激活等,最终让肾功能恶化。研究表明,采用VV-ECMO治疗重度ARDS患者中,30%患者并发AKI,且其病死率高于非AKI组(56% vs 87%)。本例患者救治体会是,联合CRRT确实改善肾功能和减轻容量负荷,纠正电解质紊乱,有助于营养支持、消除对液体的限制以及减少利尿剂的使用。因此,ECMO联合CRRT对于肾功能损害的患者是较好的治疗方法,在行ECMO治疗的患者,早期使用CRRT有助于改善疾病的转归。
ECMO与CRRT联合治疗必然涉及两套环路之间的连接方式问题。问题一是两套环路是分别置管(并联法)还是利用现有管道加入CRRT环路(串联法)? 实践证明:ECMO管路串联加入CRRT设施是安全有效,无须额外增加体外抗凝剂,可以促进液体平衡、延长滤器的使用寿命,且将CRRT机器加入ECMO环路后可以精确调节液体平衡;问题二是CRRT管路如何加入ECMO环路?Santiago等认为:CRRT入口端通过一个三通连接在离心泵的后端,而出口端则在膜肺之前连接于另一端。Rubin等发现在泵和氧合器之间通常压力是最高的,而在离心泵前静脉端的压力是负压力尤其在低血压期间,通常担心会有空气栓塞的危险。由于Maquet公司提供的ECMO套包管路在离心泵后端仅保留一个三通连接口,无法按Santiago法连接,故我们进行改良,将CRRT入口端连接于氧合器后三通连接口,而出口端连接于氧合器前和离心泵之间的仅有的一个三通连接口(如图2),此法可以克服空气栓塞以及ECMO管路三通接口少的局限性。实践证明CRRT出入口处并未因压力高而报警,影响CRRT治疗,但有再循环弊端。
小结
对于合并免疫功能缺陷的重症ARDS伴急性肾损伤患者,在ARDS传统疗法无效时,VV-ECMO联合CRRT治疗可以作为生命支持技术,此技术确实为肺功能的恢复和免疫功能的重建赢得时间。选择合适的病人,合适的时机启动,合适的时机终止是ECMO治疗救治成功的关键。
本文由作者授权中国医学论坛报发布,未经同意请勿转载
查看更多