查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,上海市第六人民医院消化内科宛新建教授团队在Advanced Science(IF=14.1)在线发表题为“ETV1 Drives CD4⁺ T Cell-Mediated Intestinal Inflammation in Inflammatory Bowel Disease Through Amino Acid Transporter Slc7a5”的研究论文。该研究系统阐明,转录因子ETV1通过直接靶向调控氨基酸转运蛋白SLC7A5,驱动CD4⁺T细胞的代谢重编程与功能活化,进而促进肠道炎症发生,为炎症性肠病(IBD)的精准靶向治疗提供了新的理论依据与干预策略。

IBD是一种慢性、复发性肠道炎症性疾病,目前缺乏根治手段。CD4+T细胞(如Th17细胞)在肠道的异常活化和增殖是其核心致病机制。激活的T细胞需要大量摄取氨基酸等营养物质以支持其快速增殖和发挥免疫效应功能,但这一代谢过程的精确调控机制仍未明确。
该研究结果显示,转录因子ETV1在IBD患者的炎症肠黏膜组织中的表达水平显著上调,且与疾病严重程度呈正相关。进一步研究发现,靶向抑制ETV1可显著减轻TNBS诱导的小鼠实验性结肠炎的严重程度,表现为体重下降减少、结肠缩短程度降低、炎症细胞浸润减轻及促炎细胞因子水平下降。此外,细胞过继转移实验证明,ETV1缺失的CD4+T细胞诱导结肠炎的能力显著受损,证实了ETV1在CD4+T细胞介导的IBD发病过程中具有至关重要作用。
在机制层面,团队通过RNA测序、染色质免疫共沉淀(ChIP)等一系列分子生物学技术,发现并证实了 SLC7A5 是ETV1的直接下游靶基因。SLC7A5是负责亮氨酸等大型中性氨基酸转运的关键蛋白,其表达上调是T细胞激活后代谢重编程的重要标志。ETV1通过结合 SLC7A5 基因启动子区域驱动其表达,进而调控氨基酸摄取以及随后的细胞激活、增殖和Th17细胞分化。
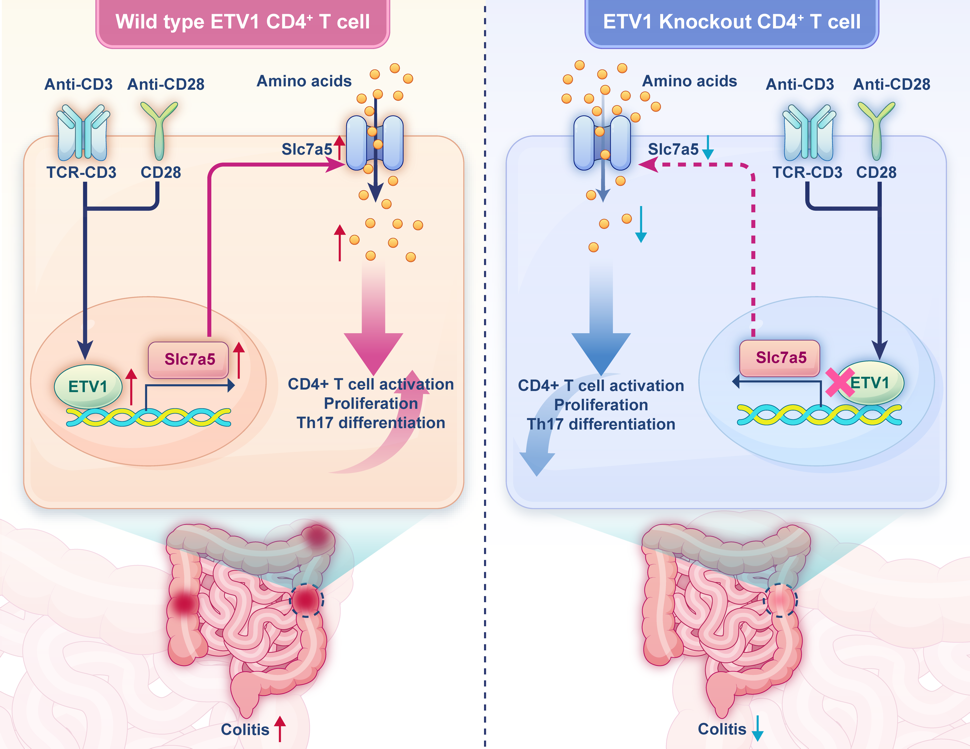
综上所述,该研究系统性地揭示了ETV1-SLC7A5轴是炎症性肠病中驱动致病性CD4+T细胞代谢与功能异常的关键通路。该发现为炎症性肠病提供了全新的精准治疗靶点,有望推动IBD治疗策略的突破性发展。
作者介绍
第一作者

石岩
医学博士,上海市第六人民医院消化内镜中心主治医师。
专注于炎症性肠病临床诊治与基础研究,主持国家级、省部级科研项目4项,获批国家发明专利2项。以第一作者在Gut, Mucosal Immunology, Advanced Science等权威期刊发表多篇论文。
通讯作者

宛新建
医学博士,主任医师、教授、博士生导师
上海市第六人民医院消化内科主任、消化内镜中心主任
中国医师协会内镜医师分会常委
中国医师协会消化医师分会委员
中国抗癌协会内镜专委会委员
中国医师协会消化内镜专委会委员
上海市医学会食管及胃静脉曲张治疗专业委员会主任委员
上海市医学会消化内镜分会委员
上海市消化内镜学会ERCP学组副组长
《中华消化内镜杂志》通讯编委
来源:上海市第六人民医院
查看更多