查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





重症肌无力(Myasthenia Gravis, MG)是一种自身免疫性疾病,主要影响神经肌肉接头,造成波动性的肌无力,尤其是眼部、延髓、呼吸肌及四肢肌肉。这种疾病的标准治疗方法通常包括免疫抑制治疗(IST),大多数患者可通过传统疗法控制症状。然而,部分患者仍然存在疾病负担,并面临较高的危象发生率及相关的发病率和死亡率。这些难治性患者的存在凸显了新型治疗方案的紧迫性。近年来,针对补体C5抑制剂(如eculizumab、ravulizumab)和新生儿Fc受体(FcRn)拮抗剂(如efgartigimod)的研究取得了重要进展,它们被证明对抗乙酰胆碱受体抗体(AChR-Ab)阳性患者具有显著疗效。然而,尽管这些疗法均得到了临床认可和研究支持,但在真实世界的疗效对比方面仍缺乏研究。
近期的J Neurol Neurosurg Psychiatry杂志发表了一项究,旨在通过分析真实世界数据,对这两种治疗策略进行比较,为临床实践提供更有价值的参考。该研究纳入了来自德国8家专科中心的153名重症肌无力患者,其中106名接受了补体C5抑制治疗(26名使用依库珠单抗,80名使用Ravulizumab),47名接受了efgartigimod治疗。通过倾向评分匹配(PSM)方法,研究比较了两组患者在治疗开始后6个月内重症肌无力特定结局参数的变化,以及安全性特征和伴随用药情况。
在研究设计方面,这是一项回顾性、观察性、多中心分析,涉及2018年至2024年期间接受依库珠单抗、Ravulizumab或efgartigimod治疗的重症肌无力患者。研究的纳入标准包括:确诊为重症肌无力,治疗开始时年龄≥18岁,以及有足够的临床随访数据(基线值和至少一次随访)。数据收集标准化,包括社会人口学数据、抗体状态、重症肌无力特定药物、胸腺切除史、胸腺瘤检测、不良事件、肌无力危象发生情况以及合并症等。重症肌无力特定项目的评分由治疗医师进行。
Efgartigimod 10mg/kg 的平均给药周期为 4个周期(标准差为1.8),每个周期通常包含四次输注,平均给药间隔为 5.8周(标准差为2.9)。第一周开始每周静脉输注 900 mg,连续4周;第5周开始每两周静脉输注1200 mg。
主要结局参数为重症肌无力日常生活活动(MG-ADL)评分的最大降低幅度。评分在基线(治疗开始前)以及治疗后1个月(14-45天)、3个月(60-120天)和6个月(150-210天)进行收集。次要结局包括定量重症肌无力(QMG)评分的变化、重症肌无力生活质量15项问卷(MG-QoL15)的改善、可接受症状状态患者比例(PASS,定义为MG-ADL评分≤2或QMG评分≤7)、最小症状表达(MSE,定义为MG-ADL评分≤1)以及类固醇和吡啶斯的明剂量减少情况。
研究结果显示,两种治疗策略均导致快速的临床改善和泼尼松龙剂量的显著减少。在接受补体C5抑制治疗的患者中,6个月后MG-ADL评分从9.3±3.8降至5.9±3.2,QMG评分从17.3±6.0降至11.9±5.4。与此类似,接受FcRn抑制治疗的患者在6个月后,MG-ADL评分从9.4±4.4降至6.2±3.6,QMG评分也显示出明显改善(-3.3±5.4)。两组患者在生活质量方面也有显著提高,MG-QoL15评分均有明显下降。
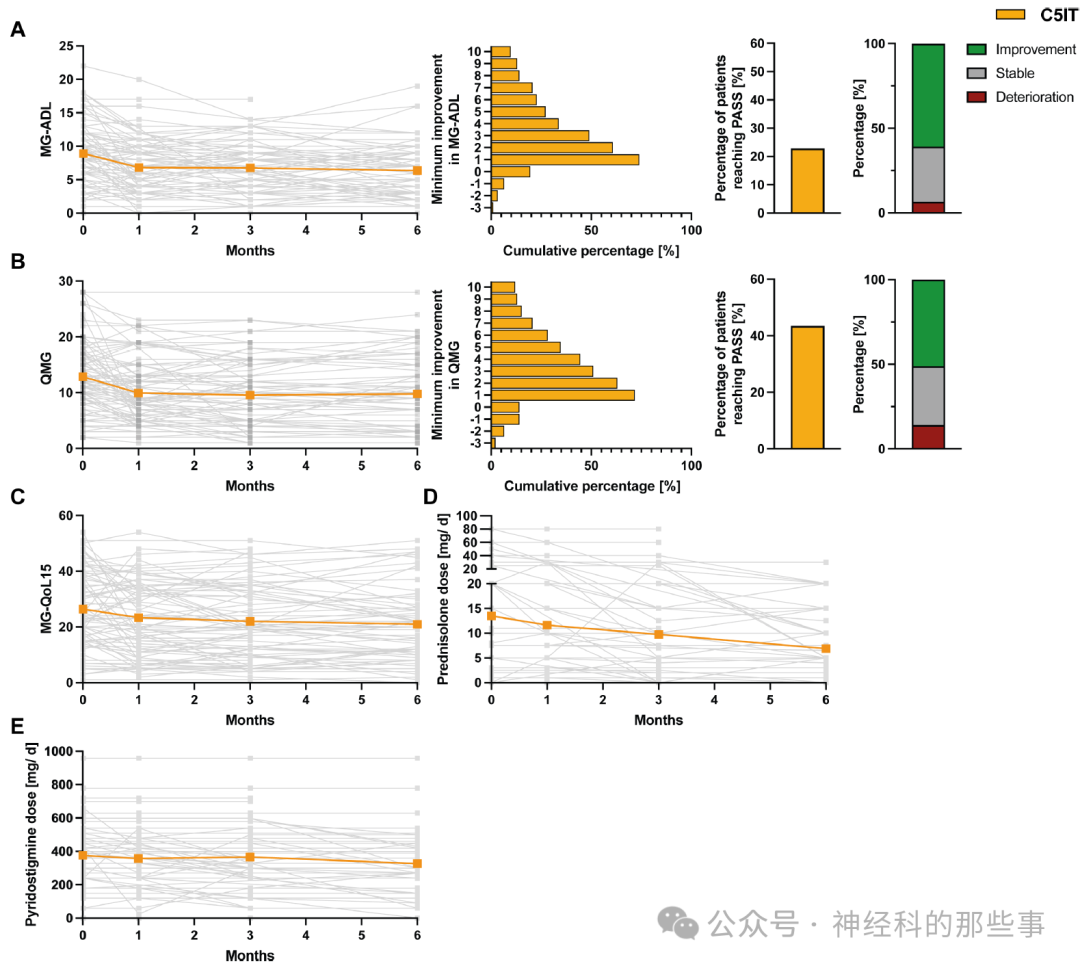
图:接受C5补体抑制疗法患者的临床结局。(A) 左侧图表显示接受eculizumab或ravulizumab治疗患者在基线后1、3和6个月的MG-ADL评分的个体变化(灰色),以及平均变化趋势(橙色)。中左图显示基于最佳个体反应的MG-ADL最小改善情况。中右图展示根据Mendoza等人方法定义的PASS指标(MG-ADL评分≤2分)达成的患者比例。右侧图表则显示MG-ADL恶化(红色)、MG-ADL稳定(MG-ADL减少≤1分,灰色)或显著改善(MG-ADL减少≥2分,绿色)的患者比例。(B) 左侧图表展示接受eculizumab或ravulizumab治疗患者在基线后1、3和6个月的个体QMG评分(灰色)及平均变化趋势(橙色)。中左图表示最小QMG改善情况。中右侧图表展示基于QMG评分定义的PASS达成情况(QMG评分≤7分)的患者比例。右侧图表显示QMG恶化(红色)、QMG稳定(QMG减少0–2分,灰色)或显著改善(QMG减少≥3分,绿色)的患者比例。(C–E) 分别展示接受C5IT患者MG-QoL15(C)、泼尼松剂量(D)和吡啶斯的明剂量(E)的个体变化(灰色)及平均变化趋势(橙色)。
经过C5IT治疗,泼尼松龙的平均每日剂量从基线的13.5±17.6 mg/day下降到6个月后的6.9±7.1 mg/天。efgartigimod治疗组泼尼松龙的平均每日剂量从基线的13.7±14.7 mg/day降低至治疗6个月后的6.4±8.3 mg/天。
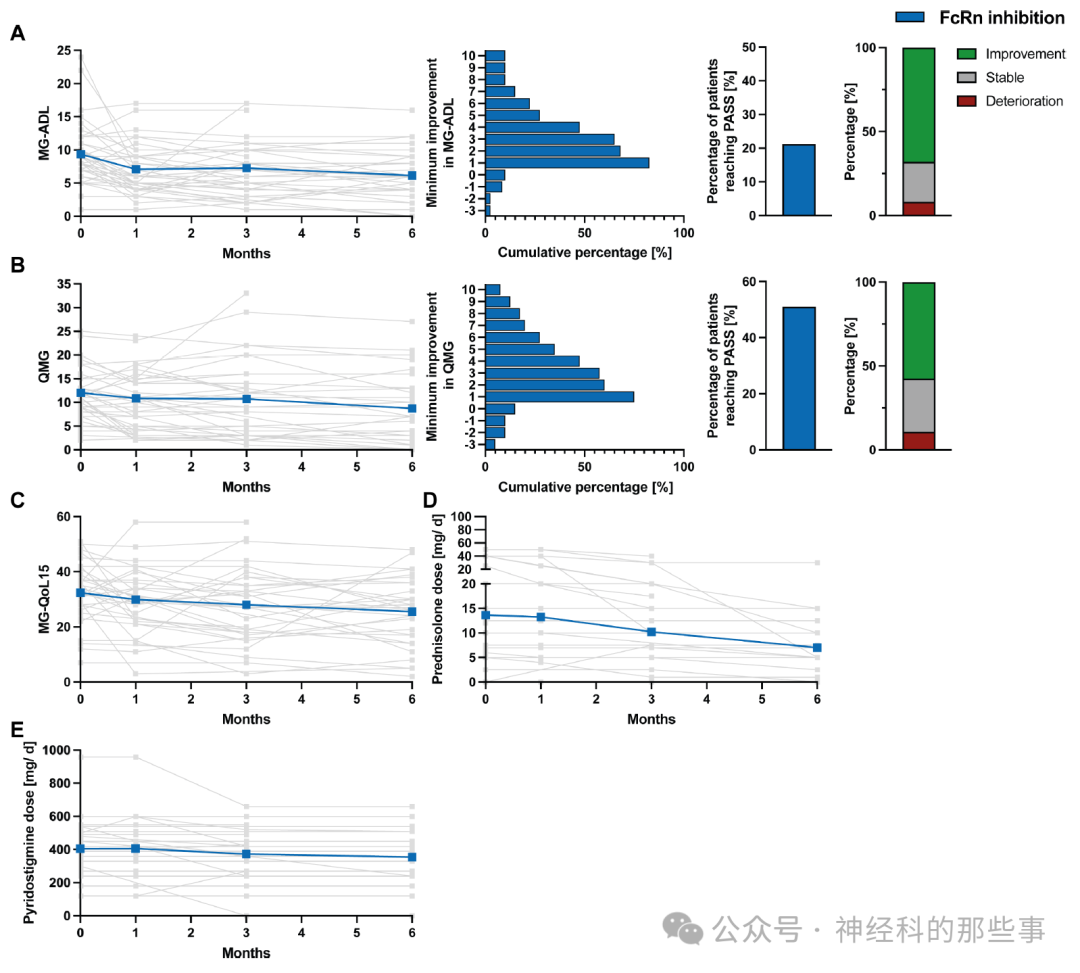
图:接受efgartigimod疗法患者的临床结局。(A) 左侧图中显示了患者在开始FcRn抑制疗法后第1个月、第3个月和第6个月的MG-ADL评分,个体数据用灰色表示,群体平均趋势以蓝色曲线显示;中左图展示了MG-ADL评分最小改善的累积百分比;中心右侧图表明达到Mendoza等人18提出的PASS标准(MG-ADL评分≤2)的患者比例;右侧图则描绘了MG-ADL评分恶化(红色)、稳定(MG-ADL减少0–1分,灰色)或显著改善(MG-ADL减少≥2分,绿色)患者的比例。(B) 左侧图中显示了efgartigimod治疗患者从基线(BL)后的前6个月内的个人QMG评分(灰色)及总体趋势(蓝色);中左图显示最低QMG改善的累计百分比;中心右侧图表明基于最佳个人反应达到PASS标准(QMG评分≤7)的患者比例;右侧图则展示QMG恶化(红色)、稳定QMG(QMG减少0–2分,灰色)或显著改善(QMG减少≥3分,绿色)的患者比例。(C–E) 展示了接受FcRn抑制治疗患者相关的MG-QoL15(C)、泼尼松剂量(D)以及吡啶斯的明剂量(E)的个人轨迹(灰色)和平均趋势(蓝色)。
值得注意的是,尽管两种治疗策略均显示出良好的疗效,但仍有20%-49.1%的患者根据QMG和MG-ADL评分显示治疗反应不足。具体而言,在C5IT组中,17.9%的患者在MG-ADL评分方面没有达到临床显著改善(≥2分),而在QMG评分方面,20%的患者未能达到临床显著改善(≥3分)。同样,在FcRn抑制组中,8.5%和10.6%的患者分别在MG-ADL和QMG评分方面显示恶化,这表明现有治疗策略仍存在一定局限性。
通过倾向评分匹配后,Ravulizumab和efgartigimod每组保留40名患者,两组在人口统计学特征和基线疾病特征方面达到平衡。在主要研究终点方面,两组的MG-ADL评分降低幅度相当。此外,次要结局参数的分析也显示C5IT与FcRn在疗效方面结果相似。这一发现与当前基于临床试验数据的荟萃分析和间接比较存在差异,后者指出两种治疗策略在疗效和安全性方面可能存在差异。
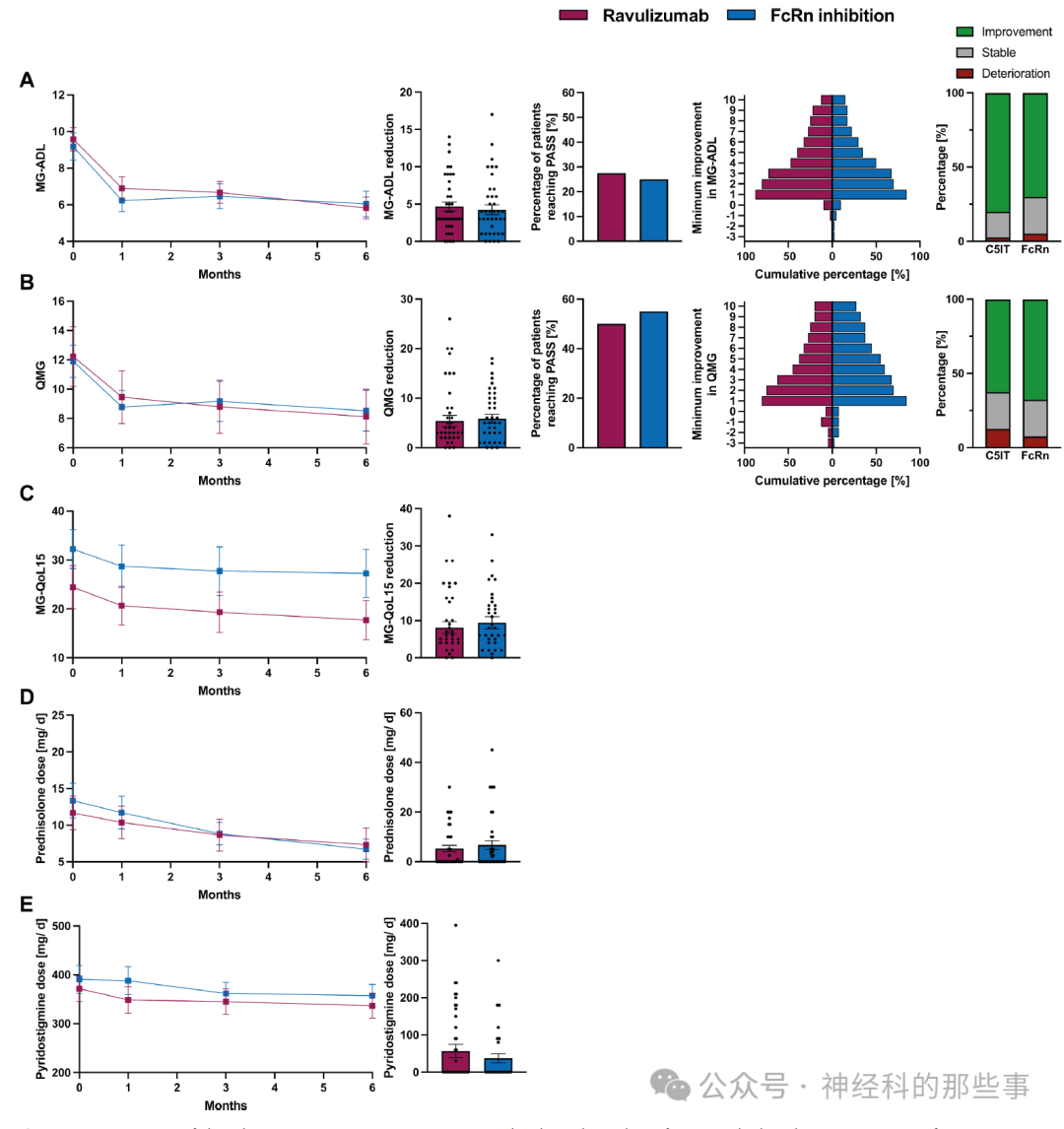
图:比较使用Ravulizumabh和efgartigimod治疗的患者的临床结果参数。对接受Ravulizumab(红色)或efgartigimod(蓝色)联合治疗的患者进行临床结果评估。通过倾向评分匹配对性别、治疗开始时年龄、联合免疫抑制治疗的使用情况、胸腺瘤状况、LOMG状况、基线时的类固醇剂量、MG-ADL基线评分及QMG基线评分等因素进行了队列可比性分析。(A)显示了治疗1、3和6个月后的平均MG-ADL评分(左侧)、MG-ADL评分的最大下降值(中左)、根据MG-ADL评分获得PASS的患者比例(MG-ADL≤2分;中间)和MG-ADL评分的最小改善(中右)。右侧图表则显示了MG-ADL评分恶化(红色)、MG-ADL评分稳定(减少0–1分,灰色)或MG-ADL评分显著改善(减少≥2分,绿色)的患者比例。(B)展示了基线后第1、3和6个月的平均QMG评分(左侧)、QMG评分的最大减少值(中左)、根据QMG评分获得PASS的患者百分比(QMG≤7分;中间)以及总QMG评分的最小改善(中右)。右侧图表显示了QMG评分恶化(红色)、QMG评分稳定(减少0–2分,灰色)或QMG评分显著改善(减少≥3分,绿色)患者的比例。(C–E)左侧图表显示了平均MG-QoL15评分(C)、每日泼尼松(D)以及吡啶斯的明剂量(E)的变化趋势,右侧图表则展示了这些参数的最大下降值。误差线表示均值和95%置信区间。定量变量使用双侧Student’s t检验进行分析。当p<0.05时,差异具有统计学意义。
在安全性方面,研究未发现任何新的安全性问题。补体C5抑制治疗组中,最常见的不良事件包括头痛(19.8%)、腹泻(16%)和上呼吸道感染(15.1%)。有17.9%的患者报告了严重不良事件,包括肌无力危象(8.5%)、败血症(2.8%)和心力衰竭(1.9%)。而在FcRn抑制组中,最常见的不良事件为上呼吸道感染(19.1%)、头痛(17%)和恶心(17%)。6.4%的患者经历了肌无力危象,8.5%出现重症肌无力恶化。这些安全性数据与之前临床试验的报告基本一致,未显示出明显的安全性优势差异。
与既往临床试验相比,本研究的真实世界数据显示出较高比例的肌无力危象(C5IT组8.5%,FcRn组6.4%)。这可能反映了真实临床环境中患者群体的差异,因为临床试验通常排除了更严重或复杂的病例。此外,本研究还观察到,两种治疗策略在减少类固醇用量方面都显示出积极效果,这对于减轻长期使用类固醇的相关副作用具有重要意义。
本研究也存在一些局限性。首先,作为回顾性研究,数据收集可能受到回忆偏倚的影响。其次,来自八个不同德国专科中心的患者纳入研究,虽然未发现明显的中心偏倚,但可能存在选择偏倚,因为只纳入了接受新治疗的患者。此外,由于疾病进展和治疗反应的个体间差异,随访时间点(3个月和6个月后)设定了±1个月的范围,这可能引入一些偏倚。然而,考虑到所研究的治疗通常在4-8周后达到最大效果,这一安排对分析的潜在影响可能有限。
另一个值得注意的限制是临床数据收集时间点(治疗后1、3和6个月)可能未能捕捉到每位患者的最佳反应,特别是考虑到肌无力症状的波动性,尤其是在FcRn拮抗治疗下。为解决这一缺点,研究选择了整个观察期内每位患者的最佳个体反应作为主要终点,以描述潜在的最佳治疗结果。
本真实世界研究表明,补体C5抑制和FcRn抑制在重症肌无力治疗中提供了显著的临床获益,在症状减轻和生活质量改善方面效果相当。此外,研究强调了即使使用这些新型治疗策略,仍有约20%-49.1%的患者治疗反应不充分,这表明需要开发更多有效的治疗选择,特别是针对难治性病例。这些患者可能需要其他治疗策略,如B细胞和/或T细胞清除/调节,包括CAR-T细胞方法。未来研究的目标还应包括识别C5IT或FcRn拮抗治疗反应的预测因素,这将有助于更精确地预测哪些患者可能从特定治疗中获益最多。

转自:神经科的那些事
查看更多