查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





在过去的20年里,肺癌的治疗经历了翻天覆地的变化,随着肺癌分子病理学的研究快速发展,免疫治疗已成为主要治疗手段,这其中以阻断程序性细胞死亡受体1(PD-1)/程序性细胞死亡配体1(PD-L1)为主,即免疫检查点抑制剂(ICIs),而如何克服免疫耐药以使更多人群从ICIs中获益,需要我们探索更多的免疫抑制机制以及尝试更多的联合治疗手段[1]。
地舒单抗(denosumab)是RANKL的全人源单克隆抗体,可特异性结合RANKL,抑制破骨细胞活性,减少骨吸收,已在国内获批用于实体肿瘤骨转移和多发性骨髓瘤患者的治疗,以延迟或降低骨相关事件(病理性骨折、脊髓压迫、骨放疗或骨手术)的发生风险[2]。研究证实其可以提高肺癌患者的总生存(OS)[3],一些回顾性研究也表明了ICIs联合地舒单抗具备治疗晚期非小细胞癌症(NSCLC)骨转移患者的可行性[4-8],而这些研究由于缺乏适当的对照组等因素,结论有待进一步证实。近日,来自中国医学科学院肿瘤医院的王燕教授团队,在Frontiers in Immunology (IF 8.786)上发表了一篇ICIs联合地舒单抗治疗晚期NSCLC伴骨转移患者的有效性和安全性研究,这也是目前中国人群中地舒单抗联合ICIs的真实世界研究首次数据公布。

王燕 教授
中国医学科学院肿瘤医院内科
主任医师 博士研究生导师
中国临床肿瘤学会(CSCO)理事
中国抗癌协会肺癌专业委员会委员
北京肿瘤防治研究会转化医学分委会 主任委员
北京抗癌协会肺癌专业委员会 副主任委员
北京癌症防治学会肺癌免疫治疗专业委员会 副主任委员
北京肿瘤学会肺癌专业委员会 副主任委员
北京肿瘤防治研究会药物不良反应管理分委会 常委
《中国肺癌杂志》和《英国医学杂志中文版》编委
该研究回顾性收集了来自中国国家癌症中心的NSCLC骨转移患者数据(2020年12月至2021年12月),为充分评估地舒单抗和ICIs的协同效应,基于系统治疗和骨靶向治疗(BTT)的治疗模式,研究队列分为一个试验组(denosumab+ICIs[DI])和三个对照组 (denosumab+非ICIs[DnI], 双膦酸盐+ICIs[PI],双膦酸盐+非ICI[PnI])(图1)。研究终点为真实世界中的客观缓解率(ORR)、中位无进展生存期(mPFS)、不良事件(AE)和骨相关事件(SREs)。
患者接受的ICI治疗包括帕博利珠单抗、纳武利尤单抗、阿特珠单抗,信迪利单抗或卡瑞利珠单抗,双膦酸盐包括帕米膦酸、唑来膦酸或伊班膦酸。联合治疗定义为初始系统治疗(化疗±ICI)前任意时间接受BTT治疗,或系统治疗后30天内开始BTT治疗。每6-8周进行一次影像学检查,基于实体瘤疗效评价标准(RECIST 1.1)进行评估。根据不良事件通用术语标准(CTCAE 5.0版)记录不良事件(AEs)。
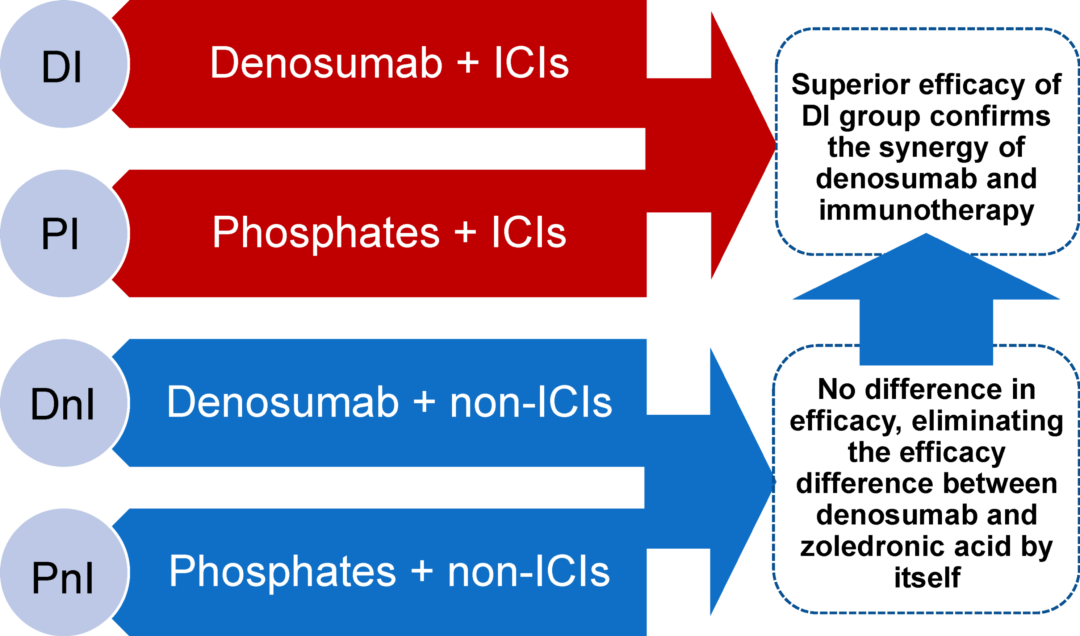
图1 研究设计
研究共纳入171例患者进行分析,根据不同的治疗方案,将队列分为4组:DI(n=40)、PI(n=74)、DnI(n=15)和PnI(n=42)(图2)。
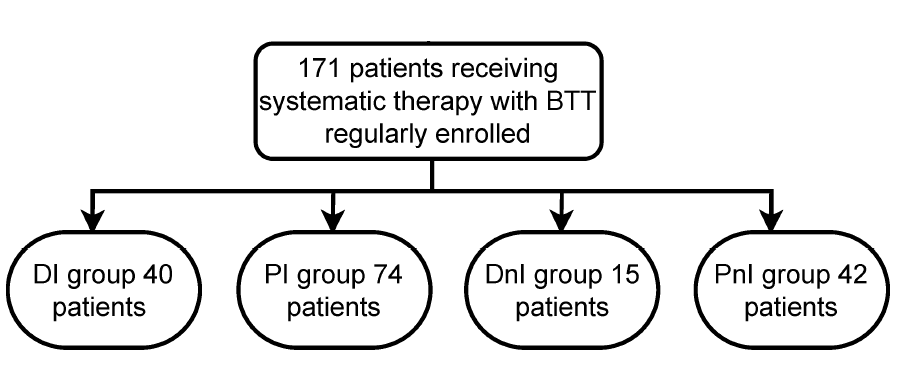
图2 患者分组信息
1)地舒单抗+ICIs可提高mPFS和ORR,且用药依从性更好。在DI组(40例)可评估患者中,大多数患者为多发骨转移(85%),28例为非驱动患者(包括KRAS突变和其他驱动基因野生型)。近70%的患者一线系统治疗同时开始BTT治疗。在DI治疗后经过评估,19例(47.5%)达到部分缓解(PR),19例(47.5%)为疾病稳定(SD),2例(5%)为疾病进展(PD),ORR为47.5%,疾病控制率(DCR)为95%(图3)。DI组的mPFS为378天(95% CI,118.5–636.5天),中位随访用药时间为198天(95% CI,181.6–214.4天),14例(35%)患者的PFS数据成熟,26例患者肿瘤仍在持续控制中(图4)。
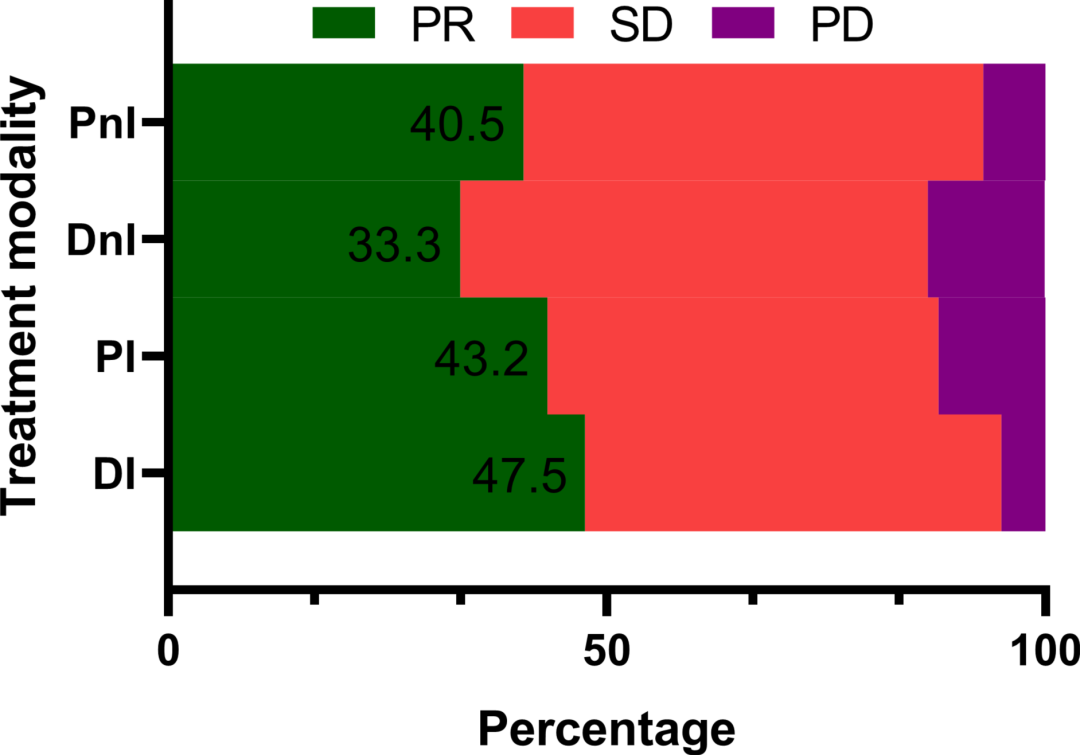
图3 不同治疗组的应答率
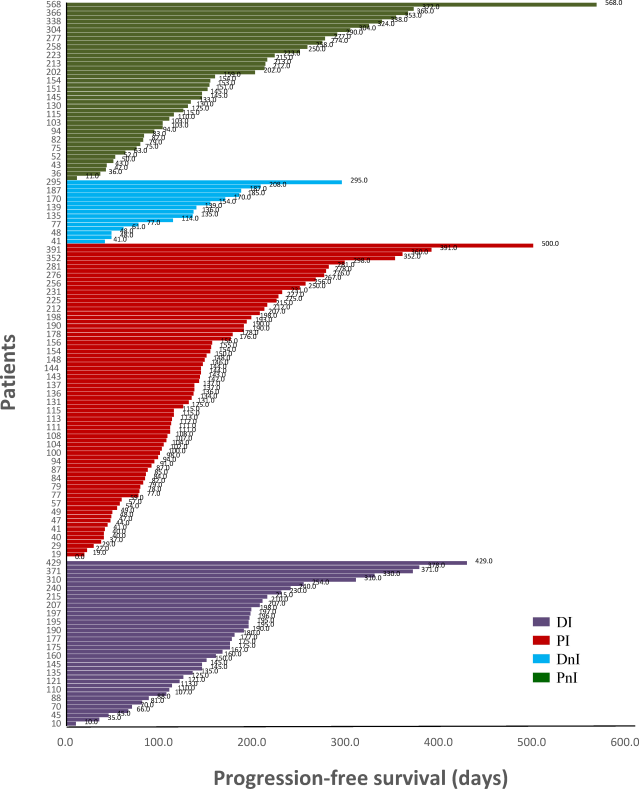
图4 不同治疗组的泳池分布图
2)免疫治疗人群中KRAS突变和其他驱动基因野生型患者使用地舒单抗+ICIs可能获益更多。分析的所有人群中,DI组相对于PI、DnI和PnI组,呈现出更好的mPFS趋势(mPFS:378、190、170、172天,p=0.115)(图5A)。为排除驱动基因等混杂因素对分析的影响,针对非驱动亚组人群(包括KRAS突变和其他驱动基因野生型病例)进行Kaplan-Meier分析,证实该人群中DI组mPFS显著优于其他对照组(mPFS:NR,225、170和133天,p=0.045)(图5B)。
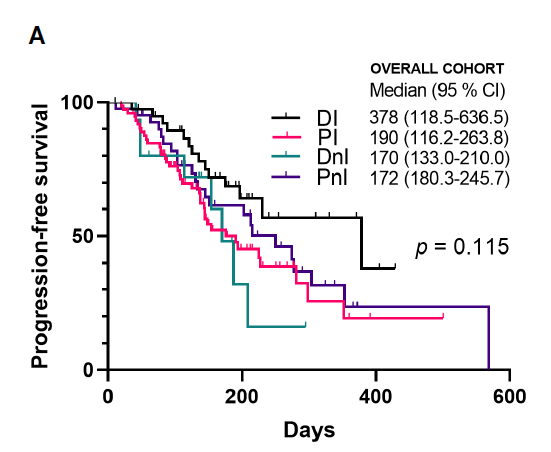
图5A 所有人群PFS的K-M曲线
图5B非驱动人群PFS的K-M曲线
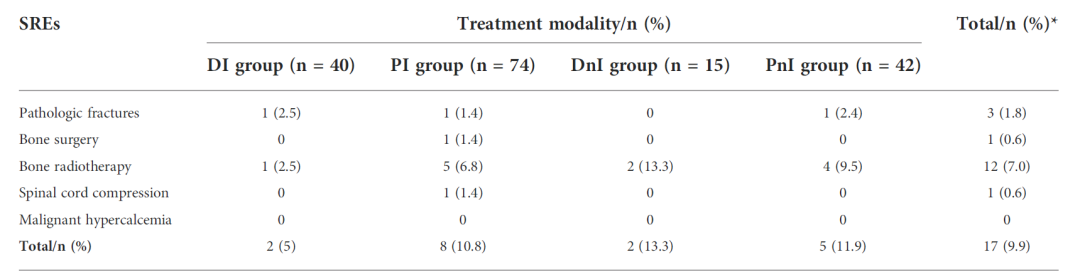
3)地舒单抗+ICIs可降低NSCLC骨转移患者的SREs发生率。在预防SREs方面,DI组的SREs发生率已显示出低于PI、DnI和PnI组的趋势(表1)。
表1 不同治疗组SREs发生率
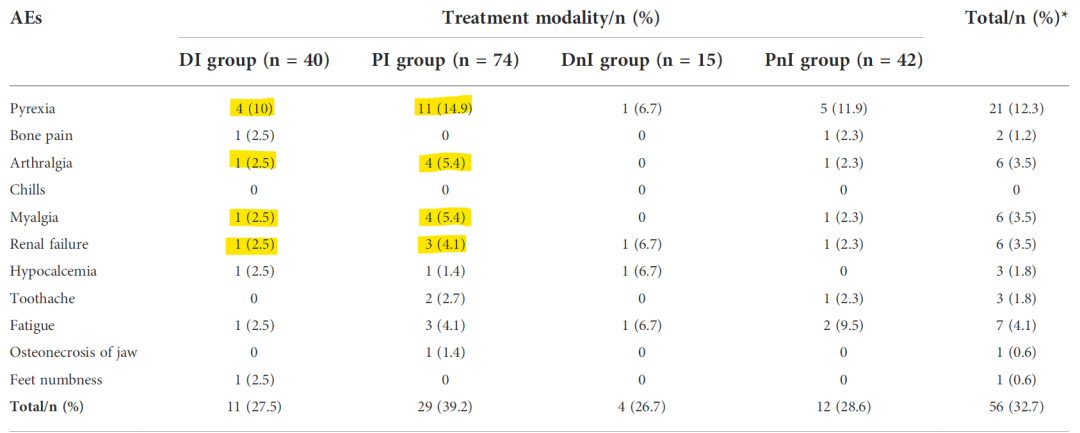
4)地舒单抗+ICIs安全性良好。安全性方面,所有人群最常见的AE是发热(12.3%),其次是疲劳(4.1%)、关节痛(3.5%)、肌痛(3.5%)和肾功能衰竭(3.5%)(表2)。PI组总体的AE高于其他3组(39.2%、27.5%、26.7%和28.6%),而DI组发热、关节痛、肌痛和肾功能衰竭等AE均少于PI组。
表2 不同治疗组的AE发生情况
地舒单抗作为首个作用于RANKL/RANK通路的单抗类骨改良药物,其治疗骨转移、延迟SREs发生的疗效和安全性已经被临床研究和全球患者验证。随着IO时代来临,免疫治疗已成驱动基因野生型肺癌患者的主流治疗模式,而临床医生也希望通过IO+的治疗模式增效减毒,进一步延长NSCLC患者的生存时间并改善生活质量。地舒单抗能否为接受IO治疗的肺癌骨转移患者带来更多的获益也成为临床医生、肿瘤患者和我们课题组都关心的话题。
有研究已证实RANK/RANKL均可在肿瘤微环境和局部淋巴结表达[9],并观察到RANKL抑制剂联合ICI可以抑制肺腺癌小鼠肿瘤生长[10]。Liede等人的一项纳入166例同时接受地舒单抗和ICIs治疗的NSCLC患者研究显示,联合治疗时间越长,患者OS获益越多[8],但由于缺乏外部对照组,仅有用药时间的比较可能导致结论不明确,因为能接受更长的联合治疗患者本身可能对免疫疗法更敏感。
因此在既往研究的基础上,我们进一步回顾性分析ICIs联合或不联合地舒单抗对患者生存、生活质量以及安全性的影响,结果发现联合治疗组确实有更好的ORR和mPFS,以及更低的SREs发生率,且安全性良好,这也是目前中国NSCLC人群使用地舒单抗和ICI联合治疗真实世界研究结果的首次公布。
此外还发现在免疫治疗人群中,KRAS突变和其他驱动基因野生型患者可能从联合治疗方案中获益更多,而Rao等人[11]发现KRAS突变肺癌患者RANK阳性表达更多,且RANKL高表达与KRAS突变患者不良预后显著相关(P=0.0051),所以也需要更多前瞻性数据进一步验证该结论。未来也期待有更多地舒单抗针对不同人群的联合治疗模式的证据公布,为NSCLC骨转移患者提供更多的治疗选择。
参考文献
[1]Ahern E, et al. Roles of the RANKL-RANK axis in antitumour immunity - implications for therapy. Nat Rev Clin Oncol. 2018Nov;15(11):676-693.
[2]地舒单抗(安加维®)说明书,核准日期2022年6月8日
[3]Scagliotti GV, et al. Overall survival improvement in patients with lung cancer and bone metastases treated with denosumab versus zoledronic acid: subgroup analysis from a randomized phase 3 study. J Thorac Oncol. 2012 Dec;7(12):1823-1829.
[4]Afzal MZ, Shirai K. Immune checkpoint inhibitor (anti-CTLA-4, anti-PD-1) therapy alone versus immune checkpoint inhibitor (anti-CTLA-4, anti-PD-1) therapy in combination with anti-RANKL denosumuab in malignant melanoma: a retrospective analysis at a tertiary care center. Melanoma Res. 2018 Aug;28(4):341-347.
[5]Ahern E, et al. Co-administration of RANKL and CTLA4 Antibodies Enhances Lymphocyte-Mediated Antitumor Immunity in Mice. Clin Cancer Res. 2017Oct 1;23(19):5789-5801.
[6]Ahern E, et al.RANKL blockade improves efficacy of PD1-PD-L1 blockade or dual PD1-PD-L1 and CTLA4 blockade in mouse models of cancer. Oncoimmunology. 2018 Feb4;7(6):e1431088.
[7]Faget J, et al. RANKL Signaling Sustains Primary Tumor Growth in Genetically Engineered Mouse Models of Lung Adenocarcinoma. J Thorac Oncol.2018 Mar;13(3):387-398.
[8]Liede A, et al. An observational study of concomitant immunotherapies and denosumab in patients with advanced melanoma or lung cancer. Oncoimmunology. 2018 Sep5;7(12):e1480301
[9]Ahern E, et al. Roles of the RANKL-RANK axis in antitumour immunity - implications for therapy. Nat Rev Clin Oncol. 2018Nov;15(11):676-693.
[10]Liede A,et al. An observational study of concomitant immunotherapies and denosumab in patients with advanced melanoma or lung cancer. Oncoimmunology. 2018 Sep 5;7(12):e1480301.
[11]Rao S, et al. RANK rewires energy homeostasis in lung cancer cells and drives primary lung cancer. Genes Dev. 2017 Oct 15;31(20):2099-2112.
查看更多