查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





血管生成在肿瘤发生发展中发挥重要的作用,伴随肿瘤发生发展的全过程,抗血管生成成为抑制肿瘤发生发展的重要手段,以血管内皮生长因子(VEGF)或表皮生长因子受体为靶点的新型生物疗法改善了临床结果,原研贝伐珠单抗作为代表更是为肠癌、肺癌、脑胶质瘤、肝癌患者带去生的希望,但同时,高昂的治疗费用却让诸多患者望而却步。
复宏汉霖秉持着为广大中国患者带来质高价优治疗选择的信念,潜心研发的贝伐珠单抗生物类似药HLX04在III期临床研究的设计上选择了转移性结直肠癌(mCRC)适应证,并达到研究的主要和次要研究终点,成为国内目前唯一拥有mCRC临床数据的贝伐珠单抗生物类似药。对此,我们特别邀请了同济大学东方医院的李进教授,为我们讲解HLX04治疗mCRC的过去、现在和未来。
回首过去:
抗血管生成治疗应惠及更多患者
结直肠癌(CRC)约占全球癌症相关死亡率的10%,是世界第三大癌症。近年来,伴随着中国经济的飞速发展,人民生活水平显著提高,生活习惯发生巨大改变,肠癌发病率也逐年升高。2020年世界卫生组织国际癌症研究机构(IARC)发布了全球最新癌症负担数据,中国新增CRC病例56万例,死亡29万例,肠癌一跃成为第二大常见癌症和第五大癌症相关死亡原因[1]。与此同时,大约20%的CRC患者在最初诊断时出现转移(mCRC),而mCRC的5年生存率仅为10%[2]。
尽管目前贝伐珠单抗经历了几轮降价,价格比最初进入中国市场时有所下调,并且也已经进入医保。但我国作为发展中国家,仍有大批低收入及贫困患者未被医保覆盖,不能承担这一治疗费用。此类患者亟需一种疗效与贝伐珠单抗一致、价格更低的药物。
李进教授认为:“世界在前进,科学正在不断发展,药物也需要不断更新换代。若能够用疗效一致、价格比较低廉的生物类似药取代昂贵的原研药物,可为普通百姓带来福音。同时也能够帮助到国家的经济建设,使更多资金应用到开发新产品中去,以便帮助中国在创新制药方面有更多的开拓。这也是我们决定将HLX04应用于mCRC患者治疗的初衷。”
HLX04治疗mCRC能否达到贝伐珠单抗同等疗效?国内III期临床研究给出了答案。
聚焦现在:
HLX04治疗mCRC与贝伐珠单抗具有相似的疗效及安全性
HLX04-mCRC03研究是一项随机、双盲、对照、多中心III期研究,于2018年4月13日至2020年4月15日间在中国的63家中心开展。677例患者按1:1随机分组接受HLX04(n=340)或贝伐珠单抗(n=337)治疗(7.5mg/kg,q3w联合XELOX;5mg/kg,q2w联合mFOLFOX6)。主要研究终点为基于RECIST v1.1标准评估的PFSR36w(36周时的PFS);次要研究终点包括最佳客观缓解率(BORR)、第6、12、18、24、30、36、42、48个月的客观缓解率(ORR)、12个月时的总生存率(OSR)、无进展生存期(PFS)、起效时间(TTR)、缓解持续时间(DOR)。
2020年8月,该III期研究达到主要及次要研究终点,在当年CSCO年会上首次口头汇报并摘得优秀论文奖殊荣。
2021年5月,该III期研究结果于BioDrugs正式刊出。
HLX04 vs. 贝伐珠单抗,主要终点PFSR36w具有等效性
HLX04组 vs. 贝伐珠单抗组的PFSR36w分别为46.4%(95%CI41.1–51.8) vs. 50.7%(95%CI 45.4–56.1),两组率差为-4.2%(90%CI −10.6 - 2.1),率比为0.92(90%CI 0.80–1.05),皆落在预先设定的等效界值范围之内(图1)。
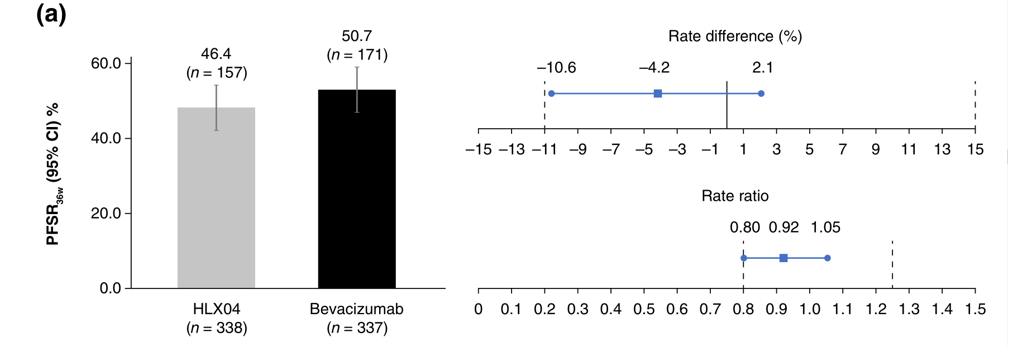
图1. CIR评估的PFSR36w(全分析集)
HLX04 vs. 贝伐珠单抗,次要终点无显著性差异
HLX04组第48周的BORR及第6、12、18、24、30、36、42、48周的ORR与贝伐珠单抗组相比,无显著性差异(表1)。
表1. CIR评估的客观缓解率汇总(全分析集)

图1. ASCEND-8研究亚洲人群3年OS率和PFS率
HLX04组与贝伐珠单抗组的12个月OSR(HR 0.92;95%CI 0.66–1.29;P=0.62)(图2a)、PFS(HR 1.07;95%CI 0.83–1.37;P=0.62)(图2b)、TTR(HR 1.11;95%CI 0.91–1.34;P=0.30)(图2c)或DOR(HR 1.14;95%CI 0.80–1.61;P=0.48)(图2d)均无显著性差异(图2)。

图2. 12个月的总生存率(a)、CIR评估的PFS(b)、TTR(c)、DOR(d)
HLX04 vs. 贝伐珠单抗,安全性相似
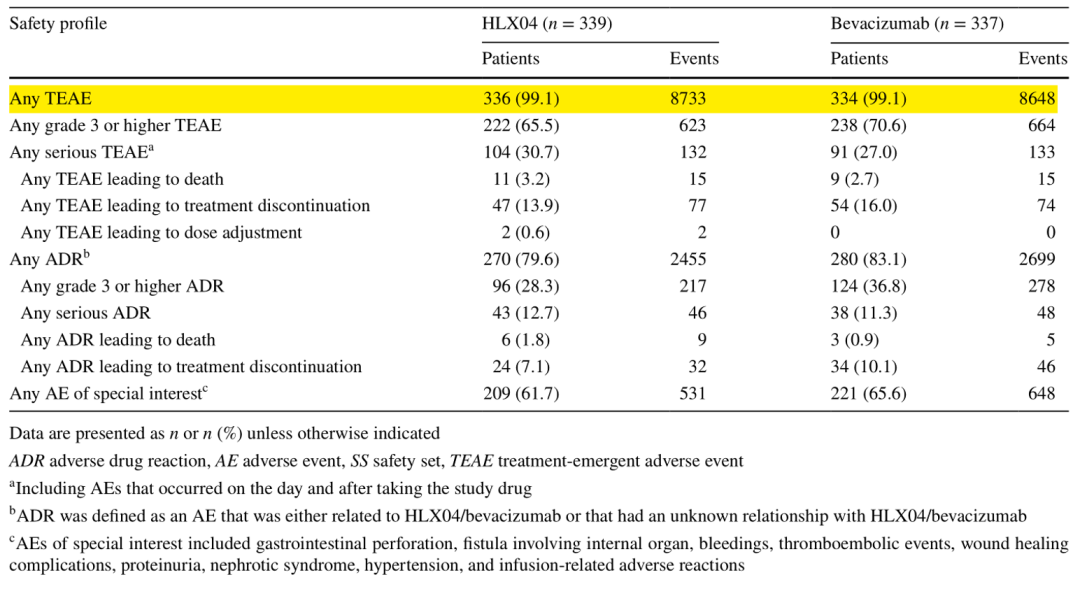
两组安全性相似,HLX04组 vs. 贝伐珠单抗组分别有336例(99.1%) vs. 334例(99.1%)患者至少经历了一次治疗紧急不良事件(TEAE)(表2)。HLX04组 vs. 贝伐珠单抗组分别有222例(65.5%)vs. 238例(70.6%)患者报告了≥3级TEAE。最常见的≥3级TEAE为中性粒细胞计数降低(20.6% vs 20.2%)、血小板计数降低(10.3% vs 10.1%)和高血压(7.4% vs 12.5%)。两组间的免疫原性相似,ADAs和NAbs的检出率相当。
表2. 治疗紧急不良事件汇总(安全性数据集)
HLX04-mCRC03研究结果的发表,再度为HLX04与原研贝伐珠单抗相似的疗效与安全性提供了有力证据,证实HLX04可作为mCRC治疗的新选择。
展望未来:
以临床价值为导向,以患者利益为核心
HLX04在抗血管生成治疗中大有可为
李进教授强调,无论做仿制品、生物类似药、还是创新药,其开发都需要以临床价值为导向,以患者利益为核心,需要满足以下四点:
1)疗效更高;
2)安全性更好;
3)价格低廉;
4)用药方便。
同时,李进教授表示,“进行生物类似药研发所花费的精力与研发创新药相差不多,但生物类似药在提高患者承受能力、降低治疗费用方面具有一定帮助。从这一点上来讲,应该对生物类似药的研发给予一定支持。”
“目前临床数据已经证实,至少在中国人群中,HLX04与原研产品完全一致。未来我希望HLX04能够早日上市,为广大中国结直肠癌患者提供更多选择,特别是为西部地区低收入人群、农村地区贫困人群提供帮助。因为人的生命只有一次,在生命面前,每个人都是平等的,每一条生命都弥足珍贵。”李进教授说道。
基于HLX04-mCRC03研究,HLX04成为国内目前唯一拥有转移性结直肠癌临床数据的贝伐珠单抗生物类似药,为贝伐珠单抗在中国结直肠癌患者人群中的应用积累了更多临床证据与经验。
目前,复宏汉霖已就HLX04用于转移性结直肠癌患者的治疗向国家药品监督管理局(NMPA)递交了上市注册申请(NDA)并正式获得NMPA受理。期待HLX04早日惠及更多癌症患者,带来质高价优的治疗选择。
参考文献
[1] Latest global cancer data: Cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020. Retrieved Dec 16, 2020, from
[2]. Shukui Qin, Jin Li, Yuxian Bai, et al. Efficacy, Safety,and Immunogenicity of HLX04 Versus Reference Bevacizumabin Combination with XELOX or mFOLFOX6 as First‑Line Treatment for Metastatic Colorectal Cancer: Results of a Randomized, Double‑Blind Phase III Study[J]. Bio Drugs. 2021 Jul; 35(4)445-458.
查看更多