查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





42岁女性患者,2024年9月18日入院。主诉剖宫产术后14年,发现腹部包块2个月。
2月前发现腹部肿物,大小约5cm,位于剖宫产疤痕之上,质硬,边界清,形态不规则,余无特殊表现。就诊外院,穿刺活检,后行分段诊刮。病理提示:子宫内膜透明细胞癌。
既往史:2009年发现哮喘,药物治疗;2018年哮喘复发,治疗1年。
孕产史:孕1产1,2009年行剖宫产1次。
月经史:LMP 2024-9-1,月经规则,经量正常,无痛经。
体格检查:耻骨联合上可见一长约12cm陈旧性瘢痕,其上可触及一大小约5cm肿物,边界清,质硬,形态不规则。BMI:26.5。专科检查:无特殊。
实验室检验(2024-9-11):CA125 13.2U/ml,CA199 5.15U/ml,AFP 1.15ug/L,CEA 4.95ug/L,HE4 426.9pmol/L,ROMA(绝经前)1.793%,ROMA(绝经后)5.86%,HPV(-)。入院后术前相关检查无明显异常。
2024-9-11全身PET-CT:1.前下腹壁腹直肌内稍高代谢软组织肿块,符合恶性肿瘤表现;2.宫腔内稍高代谢低密度灶,结合临床,建议诊刮;3.左肺上叶胸膜下小结节,代谢不高,良性病变可能;4.左肺尖少许纤维灶,右侧上颌窦及双侧筛窦黏膜增厚,双侧颈(Ⅰ区)淋巴结炎性增生;5.全身其他部位PET-CT显像无异常。
2024-9-13外院超声:子宫55mm×35mm×36mm,内膜13mm,内回声不均,稍高回声17mm×9mm,边界清内回声不均匀。CDFI:见点条状血流信号,双附件未见异常。子宫腺肌症;子宫内膜息肉?
2024-9-6腹壁肿物穿刺病理:纤维组织中见分化差的浸润癌,结合免疫组化结果,符合子宫内膜透明细胞癌,起源于子宫内膜异位症。
2024-9-14分段诊刮病理:(宫腔组织)子宫内膜单纯性增生;(宫颈组织)少许黏液组织,炎症细胞及破碎的宫颈内膜上皮。

诊断标准:
(1)恶性肿瘤与内异症组织于同一病变并存。
(2)两者有组织学相关性,有类似于子宫内膜间质的组织围绕于特征性内膜腺体,或有陈旧性出血。
(3)排除其他原发肿瘤的存在,或癌组织发生于内异症病灶,而不是从其他部位浸润或转移而来。
(4)有内异症向恶性移行的形态学证据,或良性内异症与恶性肿瘤的组织相接。
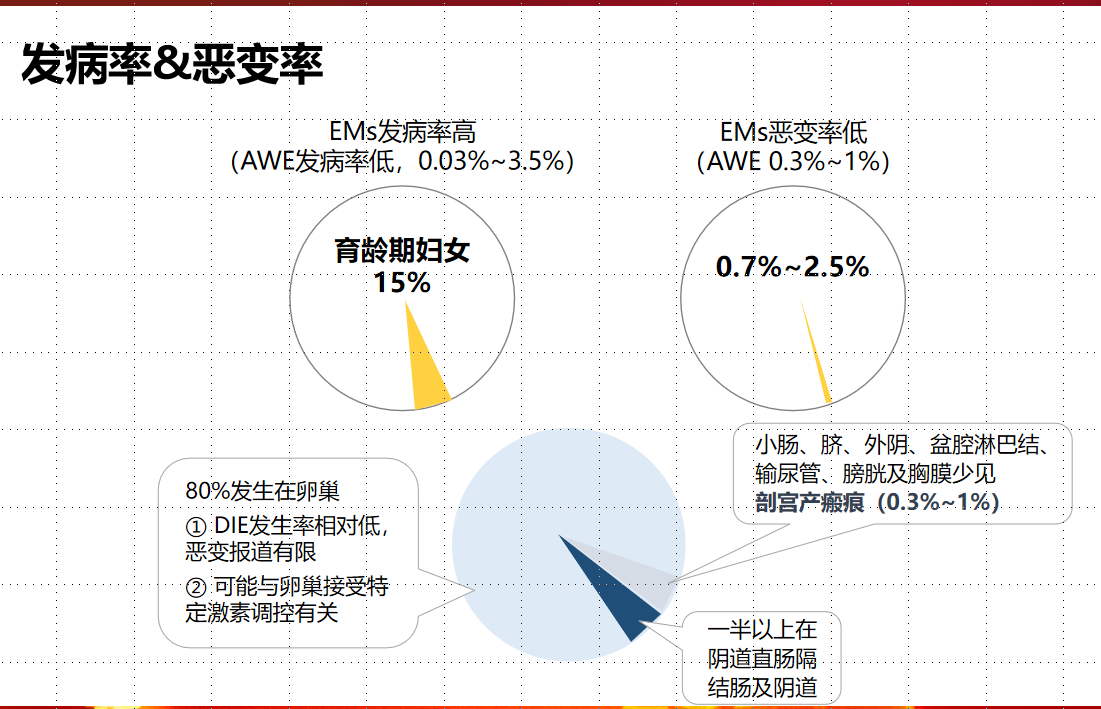
内异症恶变分为3类,①A类:卵巢癌与内异症发生在同侧卵巢,存在病理连续性。②B类:卵巢癌与内异症发生在同侧卵巢,不存在病理连续性。③C类:卵巢癌与内异症发生在对侧卵巢或是子宫、输卵管、肠道等性腺外器官。腹壁子宫内膜异位症恶变属于C类。
总体原则:因子宫内膜异位症恶变发病率低,无特定标准治疗方案,主要参考上皮性卵巢癌治疗。术后辅助治疗以TC方案为主,可采用贝伐珠单抗或PARP抑制剂维持治疗。
腹壁子宫内膜异位症治疗以手术切除为主,初次手术尽量扩大切除病灶。若病灶>3cm或手术可能累及筋膜,必要时考虑补片修补,避免腹壁疝发生。文献报道还可采用放疗或联合孕激素治疗。对于已发生远处转移的患者,采用铂类为主的化疗,但疗效不确切。
本病例中,对患者进行腹壁肿物扩大切除+全子宫切除+双附件切除+盆腔淋巴结清扫+大网膜切除,术后进行腹壁缺损无张力修补。后续病理回报腹壁肿物为子宫内膜微卫星不稳定肿瘤,以透明细胞为主。术后参照卵巢上皮癌辅助治疗方案,予以TC方案化疗,术后1个月左右给予卡铂+紫杉醇化疗,第二个疗程患者出现视物模糊副反应,改为卡铂+多柔比星脂质体化疗方案。患者术前肿瘤指标无明显升高,术后在建议下进行基因检测,测序结果显示两个有临床意义的Ⅱ类突变,即AURK基因和PIK3CA基因突变,其中ATM基因提示可能对帕博利珠单抗、奥拉帕利敏感,但为低级别的证据。
腹壁子宫内异症恶变预后良好的因素包括年龄<60岁、肿瘤体积较小、组织高分化、无转移、早期切除以及病理类型为子宫内膜样腺癌。本病例患者年龄偏小,但肿瘤体积偏大,组织学类型为透明细胞癌,整体预后偏差,文献报道腹壁透明细胞癌中位生存期约30个月,患者目前仍在化疗,需继续随访。
对于子宫内膜异位症恶变的防治,提倡早诊断早治疗,积极干预,治疗关口前移。围绝经期女性是腹壁内膜异位症恶变高危人群,有症状者手术治疗为一线选择;长期或反复发生的内异症,或超声提示囊肿有乳头、血流丰富等情况,也是手术治疗指征;药物治疗失败,完成生育者应行全宫+双附件手术切除。手术治疗后,若患者未完全绝经,建议使用孕激素或GnRH-a进行长期管理。对于早发现的腹壁子宫内膜异位症,除手术外,还可采用HIFU、经皮冷冻消融等方式治疗。有高危因素的患者,建议预防性治疗,包括激素治疗或预防性的切除手术。
查看更多
专家点评
腹壁子宫内膜异位症本身是相对常见的良性疾病,但其恶变率极低,约为1%,然而一旦发生恶变则恶性程度高,需引起临床高度重视。
本例诊疗过程为我们提供了重要经验。首先,早期诊断至关重要。患者因发现腹壁包块短期内增大、伴压痛而及时就医,并通过病灶穿刺活检得以明确恶性诊断,为后续治疗赢得了时间。这提示我们对有剖宫产史的妇女,若腹壁瘢痕处出现持续存在、短期内增大或伴有压痛的包块,应警惕恶变可能,及时进行病理学评估。
其次,手术治疗范围是关键。我们借鉴国内外经验并结合自身实践,对此类恶变病灶采取了局部扩大范围切除,以确保切缘阴性,避免残留。因切除范围较大,术中联合外科医生并使用了补片进行修补。目前患者预后良好,无复发迹象。
总之,虽然腹壁子宫内膜异位症恶变属于罕见疾病,但通过提高警惕实现早期诊断,并实施根治性的扩大范围手术,可以有效改善患者预后。随着临床经验的积累,我们将能为此类患者提供更规范的诊疗。