查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





背景
MMR活性 (dMMR)丧失与肿瘤发展和高度微卫星不稳定性 (MSI-H)有关。这些肿瘤存在大量移码和单核苷酸变异体,并以高肿瘤突变负荷为特征 (TMB)。在所有肿瘤类型中,MSI-H肿瘤与肿瘤浸润淋巴细胞增加和程序性死亡配体1 (PD-L1)表达富集有关。这些临床病理学观察结果是免疫检查点抑制剂 (ICI)治疗的免疫原性和临床反应性的部分基础。在胃癌(GC)中,MSI-H在9-22%的非转移性病例和3-14%的晚期病例中观察到。
简介

2021年4月12日,来自韩国首尔成均馆大学医学院三星医疗中心内科血液肿瘤科的Jeeyun Lee及其团队在Cancer Discov (IF: 29.497)杂志上发表名为Determinants of Response and Intrinsic Resistance to PD-1 Blockade in Microsatellite Instability-High Gastric Cancer的研究[1]。
主要结果
临床预后
截止数据 (2020年6月3日),18例患者的中位随访时间为19.5个月。3名患者达到完全缓解 (CR),7名患者获得确认部分缓解 (PR),6名患者病情稳定,总体缓解率(ORR)为55.6%,疾病控制率 (DCR)为88.9% (图1A和B)。在完全应答者中,2例患者完成了35个周期的培布罗珠单抗治疗,并在停用培布罗珠单抗后继续处于CR状态。应答的深度是显著的;根据实体瘤应答评估标准 (RECIST) 1.1,7例PRs中有5例的肿瘤负荷降低超过50%(图1A)。在所有纳入的患者中(n=19),7名患者死亡,11名患者在数据截止日继续接受研究治疗。中位总生存期和中位无进展生存期相同,为26.9个月。PR患者的中位应答持续时间为21.2个月 (图1B)。此外,与基线相比,在6个月内肿瘤减小超过50%的患者对培布罗珠单抗保持了持久的应答 (图1C)。7例SD患者中,3例 (42.9%)在6个月内进展 (图1C)。在所有可评估的患者 (n=18)中,13名患者 (72.2%)表现出持久的临床获益 (DCB),其定义为超过6个月的无进展生存期。出现DCB的患者PFS和OS均优于其他患者。
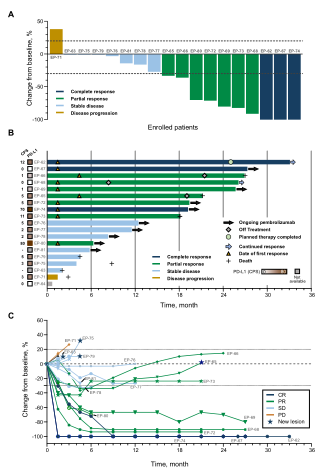
图1. 微卫星不稳定性高 (MSI- H)胃癌 (GC)患者对pembrolizumab的应答
基因组改变和TMB升高与培布罗珠单抗应答的关系
我们分析了15例MSI-H mGC患者的培布罗珠单抗 (pembrolizumab)前和后体细胞基因组图谱。我们首先试图识别与对培布罗珠单抗的临床反应显著相关上网治疗前基因组改变 (突变和拷贝数变异) (图2A)。虽然大多数患者得到了一定程度的控制,但我们观察到EP-76和EP-77患者的CDH1和JAK2突变,稳定的疾病是他们的最佳反应。同样,EP-63患者表现出难治性腹膜癌,并伴有CDH1、RHOA、ERBB2和FGFR2的改变,但肿瘤没有显著减少。在无应答者中发现了与Wnt/β-连环蛋白通路相关的AXIN1和PTCH1突变。综上所述,先前与先天PD-1耐药性相关的基因组改变在患者中占了过多的比例,但受益程度较小,尽管由于数量较少,这些相关性没有达到统计学意义。这种差异可能是由于MSI-H肿瘤中由DNA错配修复缺陷驱动的乘客事件的高度积累,我们观察到MMR通路成员中广泛分布的致病突变 (图2A),和预测一样,我们队列中有高度富集的dMMR突变特征 (图2B)。
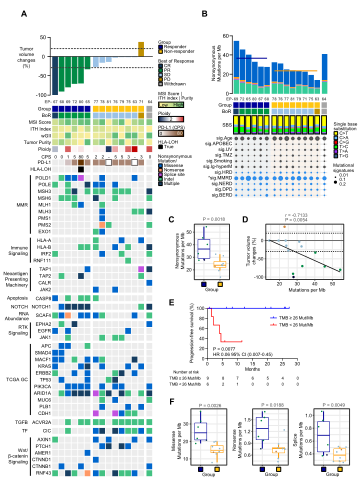
图2. 微卫星不稳定性高(MSI-H)胃癌(GC)患者的基因组景观和肿瘤突变负荷
pembrolizumab治疗后MSI-H GC的纵向肿瘤演变
癌症免疫编辑假说认为,免疫系统可有效消除存在源自肿瘤突变的新抗原的高免疫原性癌症克隆,从而选择免疫原性差或免疫逃避性差的克隆。为了研究在pembrolizumab治疗压力下MSI-H mGC中的肿瘤演变,我们通过映射内镜活检收集了pembrolizumab治疗前后病例的系列多区域活检,并分析了pembrolizumab治疗期间的分子演变动力学。有趣的是,在pembrolizumab治疗后,达到CR或PR的患者在多个病变中的突变负荷显著减少,而无应答的患者突变数量极少减少 (图3A)。
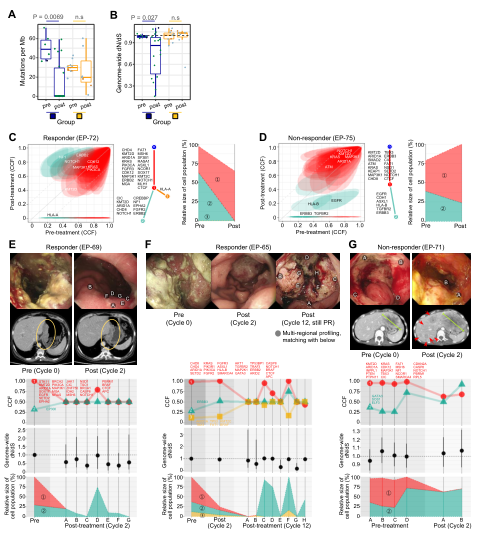
图3. pembrolizumab单药治疗期间MSI-H GC中的纵向肿瘤演变
TCR信号通路和TCR repertoire多样性增加与派姆单抗的临床应答的相关性
为了阐明与pembrolizumab应答相关的潜在转录特征或分子决定因素,我们比较了预处理MSI-H GC标本与正常邻近组织 (NAT)标本的基因表达谱。基因特征富集分析显示,对pembrolizumab反应良好的患者中,与T细胞受体 (TCR)信号通路相关的通路显著增加,反映了预先存在的免疫识别 (图4A)。应答者组中IL-2介导的信号事件也增多,IL-2对T细胞存活和活化至关重要,而在T细胞衰竭期间显著丢失。
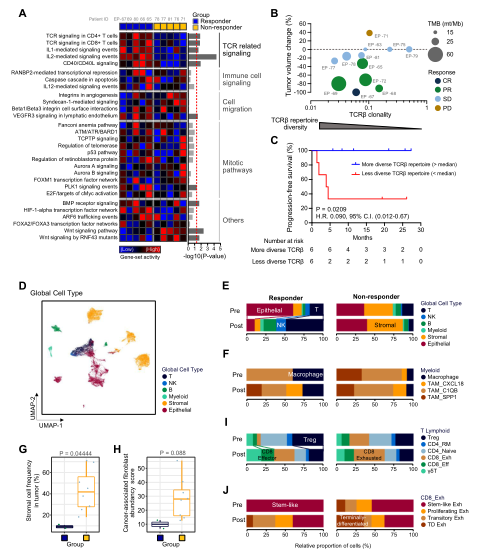
图4. MSI-H GC中免疫微环境与pembrolizumab应答的关系
外周T细胞与培布罗珠单抗反应之间的关联
鉴于组织中效应T细胞的扩张与pembrolizumab应答相关,我们假设外周血 (PB) T细胞的动态变化可能是MSI-H GC治疗获益的非侵入性标记物,正如在肺癌患者中所建议的那样。采用多色流式细胞术,分析了两个周期培布罗珠单抗治疗前后的PB T细胞群。考虑到pembrolizumab的作用靶点是PD-1表达细胞,我们重点研究了PB中PD-1+ T细胞的特性和动力学。在所有纳入的患者中,pembrolizumab治疗期间PB PD-1+CD8+ T细胞中ki-67+细胞的百分比显著增加,表明表达PD-1的细胞对pembrolizumab有反应而增殖 (图5A)。相反,在pembrolizumab治疗期间,PB ki-67+ PD-1+ Treg细胞的百分比显著降低。pembrolizumab治疗期间,PB中CD8+ T细胞数与Tregs数之比无显著差异,且与对pembrolizumab的应答无关。因此,PB CD8+ T细胞和Tregs的比例变化并不反映在肿瘤组织中观察到的免疫细胞的变化。此外,在我们的队列中,胸腺细胞选择相关的高迁移率盒蛋白 (TOX,T细胞耗竭的主要调节因子)的强度在治疗期间或与培布罗利珠单抗应答相关时没有显示出任何差异 (图5A)。
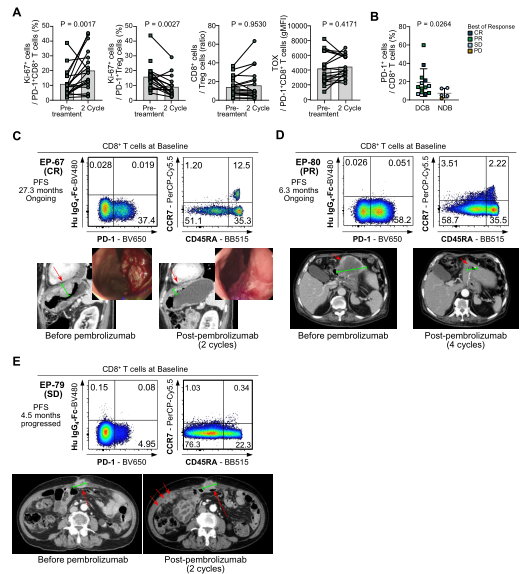
图5. 外周血 (PB) T细胞与pembrolizumab应答的关系
结论及展望
在20%的胃癌 (GC)中观察到微卫星序列改变和突变负荷增加,且与抗程序性死亡 (PD)-1抗体的临床应答相关。然而,50%的微卫星不稳定性高 (MSI-H)癌症对PD-1治疗具有耐药性。我们在晚期MSI-H GC患者中进行了一项pembrolizumab的II期试验,除了系列外周血分析外,还包括系列和多区域组织样本。全外显子组测序 (WES)衍生的非同义突变的数量与抗肿瘤活性和延长的无进展生存期 (PFS)相关。将WES与单细胞RNA测序相结合,我们发现在应答者中,肿瘤的动态进化与治疗中突变结构的崩溃更相关。不同的T细胞受体序列与pembrolizumab的PFS时间延长有关。此外,PD-1+ CD8+ T细胞的增加与持久的临床获益相关。我们的发现强调了MSI-H GC的基因组、免疫学和临床结果的异质性,并可能为制定增强反应性的策略提供信息。
查看更多