查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





点击下图↓,查看专题更多内容
作者:复旦大学附属华山医院 贺定贤 赵重波
2025年,重症肌无力(MG)的诊疗范式正经历着一场深刻的变革。这一年,我们见证了治疗目标从单纯的“症状改善”向“双达标(疗效与安全并重)”的跨越,更看到了从传统的“免疫抑制”向“免疫重置”的实践升维。从嵌合抗原受体(CAR)T(CAR-T)细胞疗法的突破性数据,到靶向药物在真实世界中的长期验证,再到固有免疫致病新机制的阐明,全球MG研究呈现出井喷之势,中国在MG领域发表的研究已占全球近1/4(图1)。
本文将系统梳理2025年度国际MG领域的核心进展,深度剖析这些新证据如何重塑我们的临床实践。

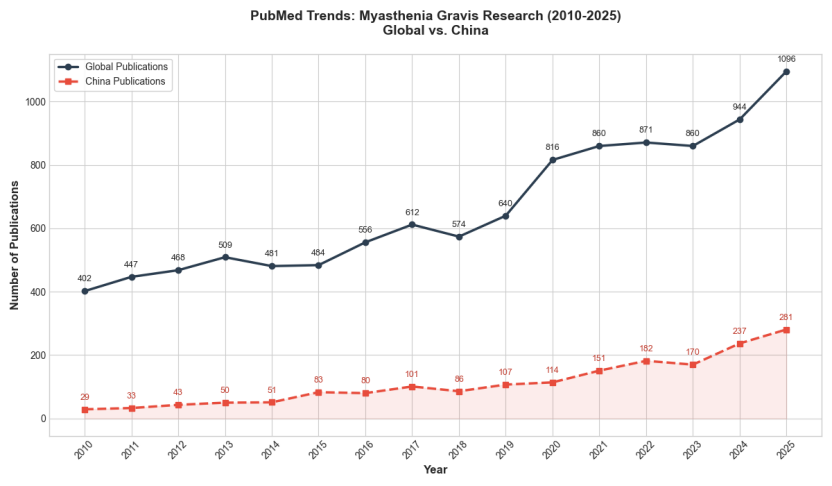
图1 2010~2025年重症肌无力(MG)研究(全球与中国对比)
2025年是CAR-T细胞治疗MG的里程碑之年,多个平台相继报告了足以支持Ⅲ期临床推进的疗效数据。
徐州医科大学附属医院开展的B细胞成熟抗原(BCMA)/CD19双靶点CAR-T Ⅰ期试验纳入18例难治性患者,治疗后第180天,15例(82%)达到微小症状状态,16例(88%)停用糖皮质激素,近半数实现抗体血清学转阴。
Descartes-08是一种无需淋巴细胞清除化疗的BCMA靶向信使核糖核酸(mRNA)CAR-T疗法,可在门诊完成治疗,Ⅱb期试验应答率达67%且全程未观察到细胞因子释放综合征(CRS),Ⅲ期的AURORA试验已启动。
KYV-101在Ⅱ期试验纳入的6例患者中应答率达100%,治疗后24周重症肌无力日常活动量表(MG-ADL)和重症肌无力定量评分表(QMG)均显著改善,Ⅲ期试验亦已于年底启动。
临床前研究方面,嵌合自身抗体受体T细胞(CAAR-T)利用乙酰胆碱受体(AChR)α亚基胞外结构域特异性靶向AChR反应性B细胞,有望实现精准清除同时避免广泛免疫抑制。

2025年,Nipocalimab获得美国食品与药物管理局(FDA)批准用于治疗AChR-Ab+和肌肉特异性受体酪氨酸激酶(MuSK)-Ab+全身型MG,每两周一次皮下注射的给药方式为患者提供了更大便利。
Efgartigimod的适应证进一步拓展至特殊人群,一项开放标签研究首次前瞻性证实其在血清双阴性MG中的疗效,6个月时应答率达72%;针对高龄患者(≥80岁)的研究显示,91.7%的患者在1周左右实现明显改善;合并胸腺瘤、恶性肿瘤、甲状腺疾病或其他自身免疫性疾病可能预示着对Efgartigimod应答不佳。机制研究揭示该药物除降低免疫球蛋白(Ig)G外,还可诱导调节性浆细胞生成,提示其具有主动免疫调节作用。

RAISE-XT开放标签延长研究提供了zilucoplan迄今最长的随访数据:至第120周,61.1%的患者减少或停用糖皮质激素(平均减量15.5 mg),29.8%的患者减少非甾体免疫抑制剂。意大利ZILU25真实世界研究亦证实其激素减量效果(24周时泼尼松平均减量8.3 mg)。基于美国医疗索赔数据的比较研究显示,C5抑制剂的激素减量效果优于Efgartigimod,口服激素日剂量分别减少11.2 mg和3.6 mg(P=0.034),非甾体免疫抑制剂减量比例分别为28.3%和0。
补体抑制剂在难治性肌无力危象和围手术期管理中展现价值。Ravulizumab用于晚期胸腺瘤(Masaoka Ⅳa期)合并难治性危象患者的研究显示,3例患者中有2例短期内成功脱离机械通气;另有个案报道单次负荷剂量的Ravulizumab(2700 mg)可使经血浆置换和静脉注射免疫球蛋白(IVIG)治疗无效的患者在48小时内得到显著改善。一项纳入1254例胸腺切除术患者的多中心研究表明,合并胸腺瘤的患者术后恶化风险增加40%[风险比(HR)1.40]、眼肌型转为全身型的风险增加137%[比值比(OR)2.37];而补体抑制剂可显著改善围手术期预后,Eculizumab组术后1周QMG改善7.39分,优于标准治疗组的0.25分(P=0.0001),术后危象发生率亦明显降低(9.1% 对 20%)。

2025年发表的Cochrane系统评价纳入了2项随机对照试验(RCT),共99例患者:结果显示利妥昔单抗可降低需要挽救治疗的复发风险[相对危险度(RR)0.45,95%置信区间(CI)0.26~0.78],证据确定性为中等,但其对症状严重程度的影响尚不明确。
RINOMAX试验长期随访数据进一步表明,早期使用利妥昔单抗可改善疾病转归,12个月和24个月时QMG评分差异分别为2.9分(P=0.005)和2.6分(P=0.027),挽救治疗率显著降低,住院风险降低76%(HR 0.24)。基于上述证据,2025年英国神经科医师协会(ABN)更新的《自身免疫性重症肌无力管理指南》推荐在全身型MG发病1年内早期使用利妥昔单抗。

2025年MG生物标志物研究取得多项进展,新型自身抗体的发现拓展了对MG异质性的认识。研究者通过免疫沉淀/质谱技术在血清阴性MG中发现了针对醛缩酶A(ALDOA)的自身抗体。另一项研究在12%的MuSK-MG患者中检测到疾病特异性IgA抗体,这些抗体对B细胞耗竭治疗耐药并与IgG4具有协同致病作用,提示MuSK-MG发病可能涉及黏膜/环境因素。
疗效预测标志物研究同样取得突破:成纤维细胞生长因子(FGF)-19可预测Efgartigimod应答,AH50(补体旁路途径溶血活性检测)可预测Ravulizumab疗效,钙卫蛋白和神经丝轻链则与C5和FcRn抑制剂应答不佳相关。一项多中心研究通过Olink炎症Panel识别出可区分MG与多发性硬化(MS)、慢性炎性脱髓鞘性多发性神经根神经病(CIDP)的特异性血清标志物组合,通过可穿戴设备结合机器学习算法可有效预测MG的恶化[曲线下面积(AUC)0.85],为疾病监测提供了新工具。

2025年MG基础研究取得重要突破,中性粒细胞胞外诱捕网(NETs)和血小板作为连接固有免疫与适应性免疫的新型致病因子被首次系统阐明。宣武医院团队发现MG患者外周血中低密度粒细胞(LDGs)显著升高并与疾病严重程度相关,可诱导促炎性辅助性T细胞(Th)1/Th17应答形成正反馈环路。另一项研究揭示了“中性粒细胞-B细胞激活因子(BAFF)-浆细胞轴”在急性加重中的作用,基线中性粒细胞水平较高的患者对泰它西普治疗获益更大。
Nature Communications发表的研究首次揭示血小板在MG中的促炎作用,NETs与血小板形成双向活化环路,血小板通过分泌RANTES促进Th1应答并抑制调节性T细胞(Treg)分化。白细胞介素(IL)-17/Th17轴研究亦取得进展,使用IL-17A抑制剂司库奇尤单抗治疗24周时QMG评分降低60.7%,Th17细胞频率下降68%。
胸腺病理和B细胞异质性研究进一步深化了对MG发病机制的理解。迄今最大规模的MG胸腺单细胞图谱(237661个细胞)揭示病理性B细胞上调TNFRSF17以获取BAFF生存信号,BAFF-BCMA轴成为可药物化靶点。B细胞研究揭示了亚型特异性差异,AChR-MG主要由IgG1~3抗体介导并与长寿浆细胞相关,MuSK-MG由IgG4驱动并与短寿浆母细胞相关,这解释了两种亚型对抗CD20治疗的不同反应。
此外,IMPDH2-SRPK1-AKT/mTOR轴被证实是CD4+T细胞活化的关键驱动因素,肠道菌群研究发现产短链脂肪酸细菌减少和致病菌增加可通过调节Treg/Th17平衡参与MG发病。

2025年多部指南更新,推动MG治疗目标向“双达标”迈进。
《中国重症肌无力诊断与治疗指南(2025版)》首次提出“疗效达标”[最小症状表达(MSE),即MG-ADL评分0~1分]与“安全达标”(泼尼松≤5~10 mg/d)并重的理念,并纳入FcRn抑制剂、补体抑制剂及CAR-T等新兴疗法。
ABN指南将隔日激素调整为每日方案,强调早期胸腺切除,并首次基于RCT证据推荐全身型MG发病1年内早期使用利妥昔单抗。
国际Delphi共识由8个国家、70位专家达成,将口服激素≤5 mg/d确立为长期目标剂量,推荐使用生物制剂以减少激素需求。

真实世界研究揭示了MG管理中持续存在的挑战。荷兰-比利时登记研究显示,36%的患者在10年后仍在使用糖皮质激素;而日本医疗索赔分析证实高剂量激素与长期住院风险增加83%相关,达到≤5 mg/d目标的患者医疗费用和并发症显著减少;巴西数据显示病死率从2011年的0.76%上升至2023年的1.90%,频繁的治疗转换提示症状控制不充分。
特殊人群研究同样值得关注。青少年MG多中心研究识别出继发泛化的危险因素,包括青春期发病(OR 5.2)和胸腺增生(OR 11.4),晚发型MG预后较差,仅66.7%达到微小症状状态;MG妊娠研究显示子痫前期、剖宫产、早产和小于胎龄儿发生率均显著升高,61.2%的患者在妊娠期间未接受治疗;此外,中国MG患者抑郁和焦虑患病率分别为35.5%和30.1%,心理挑战独立于症状稳定性而持续存在。


2025年,MG治疗正经历从“症状控制”向“免疫重置”的范式转变。CAR-T细胞治疗从早期探索迈向注册临床试验,靶向药物的长期随访数据支持其激素减量效果,NETs和血小板等新型致病机制的阐明为未来治疗提供了新方向,多部国际指南确立的“双达标”理念正在重塑临床实践。
与此同时,药物可及性、治疗排序、长期安全性以及发病机制的深入解析仍是亟待解决的问题,我们期待这些进展能尽早惠及每一位MG患者。
1. Zhang M, Zhang Y, Liu P, et al. Anti-ALDOA antibody: a novel diagnostic-associated autoantibody in myasthenia gravis. Front Neurol. 2025;16:1696583. doi:10.3389/fneur.2025.1696583
2. Zhang Y, Liu D, Zhang Z, et al. Anti-BCMA/CD19 CAR T cell therapy in patients with refractory generalized myasthenia gravis: a single-arm, phase 1 trial. EClinicalMedicine. 2025;90:103621. doi:10.1016/j.eclinm.2025.103621
3. Wiendl H, Murai H, Narayanaswami P, Saccà F, Silvestri NJ, Howard JF. Appropriate use of steroids for patients with generalized Myasthenia Gravis: an international Delphi study. Ther Adv Neurol Disord. 2025;18:17562864251398375. doi:10.1177/17562864251398375
4. Jacob S, Farrugia ME, Hewamadduma C, et al. Association of British Neurologists (ABN) autoimmune myasthenia gravis management guidelines (2025 update). Pract Neurol. 2025;25(5):422-437. doi:10.1136/pn-2025-004655
5. Bhandage AK, Hoffmann S, Dusemund C, et al. AXIN1, STAMBP, ST1A1, CDCP1, and SIRT2 Validated as Myasthenia Gravis Biomarkers: A Comparative Proteomic Study With MS, CIDP, and Controls. Eur J Neurol. 2025;32(11):e70426. doi:10.1111/ene.70426
6. Stascheit F, Schulze D, Lehnerer S, et al. Calprotectin and neurofilament serum levels correlate with treatment response in myasthenia gravis under intensified therapy-A pilot study. J Autoimmun. 2025;157:103476. doi:10.1016/j.jaut.2025.103476
7. Hewamadduma C, Freimer M, Genge A, et al. Changes in corticosteroid and non-steroidal immunosuppressive therapy with long-term zilucoplan treatment in generalized myasthenia gravis. J Neurol. 2025;272(7):457. doi:10.1007/s00415-025-13113-0
8. Jacobson MH, Makadia R, Anderson AEL, et al. Characterizing Perinatal Treatment Patterns and Outcomes in Myasthenia Gravis. Muscle Nerve. Published online December 3, 2025. doi:10.1002/mus.70090
9. Numajiri N, Yamamoto T, Waratani M, Takahashi MP. Clinical Impact of High-Dose Corticosteroids on Healthcare Resource Utilization and Steroid-Related Complications in Patients with Myasthenia Gravis in Japan. Neurol Ther. Published online November 12, 2025. doi:10.1007/s40120-025-00850-7
10. Oh S, Khani-Habibabadi F, O’Connor KC, Payne AS. Composition and function of AChR chimeric autoantibody receptor T cells for antigen-specific B cell depletion in myasthenia gravis. Sci Adv. 2025;11(9):eadt0795. doi:10.1126/sciadv.adt0795
11. Chahin N, Sahagian G, Feinberg MH, et al. Durability of Response to B-Cell Maturation Antigen-Directed mRNA Cell Therapy in Myasthenia Gravis. Ann Clin Transl Neurol. 2025;12(11):2358-2366. doi:10.1002/acn3.70167
12. Di Stefano V, Rini N, Antozzi C, et al. Early real-life experience on Zilucoplan for generalized myasthenia gravis: ZILU25 multicenter observational study. J Neurol Sci. 2025;479:125671. doi:10.1016/j.jns.2025.125671
13. Wu H, Chu X, Zhong H, et al. Eculizumab as a new option for perioperative treatment in thymoma-associated myasthenia gravis. Clin Immunol. 2025;283:110657. doi:10.1016/j.clim.2025.110657
14. Hong Y, Yuan CW, Lu J, et al. Efgartigimod for generalized myasthenia gravis in the extreme elderly (≥80 years): a multicenter retrospective real-world study. Front Immunol. 2025;16:1685233. doi:10.3389/fimmu.2025.1685233
15. Niu Z, Wang J, Ren J, et al. Efgartigimod non-responders after the first treatment cycle in generalized myasthenia gravis: a retrospective analysis of predictive factors. Front Neurol. 2025;16:1715486. doi:10.3389/fneur.2025.1715486
16. Li G, Xiong Y, Li Z, et al. Gut microbiota-derived metabolites modulate Treg/Th17 balance: novel therapeutic targets in autoimmune diseases. Front Immunol. 2025;16:1710733. doi:10.3389/fimmu.2025.1710733
17. Masi G, Chen K, Bayer AC, et al. IgA autoantibodies demonstrate a novel mechanism of MuSK myasthenia gravis pathology. Brain. Published online October 28, 2025:awaf410. doi:10.1093/brain/awaf410
18. Ren Y, Wu T, Liu Z, et al. IMPDH2 facilitates CD4+ T cell activation through AKT/mTOR pathway by upregulating SRPK1 in myasthenia gravis. Clin Immunol. 2026;282:110634. doi:10.1016/j.clim.2025.110634
19. Gerischer L, Stascheit F, Mönch M, et al. Inhibition of Classical and Alternative Complement Pathway by Ravulizumab and Eculizumab. Ann Clin Transl Neurol. Published online November 19, 2025. doi:10.1002/acn3.70251
20. Remijn-Nelissen L, Tannemaat MR, Verschuuren JJ. Longitudinal treatment patterns in myasthenia gravis: An analysis from the prospective Dutch-Belgian patient registry. J Neuromuscul Dis. Published online December 9, 2025:22143602251405924. doi:10.1177/22143602251405924
21. Yan Y, Patino DA, Zhao Y, Wu X, Budinger GRS, Bharat A. Myasthenia thymus reprograms class-switched B cells into BAFF-dependent survivors. bioRxiv. Published online September 21, 2025:2025.09.19.677075. doi:10.1101/2025.09.19.677075
22. Mitsutake A, Suzuki A, Murai H, Iwata NK. Myasthenic crisis associated with invasive thymoma successfully treated with ravulizumab: A case series. J Neurol Sci. 2025;479:125662. doi:10.1016/j.jns.2025.125662
23. Hussain JM, Ashfaq A, Shahid A, Mudassir F. Nipocalimab-aahu in generalised myasthenia gravis: A new Fc receptor-targeted option for antibody-positive patients. Ibrain. 2025;11(4):524-530. doi:10.1002/ibra.70006
24. Luo T, Peng D, Zhang Z, et al. Olink Proteomics Analysis Reveals Heterogeneous Responses to FcRn Blockade in Anti-AChR Antibody-Positive Myasthenia Gravis: FGF-19 as a Novel Biomarker. Ann Clin Transl Neurol. Published online November 27, 2025. doi:10.1002/acn3.70261
25. Khateb M, Sivadasan A, Barnett-Tapia C, et al. Open-label study of efgartigimod in seronegative myasthenia gravis. Ther Adv Neurol Disord. 2025;18:17562864251388019. doi:10.1177/17562864251388019
26. Saccà F, Lee J, Yee KS, Silvestri NJ, Sabatella G. Oral Corticosteroid and Nonsteroidal Immunosuppressant Therapy Use in Patients with Myasthenia Gravis Receiving Ravulizumab, Eculizumab, or Efgartigimod in the USA. Neurol Ther. Published online December 13, 2025. doi:10.1007/s40120-025-00873-0
27. Huang X, Yu ZH, Cui Y, et al. Outcomes in Relation to the Age at Onset in Patients With Myasthenia Gravis. Neurology. 2025;105(12):e214428. doi:10.1212/WNL.0000000000214428
28. Andrade R, Marques Junior W, Vasconcelos L, et al. Patient journey and treatment pattern in myasthenia gravis: real-world data from the Brazilian public health system. Arq Neuropsiquiatr. 2025;83(9):1-10. doi:10.1055/s-0045-1811720
29. Zhang S, Wen Q, Su S, et al. Peripheral immune profiling highlights a dynamic role of low-density granulocytes in myasthenia gravis. J Autoimmun. 2025;152:103395. doi:10.1016/j.jaut.2025.103395
30. Wen Q, Zhang S, Wang Y, et al. Platelet activation plays a pro-inflammatory role in myasthenia gravis. Nat Commun. 2025;16(1):8779. doi:10.1038/s41467-025-63750-2
31. Stein M, Sun H, Lehnerer S, et al. Prediction of Myasthenia Gravis Worsening: A Machine Learning Algorithm Using Wearables and Patient-Reported Measures. Ann Clin Transl Neurol. Published online November 19, 2025. doi:10.1002/acn3.70257
32. Li X, Li Z, Zhang C, et al. Quality of life and social support as key determinants of anxiety and depression in Myasthenia Gravis: evidence from a Chinese cohort. Front Neurol. 2025;16:1670436. doi:10.3389/fneur.2025.1670436
33. Dodd KC, Clay FJ, Forbes AM, et al. Rituximab for myasthenia gravis. Cochrane Database Syst Rev. 2025;7(7):CD014574. doi:10.1002/14651858.CD014574.pub2
34. Wu J, Eriksson-Dufva A, Budzianowska A, et al. Rituximab in New-Onset Generalized Myasthenia Gravis: Long-Term Follow-Up of the RINOMAX Clinical Trial. Eur J Neurol. 2025;32(11):e70418. doi:10.1111/ene.70418
35. Zhang S, Song X, Wang AR, Zhang Z. Safety profile and efficacy of secukinumab in the treatment of autoimmune myasthenia gravis: a single-center retrospective study. Front Neurol. 2025;16:1642938. doi:10.3389/fneur.2025.1642938
36. Zhang Z, Dong J, Qiu M, Bai J, Cheng X, Song X. Single-Cell Immune Profiling Reveals Neutrophils Promote Myasthenia Gravis Exacerbation Through BAFF Secretion. Adv Sci (Weinh). 2025;12(45):e09260. doi:10.1002/advs.202509260
37. Sikorski PM, Kaminski HJ, Vincent A, Bauman T, Jacobson L, Kusner LL. Subtype-specific atypical B cell profiles in myasthenia gravis reveal distinct immunopathological pathways. Front Immunol. 2025;16:1608160. doi:10.3389/fimmu.2025.1608160
38. Fan M, Zhang H, Shi Y, et al. The prognosis of MG patients with different thymic pathology: a multicenter retrospective cohort study. BMC Med. 2025;23(1):685. doi:10.1186/s12916-025-04509-w
39. Tarasco MC, Rinaldi E, Frangiamore R, et al. Unknown Immunoregulatory Effects of FcRn Inhibition by Efgartigimod in Myasthenia Gravis: A New Mechanism of Action Beyond IgG Reduction. Neurol Neuroimmunol Neuroinflamm. 2025;12(5):e200455. doi:10.1212/NXI.0000000000200455
40. 中华医学会神经病学分会神经免疫学组.中国重症肌无力诊断和治疗指南(2025版)[J].中华神经科杂志, 2025, 58(07):721-741.DOI:10.3760/cma.j.cn113694-20250120-00041.
查看更多