查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





结直肠癌是世界上最常见的恶性肿瘤之一,我国结直肠癌的发病率和死亡率仍处于上升趋势。
以往,结直肠癌的研究主要依靠细胞系和异种移植模型,但二者都有一定的局限性,且难以建立大规模生物样本库。
类器官模型是一种新兴的体外模型,具有构建周期较短、易于保存以及保留供体异质性的特点,在结直肠癌的基础研究、新药开发、个体化治疗等方面都极具应用价值。它的出现使得我们可以在体外更加高效且真实地模拟肿瘤在体内的各方面特性,为基础研究及其向临床应用的转化提供了更加先进的工具和桥梁。
类器官的出现和发展
2009年,Hans Clevers团队在《自然》(Nature)杂志上发表突破性成果,首次在外体培育出了结直肠上皮类器官。文中,研究者将肠上皮组织消化为肠隐窝结构或单个Lgr5+干细胞,并包裹于基质胶(matrigel)中,再加入含有表皮细胞生长因子(EGF)、Wnt信号通路相关蛋白R-spondin 1、Noggin蛋白的培养基进行培养。由于Matrigel具有支撑作用,利用肠隐窝底部Lgr5+干细胞的增殖分化能力,消化获得的肠隐窝结构或单个Lgr5+干细胞能够向各个方向生长,从而形成了包含肠上皮隐窝和绒毛样结构的3D组织球。经免疫荧光染色、免疫组化及电镜观察,发现其中包含了肠上皮细胞、杯状细胞、潘氏细胞、肠内分泌细胞以及Lgr5+干细胞等多种细胞种类,并具有肠上皮相似的结构。
至2014年,已有包括肠、肝、胃、脑、肾、心脏、皮肤等在内的多种器官被成功培育出类器官模型。这些类器官模型的共同特点都包括:由相应供体器官的多种特征性细胞构成,相比单细胞模型能够更好地模拟供体器官的特性;具有供体器官的部分功能,如排泄、过滤、收缩、神经活动等;与供体器官具有相似的组织排列形态和空间结构。
基于此,类器官模型相比传统的细胞和动物模型展现出了诸多优势,并且由于其建立更为简便高效,可能成为传统模型难以解决的科学问题的新型研究工具。例如,人脑类器官可以用于研究神经干细胞独特的分裂方式;视网膜类器官已被用于研究人与实验动物视网膜组织形态发生的区别;胃肠道类器官则已被用于研究人与实验动物胃肠道各器官在发育过程中功能的协调发展。此外类器官在多种疾病的发生机制及治疗的研究中也具有很大的潜力,可以构建疾病模型,进行化疗药物敏感性及安全性测试等。
除了使用临床组织样本培养类器官,目前已有研究团队成功构建了利用分化的人胚胎干细胞以及诱导多能干细胞诱导培养结肠类器官的体系,为未来类器官的发展提供了更多的可能。
结直肠癌类器官生物样本库的建立和发展
在以往的癌症研究中,细胞系是最常用的体外模型,可以进行高通量的药物敏感性测试并将其与基因组的改变相关联。但细胞系往往已经失去原始供体的基因组特征,不具备个体异质性,这给精确预测具体患者对特定药物的敏感性带来了困难。运用人源肿瘤异种移植模型(PDX)可以很好地解决这一问题,将供体的原位肿瘤移植入免疫缺陷动物,可最大化地保留供体的异质性。
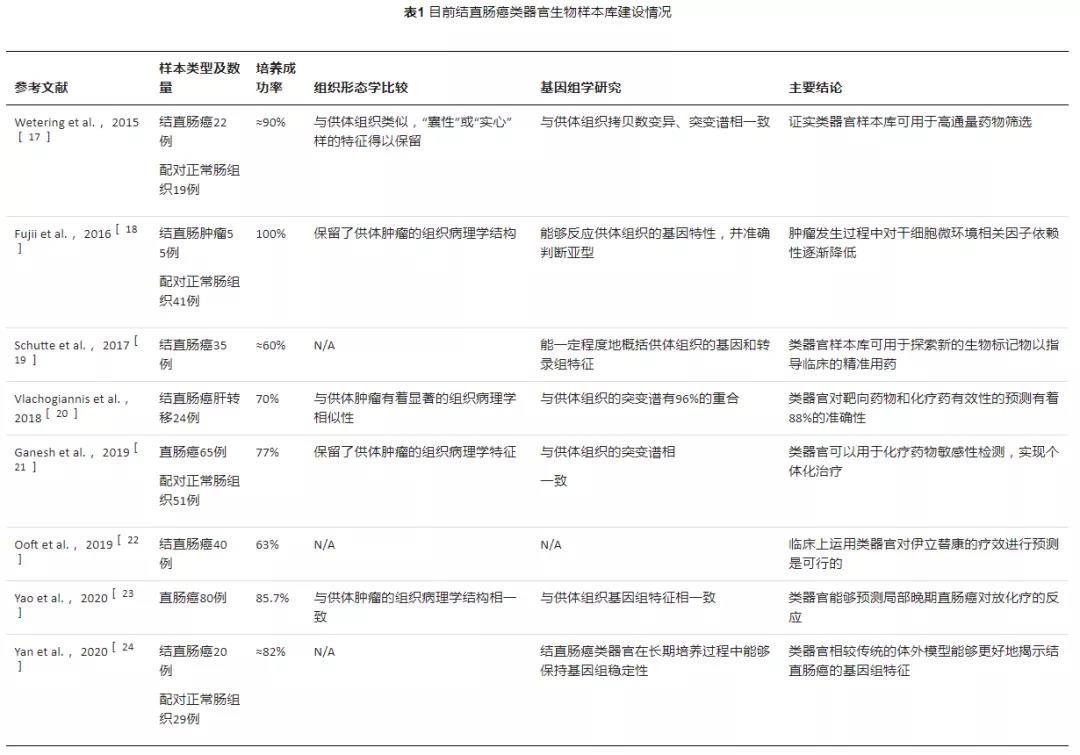
但PDX模型的建立需要时间较长,且需要高昂的费用,不利于高通量的药物筛选。2015年,Hans Clevers团队首次建立了结直肠癌类器官生物样本库,他们用27例手术切除的结直肠癌样本成功培育出了22例结直肠癌类器官,总体成功率达90%,并且经传代后均可冻存,复苏后的成活率可达80%以上。通过对供体组织样本及所培养的类器官进行固定、切片及H&E染色后对比发现,正常肠上皮组织来源的类器官形态较规则,中空有腔并有绒毛、隐窝样结构。而结直肠癌组织来源的类器官则很大程度上保留了供体组织的形态学特征,如薄壁的囊性结构或没有空腔的紧密型结构。之后分别提取类器官及其相应供体活检组织的基因组DNA,进行全外显子组测序,发现类器官每Mb碱基对的平均突变率与供体活检组织相似,且突变主要为CpG向T的突变,与结直肠癌的大规模测序结果相一致。转录组分析显示不同类器官在基因表达上具有细微的差异,说明了类器官之间具有异质性。基于此,Hans Clevers团队组织成立了非营利机构Hubrecht Organioid Technology (HUB),以进一步扩大结直肠癌和其他类型类器官生物样本库的规模。
此后,又有多个结直肠癌样本库被建成(见
结直肠癌类器官生物样本库的应用
近年来,由于法规的完善以及越来越严格的临床试验标准,前期基础研究所开发的抗癌药物大部分无法通过临床试验最终进入临床使用,导致研发成本急剧升高。
其中,影响最为显著的因素是在药物的前期开发过程中没有合适的临床前模型进行药物疗效的评价,导致多数药物虽然在基础研究中显示出良好的效果,但应用于人体后却无法达到满意的疗效。通过收集临床样本建立大型结直肠癌类器官生物样本库,并记录每个患者的基线资料,除了可以对这些类器官进行基因组测序和表达谱分析外,在抗癌药物开发的基础和临床研究中可以起到重要的作用,可以帮助发现新颖的抗癌化合物,探索全新的治疗策略。使用类器官模型进行抗癌药物的开发能够更好地模拟人体对于药物的反应,更准确地评价治疗效果,减少后期临床试验失败的风险,同时节省研发时间,降低研发成本,目前已经得到了越来越广泛的使用。
类器官作为极具潜力的临床前模型,在药物敏感性检测方面已有较多应用。Schutte等建立了1个大型结直肠癌生物样本库,其中包含了35例类器官样本及59例PDX样本,并通过基因组测序验证了这些模型都很好地反映了供体肿瘤组织的表型特征。此研究发现了不同来源肿瘤的异质性如EGFR、PTCH1等基因的突变可能影响到药物的治疗效果,这也印证了类器官模型对供体组织异质性的保留。
Ganesh等建立了包含65例直肠癌类器官的样本库,进行体外放化疗干预后的类器官模型显示出了与临床患者相一致的反应。并且将类器官移植入实验动物体内再进行相同手段干预后,可以观察到相一致的结果,显示出了类器官模型在药敏检测中良好的应用前景。
Yao等运用局部进展期直肠癌(LARC)且接受了新辅助放化疗(NACR)患者的临床组织样本构建了包含80例类器官的生物样本库,基于此样本库发现类器官可以预测患者对放疗、5-Fu、CPT-11的敏感性,识别适合进行新辅助放化疗的患者,指导临床治疗。对于部分对放化疗不敏感的患者,类器官也可以帮助选择合适的靶向药物或新型药物,避免过度治疗并减少治疗的副作用。该研究所进行的类器官培养及干预反应检测均可以在4周内完成,证明了类器官模型可以在短时间内对临床用药作出有意义的指导。
Vlachogiannis等构建了包含24例结直肠癌类器官在内的生物样本库,经过对类器官模型、动物移植瘤模型药敏检测结果以及临床患者药物反应进行比较,发现类器官预测患者对靶向药物或化疗药物的反应具有100%的敏感性和93%的特异性,准确性达到88%,且具有100%的阴性预测率。
Narasimhan等对腹膜转移的结直肠癌组织进行类器官培养,并进行基因测序及中通量药敏测试。结果发现药物对腹膜转移的结直肠癌的反应性与患者特定的基因组改变相一致,显示类器官平台可以作为药敏检测的平台,从而指导预后不良的结直肠癌患者进行个体化治疗。总而言之,在临床实践中对于需要进行化疗或靶向药物治疗的结直肠癌患者,可以对其活检或手术切除组织进行类器官培养,高通量的进行药物敏感性检测,针对个体选择更为敏感的药物组合方案,从而提高治疗的效果,更符合个体化治疗的发展趋势,具有很高的临床应用价值。
由于结直肠癌是一种异质性疾病,不同患者的临床表现和预后都各不相同,所以,类器官在结直肠癌发生与发展的基础研究中有很高的应用前景。
Fujii等构建了包含55例样本的结直肠癌生物样本库,其供体组织包含了多种组织学亚型及临床阶段。无论在体外培养或移植到免疫缺陷小鼠体内培养,类器官均表现出了与供体组织相似的病理分期和分化能力。在结直肠肿瘤从正常组织向腺瘤转变以及从腺瘤组织向腺癌转变的过程中,对局部微环境的依赖性降低,产生这种变化主要是由基因突变导致的,且能够加速局部的癌变过程。而对于进展期的结直肠癌类器官,其生物学行为的改变如对BMP/TGF-β的抵抗以及获得转移的能力,被发现与基因组的改变没有直接的关联。未来利用更先进的基因分析技术可能会发现对结直肠癌进展有重大影响的遗传学改变,而类器官模型则可以成为连接生物学与遗传学的主要桥梁。早发性结直肠癌(EOCRC)的预后较差,且难以用细胞和动物模型进行研究。Drost等运用CRISPR-Cas9技术在人结直肠类器官上对最常见的结直肠癌突变基因进行靶向修饰,证实类器官模型可以作为结直肠癌发生研究的重要工具。
Takeda等则运用CRISPR-Cas9技术干预结直肠癌类器官,构建了对结直肠癌发生相关基因进行功能验证的平台,并且可以进一步推广至其他类型的肿瘤中。Yan等利用EOCRC患者的临床组织样本培养了49例类器官,并对其进行了外显子组及转录组测序,寻找EOCRC中的关键突变以及转录组的变化。该团队发现了在EOCRC类器官中就包含了PTPRK-RSPO3融合在内的多种表型特征。而从转录角度,与APC突变型类器官相比,RSPO融合型与正常肠组织类器官更为相似,表现为BMP2高表达且依赖于BMP/SMAD通路的失活,且表达较少的干细胞标志物PTK7,单细胞转录组分析也证实了这一结果。通过对EOCRC和正常肠类器官的长期培养,相较于正常肠癌类器官,EOCRC类器官的稳定性更强,这一特性对CRISPR-Cas9技术的合理使用有所帮助。此外,这些发现对正在进行临床试验的Wnt分泌抑制剂、RSPO、PTK7靶向药物对RSPO融合型及APC突变型结直肠癌的不同应用作出了一定的指导作用。
小结
结直肠癌类器官生物样本库的建立和应用为结直肠癌的基础研究、药物开发、个体化治疗提供了更为可靠的工具,相较于传统的疾病模型具有诸多优势。但结直肠癌类器官生物样本库的进一步推广应用仍存在一定的挑战。
例如,类器官培养的技术相对复杂,对技术人员的操作要求较高;类器官培养虽然相较于构建PDX模型成本较低,但建立大规模的生物样本库仍然需要较高的费用投入;目前结直肠癌类器官主要以上皮组织培养为主,还缺乏成熟的包含基质及免疫系统的培养体系,需要进一步研究探索。
总而言之,类器官技术的出现以及结直肠癌类器官生物样本库的建立和应用有望建立结直肠癌基础研究与临床试验的直接联系,补充以细胞系和PDX模型为基础的药物研究的不足,进一步推动结直肠癌的个体化治疗。

引用本文:
王一, 吴小倩, 黄伟芳, 裴斌, 尚芳, 孔德松, 王小峰, 朱勇, 姚航, 刘飞, 樊志敏. 结直肠癌类器官生物样本库的建立和应用研究进展[J/OL]. 中华结直肠疾病电子杂志, 2021, 10(03): 302-305. DOI: 10.3877/cma.j.issn.2095-3224.2021.03.014
中华结直肠疾病电子杂志 平台发布
查看更多