查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:东部战区总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所 胡娜娜 许书添 董建华 李世军 刘志红
男性,32岁,因“肾移植术后5月余,发热5天,胸闷1天”于2017年5月25日入院。
患者2016年12月因慢性肾脏病(CKD)5D期于外院行右侧同种异体肾移植术[心脏死亡器官捐献(DCD)供肾],术后予更昔洛韦100mg/d静滴12天,甲泼尼龙16mg/d、他克莫司14mg/d、吗替麦考酚酯1.5g/d抗排斥治疗。患者尿量增多,血肌酐降至正常,血红蛋白110g/L,监测他克莫司血药谷浓度8.2ng/ml,调整他克莫司为15mg/d,并口服黄连素增加血药浓度。2017年2月,患者血肌酐升高至169μmol/L,血红蛋白逐渐降至57g/L,病程中无血尿、黑便、痰中带血等,反复输血以纠正贫血。4月初调整免疫抑制剂为甲泼尼龙16mg/d、环孢素A250mg/d、吗替麦考酚酯0.5g/d,肾功能、贫血无明显改善。4月26日住院行骨穿示粒细胞系反应性改变,红系增生减低;行移植肾穿刺活检示移植后临界性排斥反应,胸部CT示肺部感染,血肌酐升至225μmol/L,予哌拉西林/他唑巴坦、莫西沙星抗感染,甲泼尼龙500mg/d×3d冲击,输注红细胞(11U)纠正贫血等治疗,血肌酐降至179μmol/L、血红蛋白升至72g/L,后出院再次门诊输注红细胞6U。5月20日出现发热,体温最高41℃,伴畏寒,活动后胸闷,无寒战,无咳嗽咳痰。24日至我院就诊,查C反应蛋白76.2mg/L,降钙素原0.576μg/L,为进一步诊治入院。
患者入院前精神食欲正常,24h尿量3000ml左右,大便正常,体重稳定(图1)。
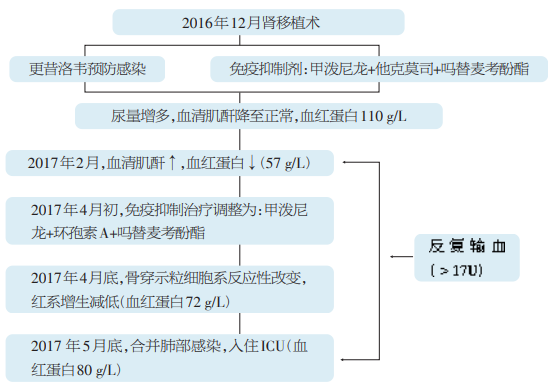
图1 患者肾移植术后病程
高血压病病史6年余,目前口服氨氯地平、美托洛尔缓释片降压。2015年因双下肢浮肿,伴恶心呕吐,血肌酐1200 μmol/L,予急诊连续肾脏替代治疗(CRRT),2015年7月行左前臂动静脉内瘘成形术,开始接受维持性血液透析。吸烟史19年,饮酒史10年,1年前戒烟戒酒。个人史、婚育史及家族史无特殊。
体温37.3℃,脉搏96次/分,呼吸22次/分,血压 144/83mmHg,脉氧95%;体质指数26.9kg/m2;神志清楚,精神可,颜面部及颈胸部散在皮疹;心肺查体未及异常;腹软,无压痛、反跳 痛,肝脾肋下未触及;右下腹见一长约12cm的手术瘢痕,可触及移植肾,大小约10cm×5cm,质中,无压痛,边界清,未闻及血管杂音;左前臂可见动静脉内瘘手术疤痕,听诊无杂音,未触及震颤,双下肢不肿。
尿液 尿蛋白定量1.76g/24h(尿量2200ml/24h),尿红细胞9/μl,尿白细胞5.3/μl,尿糖阴性,中性粒细胞明胶酶相关脂质运载蛋白(NGAL)403.8ng/ml,白介素-18613.12ng/L,N-乙酰-β2-葡萄糖苷酶(NAG)24.1U/(g.cr),视黄醇结合蛋白(RBP)8mg/L,溶菌酶1.49mg/L,尿α2微球蛋白(α2-m)2mg/L,尿C32mg/L。
血液 血红蛋白80g/L,平均红细胞容积(MCV)89.6fl,平均红细胞血红蛋白量(MCH)29.9pg,平均血红蛋白浓度(MCHC)320g/L,网织红细胞绝对值2.8×109/L,血白细胞4.1×109/L,中性粒细胞百分数80.8%,淋巴细胞百分数8.3%,单核细胞百分数7%,血小板158×109/L。C反应蛋白175.7mg/L,降钙素原1.5μg/L,白蛋白31g/L,球蛋白22.4g/L,尿素12.9mmol/L,肌酐184μmol/L,尿酸439μmol/L,丙氨酸氨基转移酶117U/L,天冬氨酸氨基转移酶48U/L,乳酸脱氢酶913U/L,总二氧化碳17.2mmol/L,钾3.5mmol/L,钠140.1mmol/L,氯108mmol/L,钙2.22mmol/L,磷1mmol/L,脑利钠肽前体551.7pmol/L,空腹血糖9.2mmol/L,餐后2小时血糖19.3mmol/L,糖化血红蛋白7.2%。铁13μmol/L、总铁结合力24μmol/L、不饱和铁结合力11μmol/L;叶酸6.1nmol/L、维生素B12627pmol/L。
免疫学检查免 疫球蛋白:IgG5.83g/L、IgA0.609g/L、IgE<20IU/ml、IgM1.53g/L、抗链球菌溶血素O(ASO)<25IU/ml、类风湿因子(RF)<20IU/ml;外周血淋巴细胞亚型:CD3447个/μl,213个/μl,CD8227个/μl,CD4+/CD8+0.94;抗人球蛋白试验(Coomb's试验)阴性;群体反应性抗体(Ⅰ类抗原、Ⅱ类抗原)均阴性。
病原学检查 真菌1,3-β-D葡聚糖试验(G试验)416.9pg/ml。真菌1,3-β-D葡聚糖试验(GM试验)、结核感染T细胞斑点试验、呼吸道病原体检测均阴性。巨细胞病毒DNA<500copies/ml。
心电图 正常。
胸部CT 两肺间质性炎症,双侧胸膜增厚;纵隔淋巴结增大;主动脉及冠状动脉粥样硬化。
移植肾超声 移植肾大小约114cm×67cm×60cm,各级动脉阻力指数增高。
患者为青年男性,肾移植术后5月余,术后应用更昔洛韦预防感染,应用激素、他克莫司、吗替麦考酚酯抗排斥,且他克莫司血药浓度长期处于较高水平。
血肌酐逐渐升高,移植肾活检示临界性排斥反应,甲泼尼龙冲击后肾功能未见明显改善;血红蛋白进行性下降,反复输血、注射红细胞生成素后,血红蛋白不稳定,骨髓示红系增生减低;发热、胸闷、感染指标升高,CT示双肺间质性病变,存在肺部感染。
患者存在顽固性贫血,考虑以下原因:
溶血性贫血 患者血红蛋白进行性下降,为正细胞正色素性,需考虑溶血性贫血,但通过免疫抑制方案的调整无明显效果,仍表现为慢性贫血、移植肾功能不全,结合患者病史特点,入院后体格检查示无黄疸、肝脾肿大,实验室检查示网织红细胞降低,骨髓示红系增生减低,且Coomb's试验阴性并不支持,溶血性贫血可排除。
营养不良性贫血 患者长期血液透析,饮食控制严格,需考虑营养不良性贫血,但血常规示正细胞正色素性贫血,且铁代谢、叶酸、维生素B12无异常并不支持,可除外缺铁性贫血及巨幼细胞贫血。
肾性贫血 患者移植肾功能不全,需考虑到红细胞生成素减少导致贫血,但患者的贫血与血肌酐升高程度不平行,且予以外源性注射红细胞生成素后贫血无改善,也并不支持,肾性贫血可排除。
失血性贫血 患者血红蛋白进行性下降,反复输血后无好转,需考虑失血性贫血,但病程中无血尿、黑便、痰中带血等症状,实验室检查大便潜血阴性、尿红细胞计数基本正常并不支持,可排除失血性贫血。
纯红细胞再生障碍性贫血 患者完善骨穿示红系增生减少,粒系、巨核系未见异常,结合网织红细胞绝对值减少,白细胞、血小板正常,提示纯红细胞再生障碍性贫血。患者为肾移植术后,长期服用大剂量免疫抑制剂,无长期使用红细胞生成素注射剂史,排除了胸腺瘤、巨细胞病毒、EB病毒感染等可能,应考虑人细小病毒(HPV)B19可能,遂完善相关检查,HPVB19DNA>1×108copies/ml,明确诊断为HPVB19致纯红细胞再生障碍性贫血。
患者诊断为:① 右侧 同种异体肾移植术后,移植 肾功能不全;②人细小病毒 B19感染(纯红细胞再生障碍性贫血);③肺部感染;④ 移植后糖尿病。
患者入院后停用环孢素A、吗替麦考酚酯,予甲泼尼龙80mg/d,复方磺胺甲喏恶唑片、比阿培南抗感染,及吸氧、降压、降糖、保肝等治疗。患者HPVB19明显复制,考虑病毒致纯红细胞再生障碍性贫血,予人免疫球蛋白10g×10d静滴。患者体温降至正常,感染指标下降,复查CT示肺内病变较前吸收,网织红细胞升高,血红蛋白稳定,骨穿示红系增生活跃,HPVB19DNA降至1.36×104copies/ml,停用抗生素,甲泼尼龙减量至40mg/d,加用咪唑立宾150mg/d抑制免疫。出院时血红蛋白81g/L,网织红细胞258.5×109/L,肌酐162μmol/L。院外加用环孢素A、吗替麦考酚酯,2017年7月25日复查血红蛋白升至141g/L(图2)。
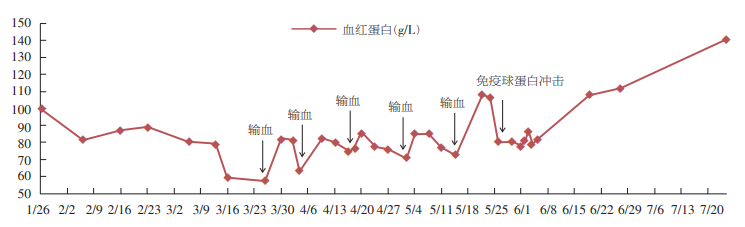
图2 患者血红蛋白变化
HPVB19是一种小而无包膜的单链线性DNA病毒,属于细小病毒科家族。它是已知可感染人类的最小DNA病毒之一。作为红病毒属的原型,HPVB19对人红系细胞有特嗜性。宿主范围非常有限是所有红病毒属的独有特征,特别是HPVB19,人类是其唯一已知宿主。HPVB19与红细胞膜上的糖苷酯即P血型抗原结合,该抗原在红细胞、红细胞前体细胞、胎盘及胎儿组织的红细胞均有发现。
HPVB19感染在世界范围内都很常见,可散发或集中爆发,其特异性抗体的存在有年龄差异性,5岁以下幼儿为2%~20%,5~18岁未成年人为15%~40%,而成人则为40%~80%。HPVB19感染最常见于儿童阶段,半数15岁儿童存在提示既往感染的血清学证据。超过70%成人B19-IgG抗体阳性,包括肾移植患者。
HPVB19通过感染者的呼吸道分泌物传播,与病人亲密接触及污染物接触是病毒传播的途径。医院内传播也有发生。HPVB19可通过胎盘途径垂直传播,也可通过输血及器官、组织移植传播。在一项对儿童移植肾的研究中发现,接受血清学HPVB19+供肾,而自身HPVB19-的受者,移植肾活检中可检出HPVB19,表明感染的同种异体移植物可传播病毒。因缺乏监察性研究,目前肾移植后HPVB19感染率并不明确。一个单中心研究显示,12%有明显贫血的肾移植患者外周血中发现HPVB19。研究显示,感染率波动于3%~58.7%,也有研究未发现病毒感染。感染率的显著差异可能与季节变化、病例聚集度、诊断标准及敏感性特异性、移植操作不同及患者人群的不同有关。血液中存在低水平HPVB19DNA可能无意义,只有高水平的患者才有临床相关贫血表现(一项研究中界定为>106copies)。
急性HPVB19感染标后,免疫功能正常者会产生中和抗体,短暂、高水平病毒血症存在不到一个星期,然后特异性IgM抗体滴度在8~10周后下降,并产生终身特异性IgG抗体。然而,在免疫功能低下的患者中,感染可能会因无法产生中和抗体清除病毒而持续存在,致慢性HPVB19感染或进行性贫血。
HPVB19感染的临床表现是感染性红斑(也称为第五疾病——在具有免疫力的患儿表现为以皮疹为特点的发热性疾病)、关节病(特别常见于原发性感染的成人)、胎儿水肿(胎儿宫内感染时可导致胎儿死亡),以及显著贫血(再生障碍性危象和纯红细胞发育不良,有时伴有其他细胞系紊乱,例如白细胞)(表1)。实际上,有研究发现HPVB19感染可累及多种细胞,例如巨细胞、肝细胞、心肌细胞、脑细胞等,而导致血小板减少、肝炎、心肌炎和脑炎等。
HPVB19在骨髓和血液中的红细胞前体细胞中复制从而导致其破坏,对细胞系产生直接细胞毒性作用。慢性HPVB19感染常见于肾移植和其他免疫功能低下的患者,最常见的临床表现为纯红细胞再生障碍。
在一项包括98例HPVB19感染的肾移植患者大型研究中,99%的患者反复发生严重贫血,白血病及血小板减少的发生率分别为38%和21%。其他的临床表现有发热、关节痛和皮疹。
在肾移植患者中也报报道有肝炎、肺炎及神经系统疾病并发症。在临床上,遇到严重贫血的,尤其是对于输注血制品及调整(或停止)骨髓抑制药物(例如复方新诺明、缬更昔洛韦和吗替麦考酚酯)后仍不缓解者,应高度怀疑HPVB19感染,应完善相关检测。
最常用的诊断方法包括血清学、核酸检测及骨髓检查。在急性原发性感染时,患者通常处于病毒血症状态。在患者的血液、骨髓或其他器官中直接检测病毒核酸是一种高度敏感且特异性的诊断方法。在感染早期血清中检测HPVB19-IgM可能是阴性结果,这是由于肾移植受者产生抗体的能力受到延迟和/或损害,特别是在服用大剂量免疫抑制剂的情况下。有研究显示,仅75%活动性HPVB19感染患者HPVB19-IgM阳性。
值得注意的是,在急性临床症状缓解后,HPVB19仍会持续一段时间,在被感染的红细胞内,病毒可持续存在3个月。因此,仅检测HPVB19DNA不能充分反映疾病活动性。诊断金标准仍是骨髓检查,即通过原位杂交和免疫组化检测病毒(表1)。HPVB19感染的特征性骨髓象为巨原红细胞,其胞浆呈细颗粒状,透明核内包涵体有一清晰的中央晕,且常会出现红细胞发育不全。
目前尚无批准用于治疗HPVB19感染的抗病毒药物。对于肾移植感染HPVB19的患者,主要治疗方法是静滴免疫球蛋白,但最适剂量和频率还未确定。多数文献报道的治疗方案是400mg/(kg.d×5d,但仍有1/3患者会复发。因此,应减少免疫抑制剂的使用以提高疗效和治愈率。由于HPVB19传染性很强,应预防院内传播,已感染的肾移植患者应放在防护的首位。同时妊娠或备孕人群也应避免接触HPVB19感染者,以免导致严重胎儿并发症。
表1 人细小病毒B19感染的临床表现及诊断
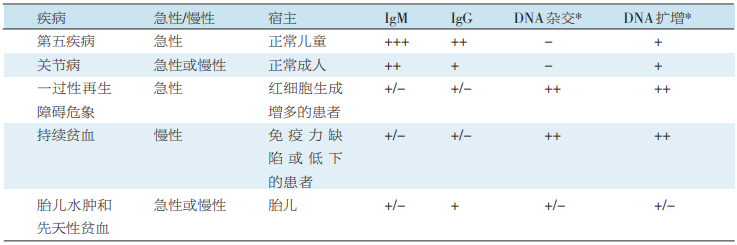
注:*DNA杂交方法的灵敏度大约为106 copies/ml,DNA扩增技术(聚合酶链反应)灵敏度为102 copies/ml。
小结
本例患者临床表现为顽固性贫血,对症治疗无效,骨髓示红系增生减低,血清核酸学检查示HPVB19DNA高滴度复制,最终诊断为HPVB19B19感染,经过静脉注射丙种球蛋白治疗,预后良好。因此,对于肾移植术后或其他免疫功能低下人群,如果出现不明原因的血红蛋白水平下降,应注意排除HPVB19感染,做到及时诊断和治疗,避免漏诊和误诊。

来源:《中国医学论坛报》2020年6月18日A10-A11
查看更多