查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近年来,以免疫检查点抑制剂(ICIs)为代表的免疫治疗极大地提高了晚期非小细胞肺癌(NSCLC)患者的生存获益。遗憾的是,与传统化疗相比,仅有约10%-40%的NSCLC患者能从PD-(L)1抑制剂治疗中获得明显疗效。组织PD-L1(tPD-L1)表达是目前临床实践中常用的生物标志物,然而其对于ICIs治疗的预测价值仍存在争议。究其原因,可能与PD-L1蛋白在肿瘤微环境(TME)中的表达具有异质性、既往治疗对tPD-L1表达存在影响以及检测主观性等因素相关。因此,寻找标准、可靠的生物标志物以筛选潜在ICIs获益人群仍是当前的研究重点。
近期,Frontiers in Immunology(IF=5.085)发表了陆军军医大学第二附属医院孙建国教授团队的研究成果,首次证实了血液PD-L1 mRNA的动态表达可以作为血液生物标志物,预测NSCLC患者ICIs的治疗获益。
孙建国 教授
陆军军医大学第二附属医院肿瘤研究所副所长
新桥医院肿瘤科副主任
博士,教授,主任医师,博导,斯坦福大学访问学者
国家重点研发计划首席专家
重庆市科技创新领军人才
中华医学会数字医学分会副主委
CSCO免疫治疗专委会委员
CSCO患教专委会秘书长
重庆市中西医结合学会肿瘤免疫治疗专委会主委
全军肿瘤学会放疗专委会青委副主委
国家重点研发计划1项,国家自然基金5项
军队医疗成果二等奖(第1)、重庆市科技进步一等奖(第5)
SCI 60余篇(单篇IF>15),主编《数字化智能放疗》专著1部
液体活检是获取肿瘤相关分子信息的一种新兴检测方法。液体活检的样本来源包括脑脊液、唾液、胸水、血液、腹水、尿液等。与组织活检相比,液体活检具有无创性和便捷性等优势,可以在患者ICIs治疗过程中重复取样,以动态监测治疗期间的分子变化,同时还可减少肿瘤异质性的影响。一些血液生物标志物,如血液TMB(bTMB)、衍生中性粒细胞/(白细胞-中性粒细胞)比值、血液外泌体PD-L1(exoPD-L1)蛋白表达以及可溶性PD-L1(sPD-L1),都被证实可以作为预测ICIs疗效的潜在生物标志物。然而,这些标志物在不同研究中呈现出不同结果。
本研究主要有两个方面的内容。一是探索初诊恶性肿瘤患者治疗前血液PD-L1(bPD-L1)与tPD-L1表达的相关性。二是通过动态监测接受ICIs治疗的NSCLC患者早期bPD-L1(包括PD-L1 mRNA、exoPD-L1和sPD-L1)的动态变化,探索bPD-L1作为生物标志物,对无进展生存期(PFS)、总生存期(OS)和最佳客观缓解率(bOR)的预测作用,探讨bPD-L1在ICIs治疗中的应用价值。
研究共纳入两个队列。第一个队列纳入33例NSCLC初诊患者,采取患者配对的肿瘤组织样本和血液样本。第二个队列包括40例接受PD-(L)1抑制剂治疗的晚期NSCLC患者,在基线和第1次用药后2个月时采取血液样本。
在33例晚期NSCLC患者中,tPD-L1表达阳性的患者有更高的PD-L1 mRNA表达,sPD-L1表达则与tPD-L1表达不相关。
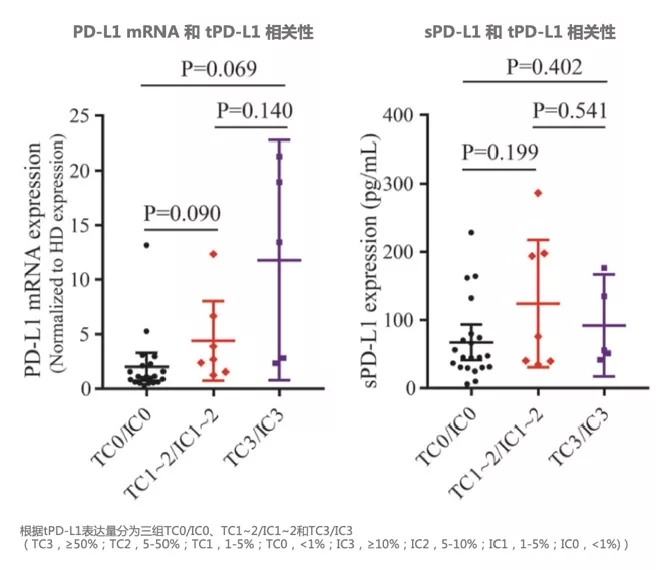
图:33例NSCLC患者bPD-L1表达和tPD-L1表达相关性(Adapted from Figure 1, Yang Q, et al. Front Immunol. 2021 Apr 16; 12: 665133.)
在40例晚期NSCLC患者队列中,基线和2个月时PD-L1 mRNA表达变化的最佳截断值为2.04倍。PD-L1 mRNA表达变化≥2.04倍和<2.04倍的患者中位PFS分别为10.0个月(95% CI:3.6-10.4个月)和4.2个月(95% CI:0.2-8.2个月),HR=0.373(95% CI:0.174-0.797,P=0.011);中位OS分别为19.0个月(95% CI:9.1-28.9个月)和7.0个月(95% CI:3.6-10.4个月),HR=0.281(95% CI:0.119-0.666,P=0.004);bOR分别为42.9%和10.5%(P=0.022)。
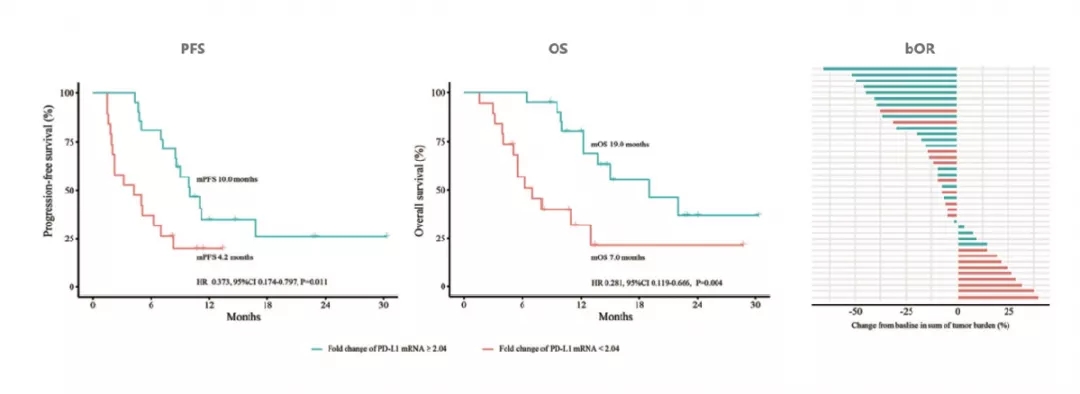
图:在40例NSCLC队列中,基于PD-L1 mRNA表达的动态变化预测PFS、OS和bOR(Adapted from Figure 3, Yang Q, et al. Front Immunol. 2021 Apr 16; 12: 665133.)
在40例晚期NSCLC患者中,其中21例还检测了exoPD-L1和sPD-L1的动态变化。与基线相比,2个月时exoPD-L1变化≥1.86倍的患者具有更长的PFS(9.9个月 vs 4.3个月,P=0.001;HR=0.165,95% CI:0.052-0.525,P=0.002)和OS(13.7个月 vs 6.3个月,P=0.004;HR=0.237,95% CI:0.082-0.684,P=0.008),以及更高的bOR(33.3% vs 11.1%,P=0.338)。而未发现能预测PFS、OS和bOR的sPD-L1最佳截断值。
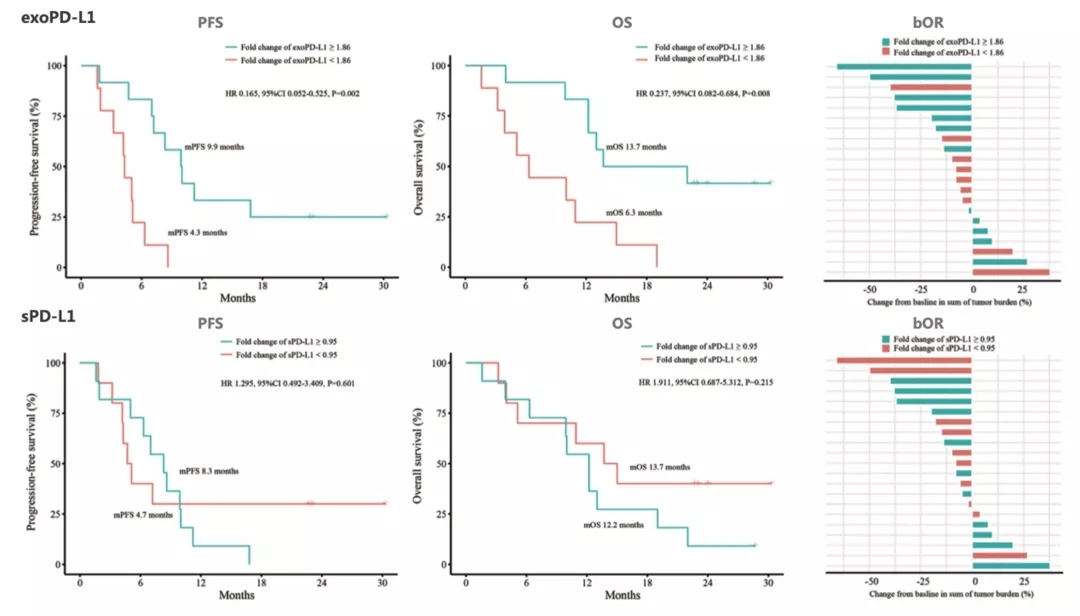
图:在21例NSCLC队列中,基于exoPD-L1和sPD-L1表达的动态变化预测PFS、OS和bOR(Adapted from Figure 4, Yang Q, et al. Front Immunol. 2021 Apr 16; 12: 665133.)
在21例晚期NSCLC患者队列中,联合PD-L1 mRNA和exoPD-L1可以更好地筛选获益亚群。与单一高组或联合低组相比,联合高组有更长的PFS(11.2个月 vs 7.0个月 vs 3.2个月,P<0.001)和OS(22.0个月 vs 13.0个月 vs 4.0个月,P<0.001)。联合高组和单一高组的bOR高于联合低组(33.3% vs 33.3% vs 0%,P=0.269)。
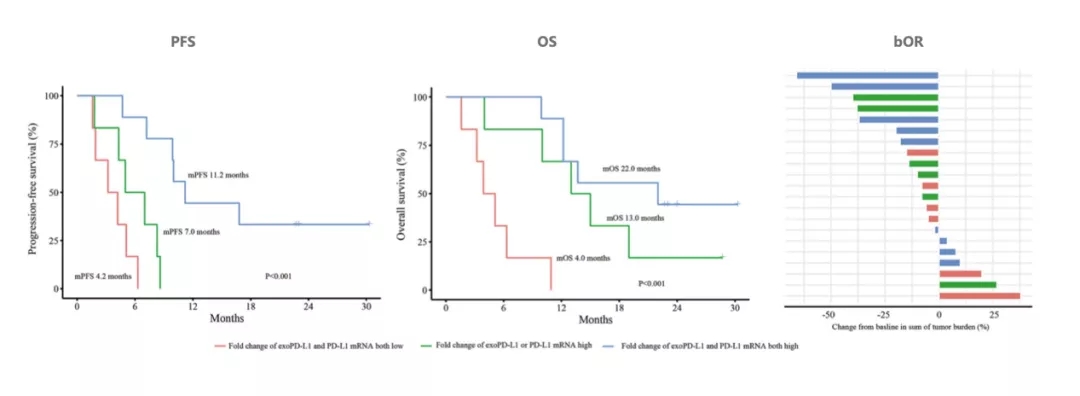
图:在21例NSCLC队列中,结合PD-L1 mRNA和exoPD-L1表达的动态变化预测PFS、OS和bOR(Adapted from Figure 5, Yang Q, et al. Front Immunol. 2021 Apr 16; 12: 665133.)
综上所述,该研究证实了血液PD-L1 mRNA和exoPD-L1的动态变化对接受ICIs治疗的晚期NSCLC患者的临床获益具有预测价值,结合这两种生物标志物可以更好地筛选获益亚群。同时,应关注到早期治疗期间PD-L1 mRNA和exoPD-L1变化幅度较小的患者可能出现潜在疾病进展,或许可以在其出现影像学进展前采用化疗、放疗或抗血管药物进行补充性干预。此外,通过建立血液mRNA检测的外参照专利产品,可能使血PD-L1 mRNA成为评估ICIs疗效的标准生物标志物。
参考文献:
Yang Q, et al. Novel Biomarkers of Dynamic Blood PD-L1 Expression for Immune Checkpoint Inhibitors in Advanced Non-Small-Cell Lung Cancer Patients. Front Immunol. 2021 Apr 16; 12: 665133.
审批号:MI-PD1-1622-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多