查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近年来国家高度重视医药产业的发展,出台了一系列政策支持药物研发,包括增加财政投入、优化药品审批流程、鼓励创新药物研发等。我国在抗癌药物、罕见病药物、生物技术药物等领域取得了突破性进展。许多国产创新药物成功上市,有的甚至获得了国际认可,进入全球市场。临床试验作为药物研发中的关键一环,也逐渐被大众所关注。中国医学论坛报社特别邀请郑州大学第一附属医院的王肖雲药师,谈谈从实验室到医患人员手中,药物和研发人员并肩作战的那些事儿。
研究人员通过多种方法(如化学合成、生物技术、药物筛选等)来发现和鉴定具有潜在治疗作用的化合物或分子。接下来进入临床前研究阶段,候选药物在体外实验(如细胞培养)和体内试验(如动物模型)中进行测试,以评估其安全性、毒性和药效学特性。医药企业建立符合GMP标准的药品生成条件,结合前述临床前数据结合拟解决临床问题,设计临床试验方案,提交药品监管部门批准。获得批准后,试验药物进入临床试验阶段,这是药物研发过程中的关键阶段,一般分三个阶段(Ⅰ、Ⅱ、Ⅲ期),验证药物的安全性和有效性。临床试验完成后,制药公司将根据试验结果向药品监管机构提交新药上市申请。监管机构会对药物的安全性、有效性和质量进行评估,并决定是否批准该药物上市。药物上市后,仍需持续监测其安全性和效果。这一阶段可能包括Ⅳ期临床试验和药物警戒活动,以收集和评估药物在实际使用中的长期效果和潜在风险。
临床试验在药物研发领域具有至关重要的作用和意义,其主要体现在以下几个方面:
临床试验是验证药物疗效的关键环节。通过与安慰剂或现有治疗方法的比较,研发人员可以确定新药是否有效,并评估其临床意义。
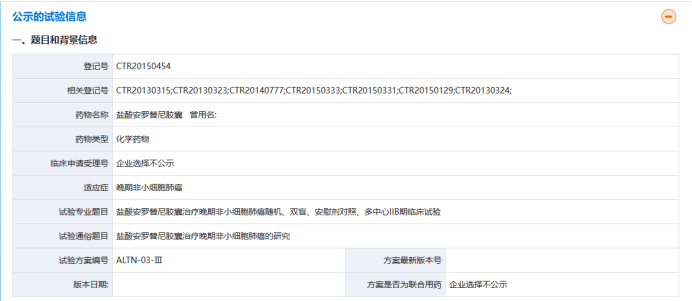
2018年5月小分子多靶点的受体酪氨酸激酶抑制剂盐酸安罗替尼胶囊(福可维)上市,用于治疗晚期或转移性非小细胞肺癌。盐酸安罗替尼胶囊属于我国自主研发的靶向创新药,通过优先审评审批程序获准上市。支持其上市的临床试验为盐酸安罗替尼胶囊治疗晚期非小细胞肺癌随机、双盲、安慰剂对照、多中心ⅡB期临床试验(CTR20150454),该项目2015年3月首例受试者入组,2017年10月结束,共入组受试者439人。
研发人员会探索不同剂量的药物对疾病的治疗效果和安全性的影响,以确定最佳剂量和给药方案。
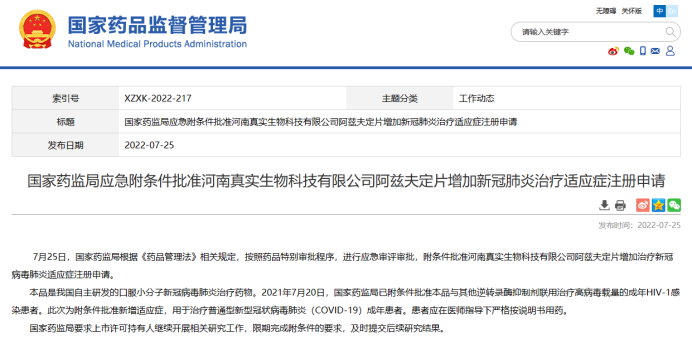
阿兹夫定(Azvudine)是新型核苷类逆转录酶和辅助蛋白Vif抑制剂,也是全球首个双靶点抗HIV-1药物。在多项抗HIV的临床试验中包含不同的剂量组:1mg、2mg、3mg和4mg。2021年7月国家药品监督管理局(NMPA)通过优先审评审批程序附条件批准河南真实生物科技有限公司申报的1类创新药阿兹夫定片上市,说明书中成年人的推荐剂量为每日3mg。同年,研发人员开展了评估阿兹夫定片治疗新型冠状病毒感染肺炎的成年患者的随机、双盲、平行、对照临床试验,使用的药物剂量为每日5mg。2022年7月,国家药品监督管理局附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应证注册申请。抗病毒药物“阿兹夫定”针对不同适应证,选择不同剂量的药物进行了评估,确定了最佳剂量以平衡疗效和安全性。
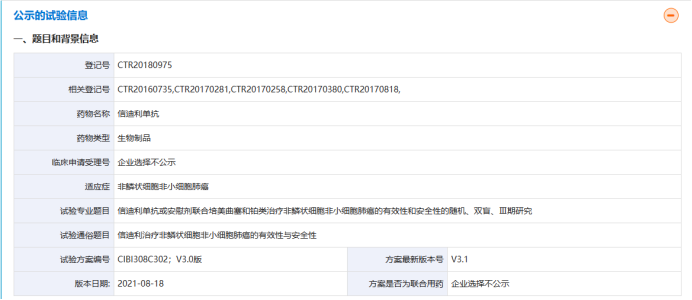
通过临床试验,研发人员可以探索药物在不同疾病或不同人群中的应用,拓展药物的适应证范围。2018年治疗霍奇金淋巴瘤的首个国产PD-1抗体药物信迪利单抗注射液获批上市“信迪利单抗”原本用于治疗霍奇金淋巴瘤,后经过临床试验,2021年2月,该药物也被国家药品监督管理局批准用于治疗非小细胞肺癌。

临床试验的结果为药物的临床应用提供了科学依据,包括用药指南、剂量推荐、注意事项等,以指导医生合理使用药物。抗HIV药物“特立普利”(Triumeq,含有阿巴卡韦、多替拉韦和拉米夫定)在临床试验中评估了不同的治疗方案,并根据试验结果更新了药物的使用指南,指导医生选择合适的治疗方案。Triumeq的获批,是基于2个关键性Ⅲ期研究的数据,之前未经治疗的成年患者参与的 Ⅲ 期研究 (SINGLE),患者分别给予多替拉韦和阿巴卡韦 / 拉米夫定。 阿巴卡韦、多替拉韦和拉米夫定组成的固定剂量的单一药片与 Dolutegravir 和阿巴卡韦 / 拉米夫定单独用药相比较的生物等效性研究。
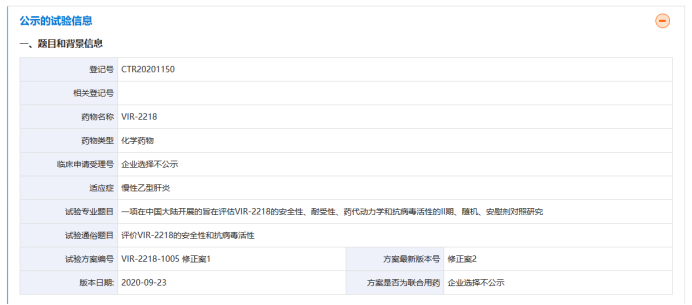
临床试验是医学研究的重要组成部分,通过新药的开发和评估,推动了医学知识的积累和医疗技术的进步。VIR-2218是Alnylam和Vir Biotechnology合作研发的RNAi类乙肝新药,一项在中国大陆开展的旨在评估VIR-2218的安全性、耐受性、药代动力学和抗病毒活性的Ⅱ期、随机、安慰剂对照研究(CTR20201150),基于该项临床试验的结果,提示VIR-2218可降低由慢性HBV感染引起的高病毒抗原负荷的新型药物,有潜力成为慢性HBV功能性治愈方案的基石,从而有助解决慢性HBV感染所带来的全球性重大公共卫生问题。
总体而言,临床试验是药物研发不可或缺的环节,它确保了药物的安全性和有效性,为药物的上市和临床应用提供了科学依据,同时也促进了整个医药行业和医学领域的发展。
王肖雲
主管药师
郑州大学第一附属医院

郑州大学第一附属医院临床试验机构办公室秘书
河南省医疗器械临床试验商会医疗器械临床试验专业委员会副秘书长
河南省药会药物临床试验专业委员会委员
河南省医学协会临床研究管理分会第一节委员会委员
中国药学会《中国临床药理学杂志》首届千人新苗青年委员会二区委员
近年来发表SCI论文3篇,中文核心期刊论文2篇,主导设计的数字化药物临床试验系统获得软件著作权2项。
协助机构负责人完成1项十三五重大专项新药临床评价平台建设课题的申请、实施和结题验收。
(本文版权属于中国医学论坛报社,转载须授权)
查看更多